よむ、つかう、まなぶ。
総-1参考1 (88 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64319.html |
| 出典情報 | 中央社会保険医療協議会 総会(第619回 10/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
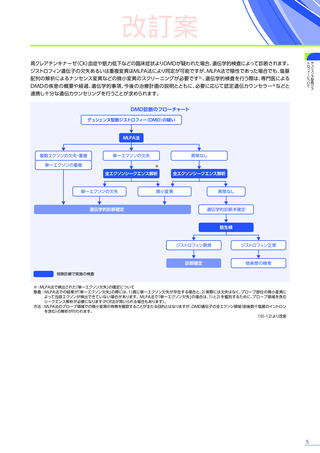
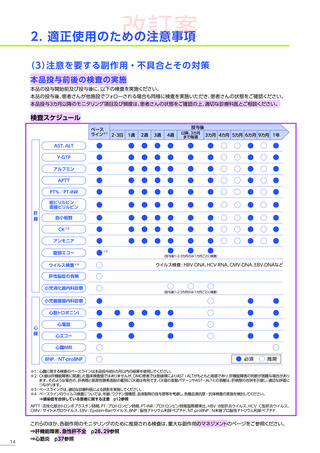
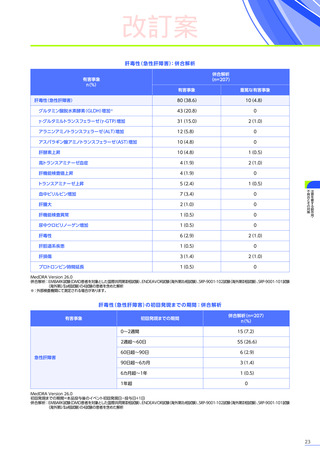
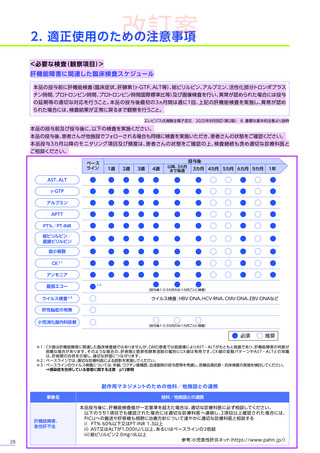
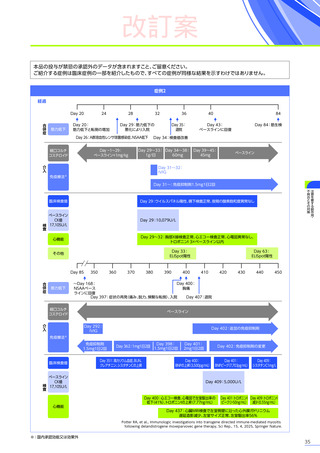
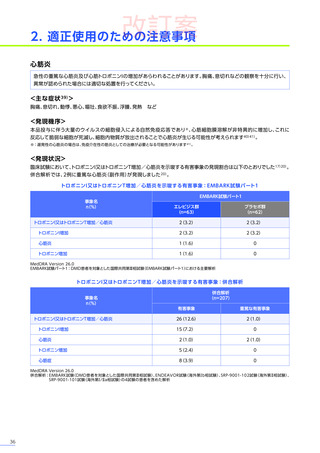
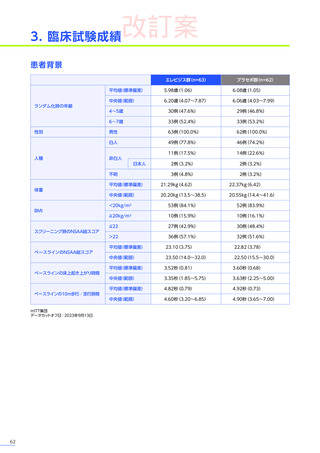
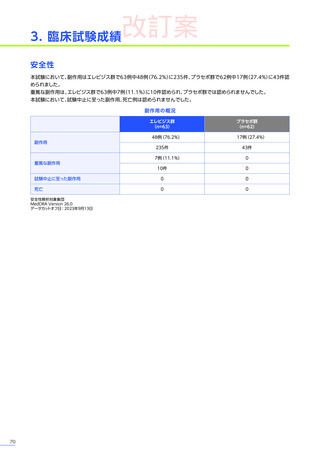
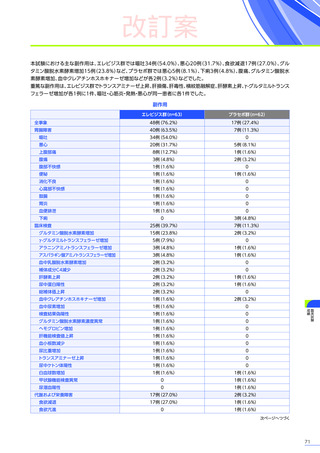
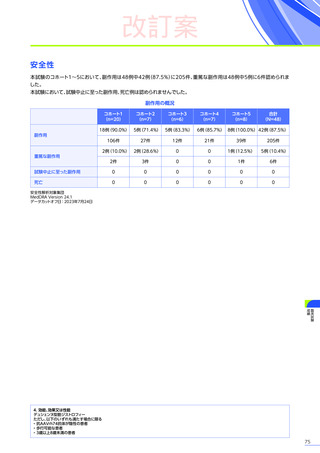
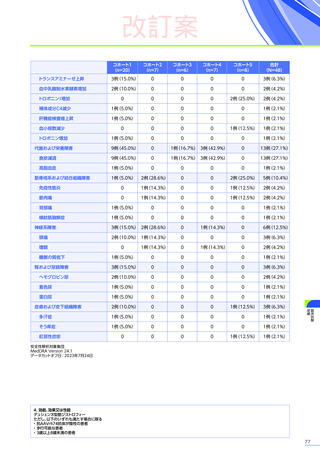
4. 副作用一覧
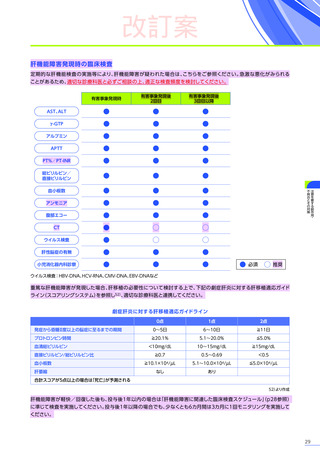
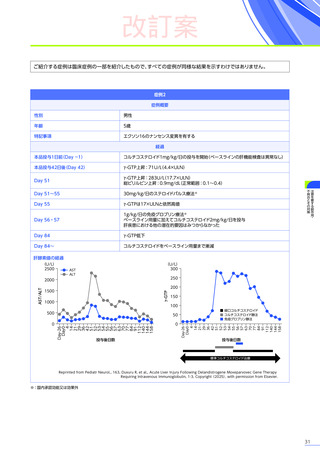
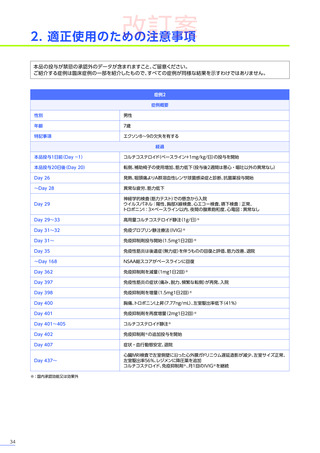
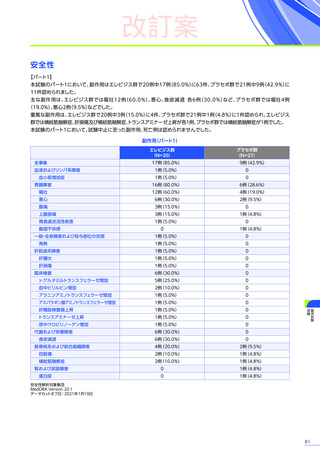
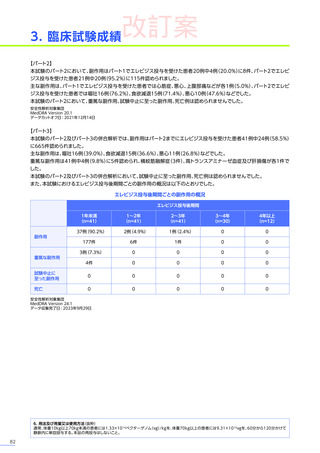
改訂案
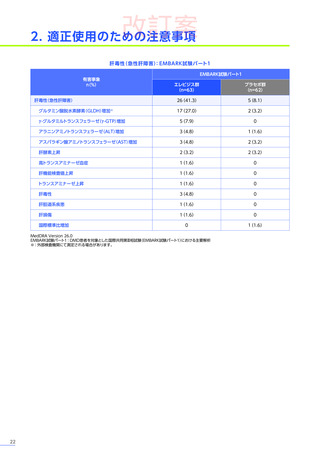
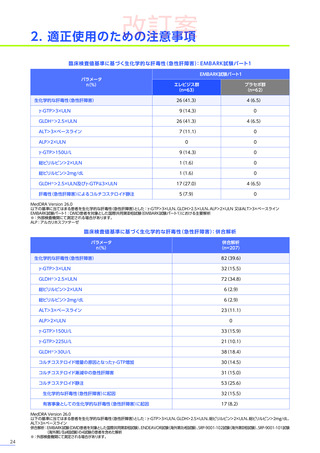
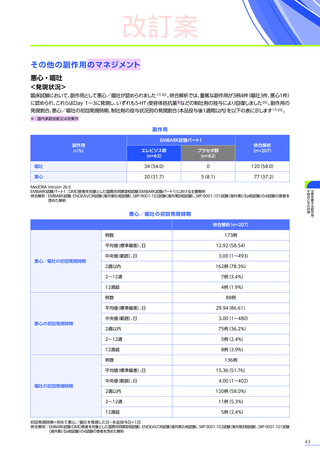
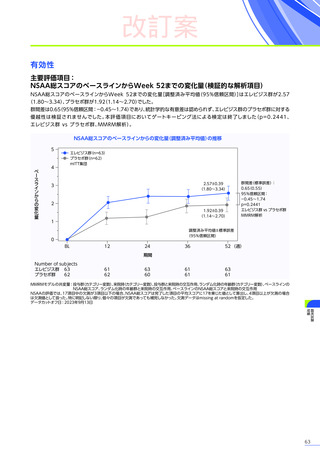
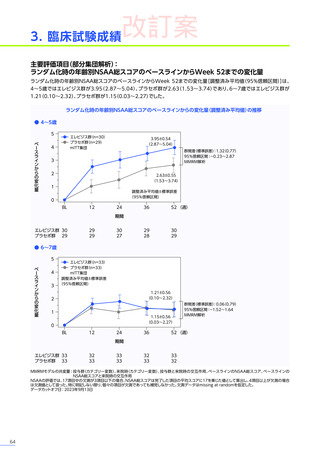
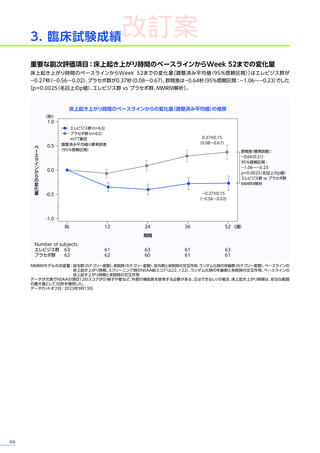
EMBARK試験
パート1
ENDEAVOR
試験
SRP-9001102試験
SRP-9001101試験
合計
n=63
(エレビジス群)
n=48
n=41
n=4
N=156
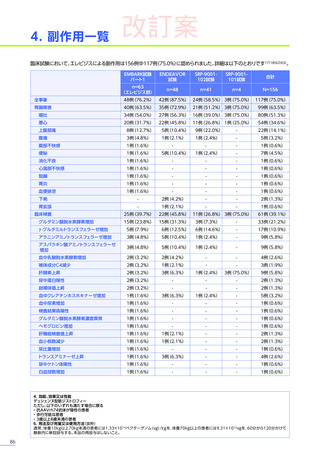
心臓障害
3例(4.8%)
1例(2.1%)
-
-
4例(2.6%)
心筋炎
1例(1.6%)
1例(2.1%)
-
-
2例(1.3%)
洞性頻脈
1例(1.6%)
-
-
-
1例(0.6%)
頻脈
1例(1.6%)
-
-
-
1例(0.6%)
心筋症
-
1例(2.1%)
-
-
1例(0.6%)
左室機能不全
-
1例(2.1%)
-
-
1例(0.6%)
腎および尿路障害
1例(1.6%)
3例(6.3%)
3例(7.3%)
-
7例(4.5%)
蛋白尿
1例(1.6%)
1例(2.1%)
-
-
2例(1.3%)
血尿
-
-
1例(2.4%)
-
1例(0.6%)
ヘモグロビン尿
-
2例(4.2%)
-
-
2例(1.3%)
着色尿
-
1例(2.1%)
-
-
1例(0.6%)
ケトン尿
-
-
2例(4.9%)
-
2例(1.3%)
-
-
1例(2.4%)
-
1例(0.6%)
1例(1.6%)
3例(6.3%)
-
-
4例(2.6%)
糖尿
皮膚および皮下組織障害
発疹
1例(1.6%)
-
-
-
1例(0.6%)
多汗症
-
1例(2.1%)
-
-
1例(0.6%)
そう痒症
-
1例(2.1%)
-
-
1例(0.6%)
紅斑性皮疹
-
1例(2.1%)
-
-
1例(0.6%)
血管障害
1例(1.6%)
-
-
-
1例(0.6%)
ほてり
1例(1.6%)
-
-
-
1例(0.6%)
-
6例(12.5%)
6例(14.6%)
-
12例(7.7%)
血小板減少症
-
5例(10.4%)
5例(12.2%)
-
10例(6.4%)
血小板増加症
-
1例(2.1%)
1例(2.4%)
-
2例(1.3%)
血液およびリンパ系障害
EMBARK試験パート1:安全性解析対象集団、MedDRA Version 26.0、データカットオフ日:2023年9月13日
ENDEAVOR試験:安全性解析対象集団、MedDRA Version 24.1、データカットオフ日:2023年7月24日
SRP-9001-102試験:安全性解析対象集団、MedDRA Version 24.1、データ収集完了日:2023年9月29日
SRP-9001-101試験:FAS、MedDRA Version 24.1、試験完了日:2023年4月25日
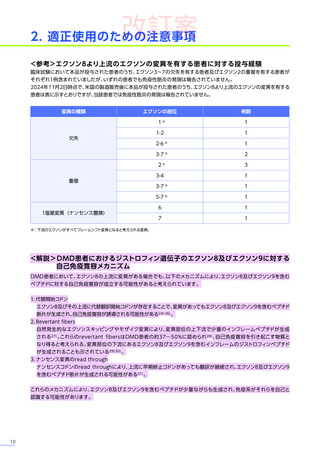
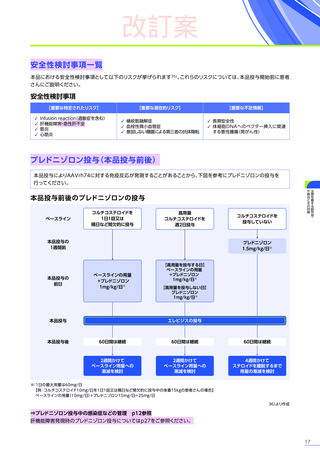
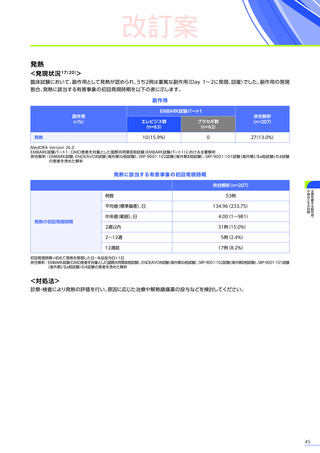
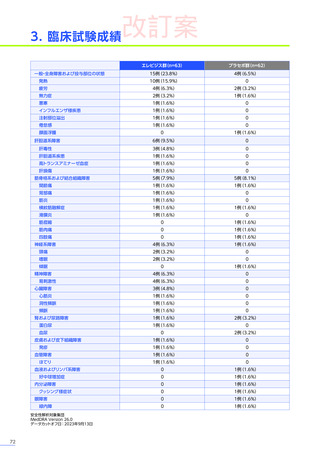
4. 効能、効果又は性能
デュシェンヌ型筋ジストロフィー
ただし、以下のいずれも満たす場合に限る
・ 抗AAVrh74抗体が陰性の患者
・ 歩行可能な患者
・ 3歳以上8歳未満の患者
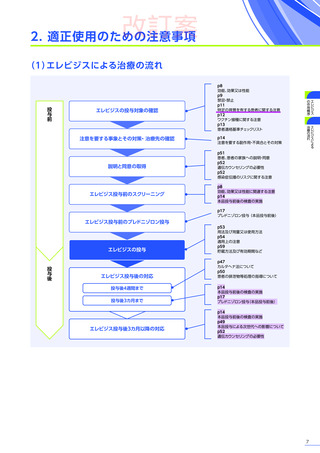
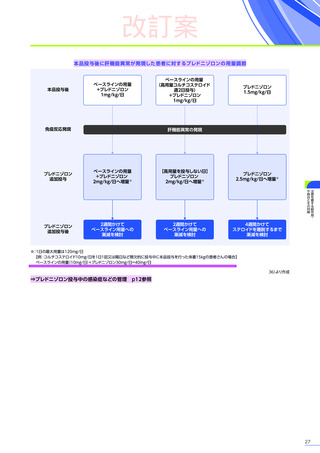
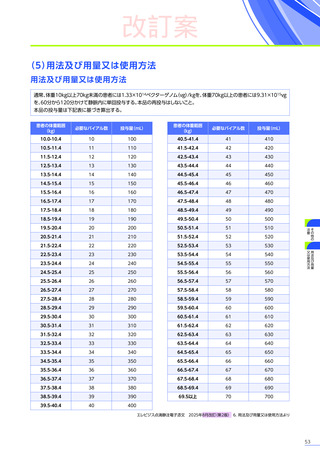
6. 用法及び用量又は使用方法
(抜粋)
通常、体重10kg以上70kg未満の患者には1.33×10 14ベクターゲノム
(vg)
/kgを、体重70kg以上の患者には9.31×10 15vgを、60分から120分かけて
静脈内に単回投与する。本品の再投与はしないこと。
88
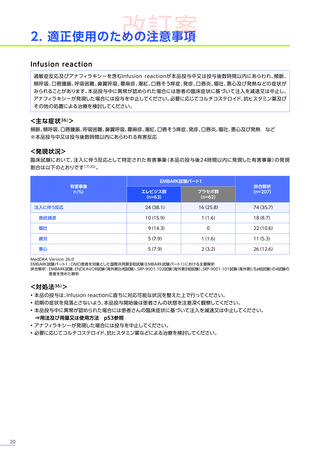
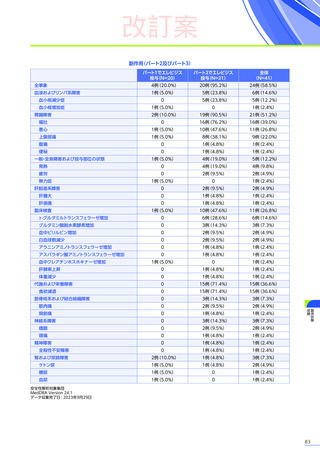
改訂案
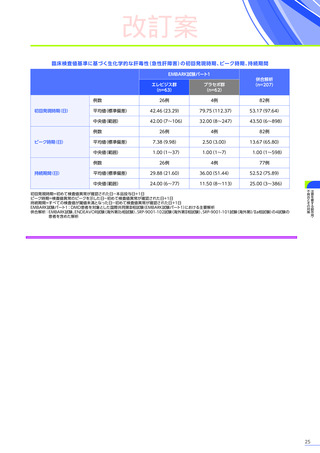
EMBARK試験
パート1
ENDEAVOR
試験
SRP-9001102試験
SRP-9001101試験
合計
n=63
(エレビジス群)
n=48
n=41
n=4
N=156
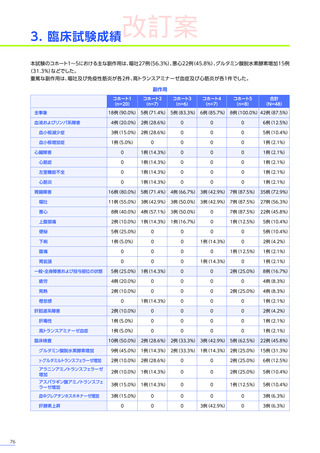
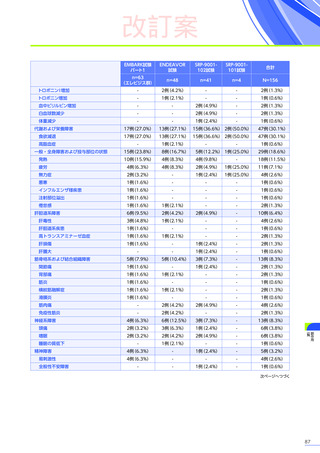
心臓障害
3例(4.8%)
1例(2.1%)
-
-
4例(2.6%)
心筋炎
1例(1.6%)
1例(2.1%)
-
-
2例(1.3%)
洞性頻脈
1例(1.6%)
-
-
-
1例(0.6%)
頻脈
1例(1.6%)
-
-
-
1例(0.6%)
心筋症
-
1例(2.1%)
-
-
1例(0.6%)
左室機能不全
-
1例(2.1%)
-
-
1例(0.6%)
腎および尿路障害
1例(1.6%)
3例(6.3%)
3例(7.3%)
-
7例(4.5%)
蛋白尿
1例(1.6%)
1例(2.1%)
-
-
2例(1.3%)
血尿
-
-
1例(2.4%)
-
1例(0.6%)
ヘモグロビン尿
-
2例(4.2%)
-
-
2例(1.3%)
着色尿
-
1例(2.1%)
-
-
1例(0.6%)
ケトン尿
-
-
2例(4.9%)
-
2例(1.3%)
-
-
1例(2.4%)
-
1例(0.6%)
1例(1.6%)
3例(6.3%)
-
-
4例(2.6%)
糖尿
皮膚および皮下組織障害
発疹
1例(1.6%)
-
-
-
1例(0.6%)
多汗症
-
1例(2.1%)
-
-
1例(0.6%)
そう痒症
-
1例(2.1%)
-
-
1例(0.6%)
紅斑性皮疹
-
1例(2.1%)
-
-
1例(0.6%)
血管障害
1例(1.6%)
-
-
-
1例(0.6%)
ほてり
1例(1.6%)
-
-
-
1例(0.6%)
-
6例(12.5%)
6例(14.6%)
-
12例(7.7%)
血小板減少症
-
5例(10.4%)
5例(12.2%)
-
10例(6.4%)
血小板増加症
-
1例(2.1%)
1例(2.4%)
-
2例(1.3%)
血液およびリンパ系障害
EMBARK試験パート1:安全性解析対象集団、MedDRA Version 26.0、データカットオフ日:2023年9月13日
ENDEAVOR試験:安全性解析対象集団、MedDRA Version 24.1、データカットオフ日:2023年7月24日
SRP-9001-102試験:安全性解析対象集団、MedDRA Version 24.1、データ収集完了日:2023年9月29日
SRP-9001-101試験:FAS、MedDRA Version 24.1、試験完了日:2023年4月25日
4. 効能、効果又は性能
デュシェンヌ型筋ジストロフィー
ただし、以下のいずれも満たす場合に限る
・ 抗AAVrh74抗体が陰性の患者
・ 歩行可能な患者
・ 3歳以上8歳未満の患者
6. 用法及び用量又は使用方法
(抜粋)
通常、体重10kg以上70kg未満の患者には1.33×10 14ベクターゲノム
(vg)
/kgを、体重70kg以上の患者には9.31×10 15vgを、60分から120分かけて
静脈内に単回投与する。本品の再投与はしないこと。
88