よむ、つかう、まなぶ。
総-1参考1 (82 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64319.html |
| 出典情報 | 中央社会保険医療協議会 総会(第619回 10/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
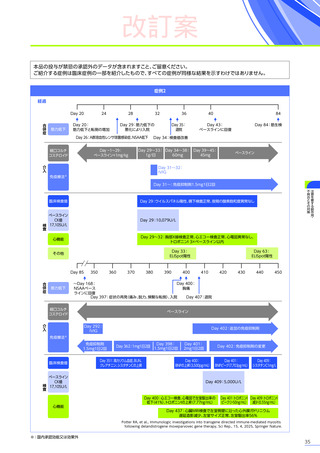
改訂案
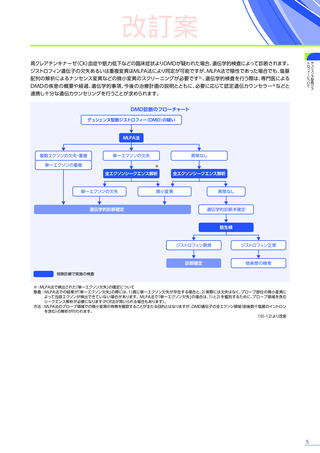
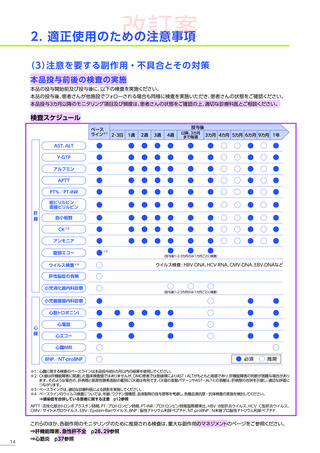
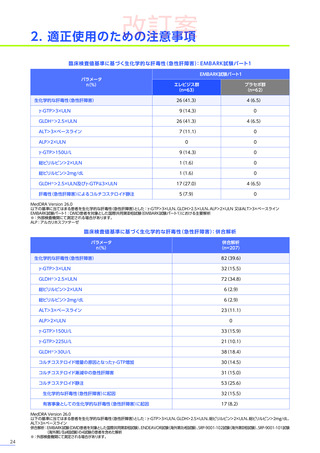
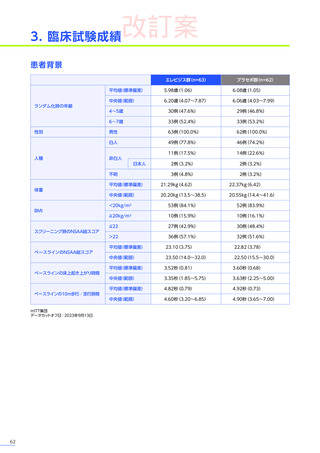
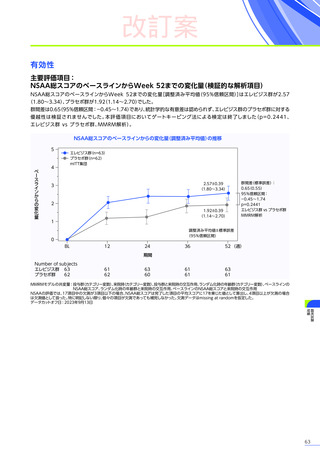
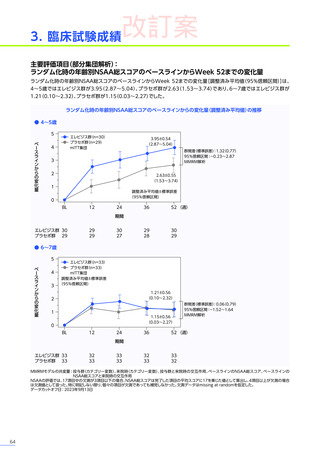
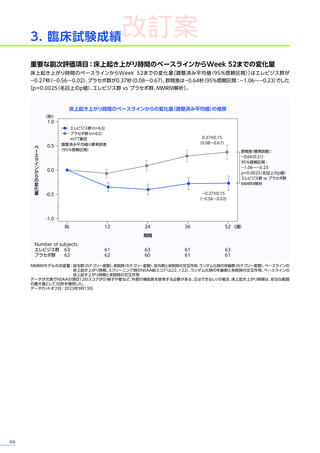
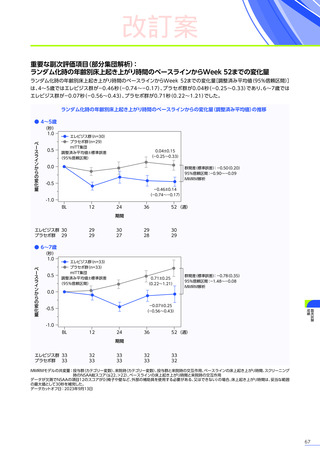
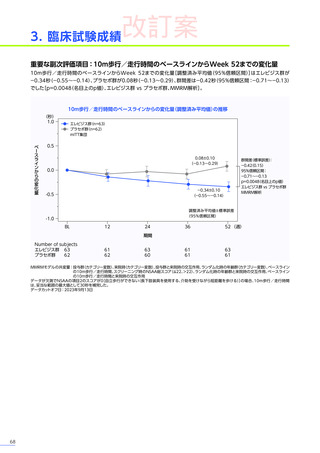
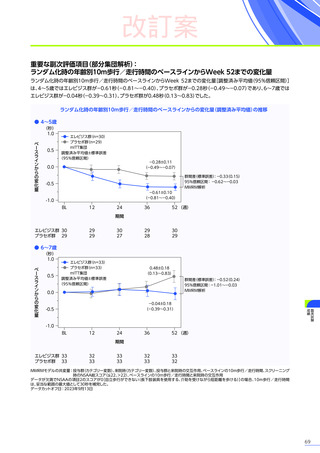
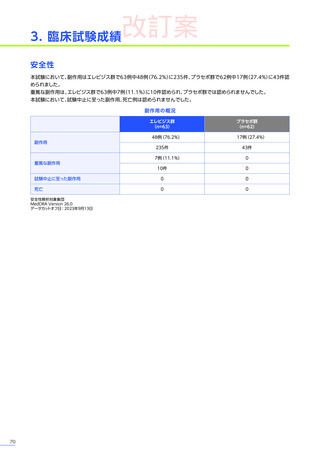
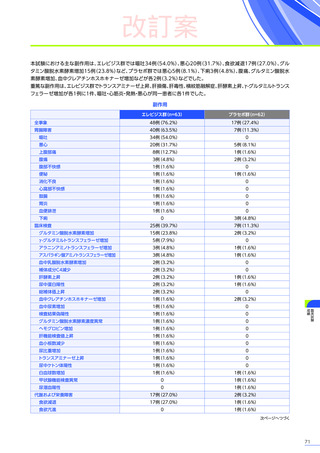
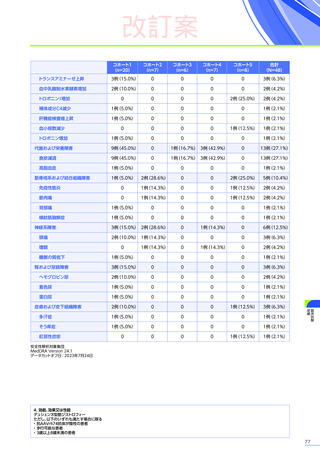
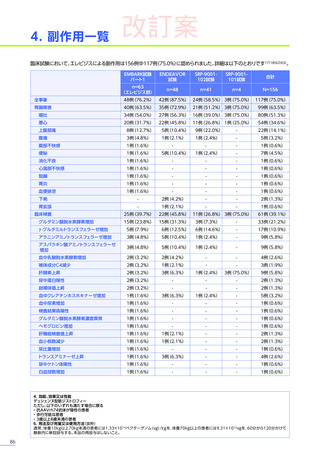
3. 臨床試験成績
【パート2】
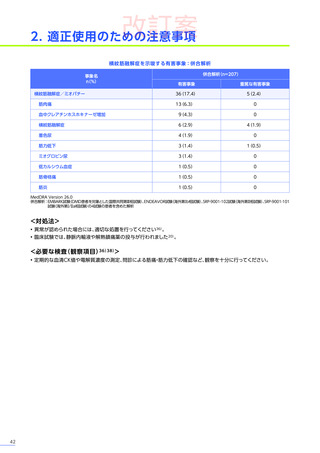
本試験のパート2において、副作用はパート1でエレビジス投与を受けた患者20例中4例
(20.0%)
に8件、パート2でエレビ
ジス投与を受けた患者21例中20例
(95.2%)
に115件認められました。
主な副作用は、パート1でエレビジス投与を受けた患者では心筋症、悪心、上腹部痛などが各1例
(5.0%)
、パート2でエレビ
ジス投与を受けた患者では嘔吐16例
(76.2%)
、食欲減退15例
(71.4%)
、悪心10例
(47.6%)
などでした。
本試験のパート2において、重篤な副作用、試験中止に至った副作用、死亡例は認められませんでした。
安全性解析対象集団
MedDRA Version 20.1
データカットオフ日:2021年12月14日
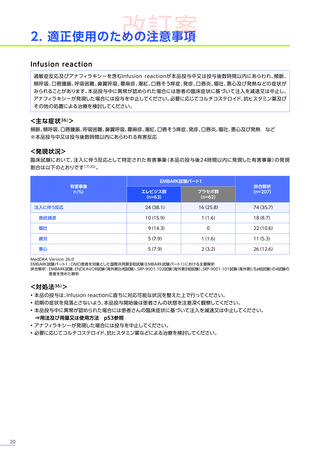
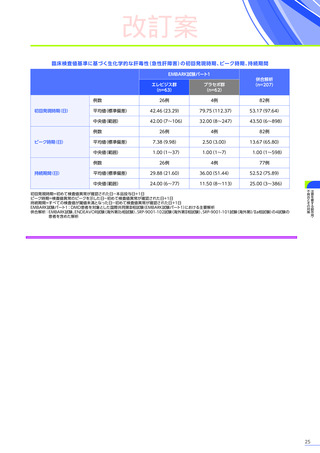
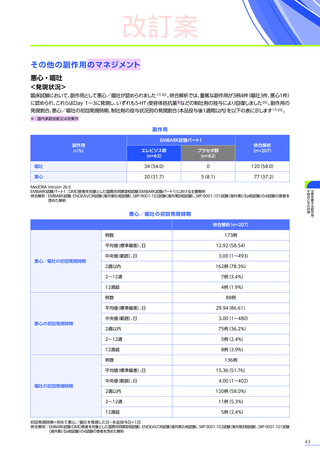
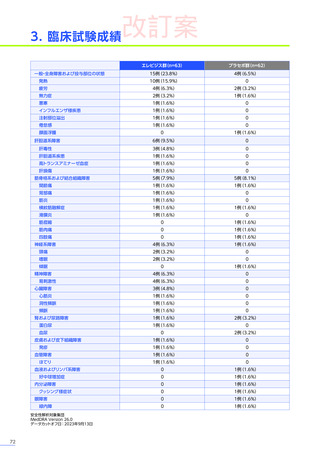
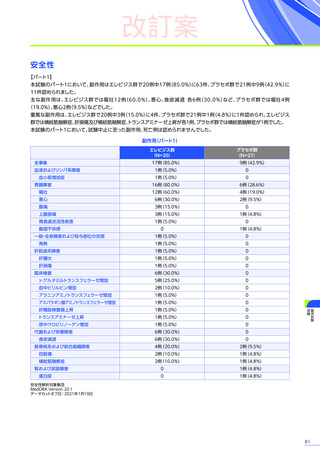
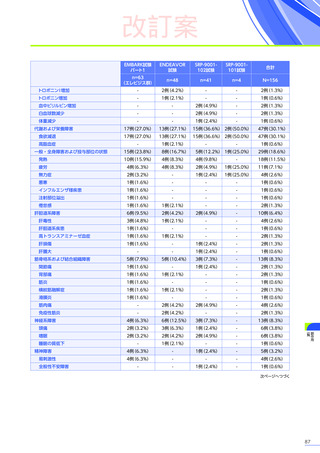
【パート3】
本試験のパート2及びパート3の併合解析では、副作用はパート2までにエレビジス投与を受けた患者41例中24例
(58.5%)
に665件認められました。
主な副作用は、嘔吐16例
(39.0%)
、食欲減退15例
(36.6%)
、悪心11例
(26.8%)
などでした。
重篤な副作用は41例中4例
(9.8%)
に5件認められ、横紋筋融解症
(3件)
、高トランスアミナーゼ血症及び肝損傷が各1件で
した。
本試験のパート2及びパート3の併合解析において、試験中止に至った副作用、死亡例は認められませんでした。
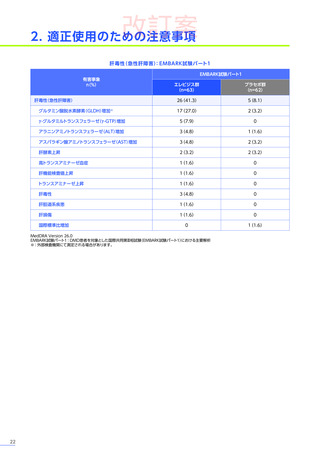
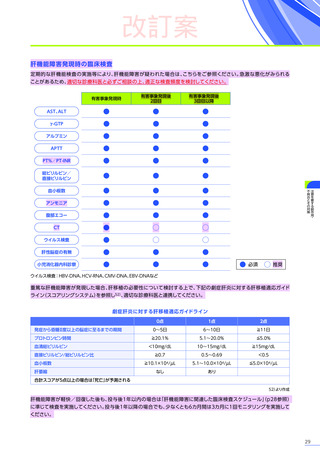
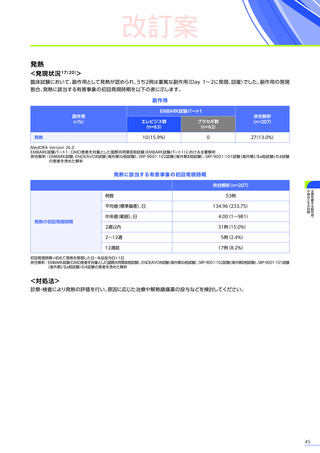
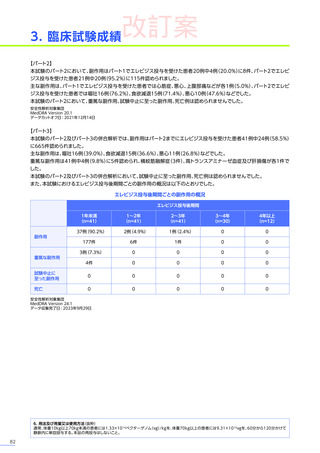
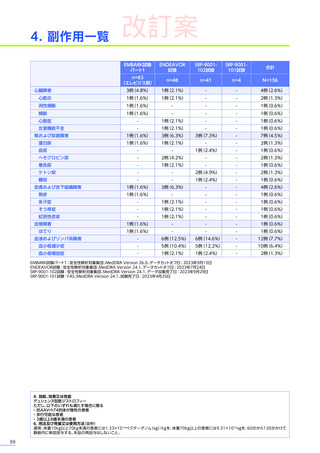
また、本試験におけるエレビジス投与後期間ごとの副作用の概況は以下のとおりでした。
エレビジス投与後期間ごとの副作用の概況
エレビジス投与後期間
3~4年
(n=30)
4年以上
(n=12)
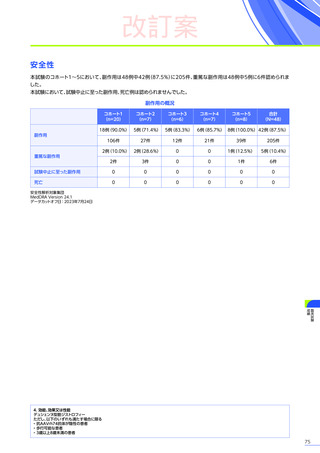
0
0
1件
0
0
0
0
0
0
4件
0
0
0
0
試験中止に
至った副作用
0
0
0
0
0
死亡
0
0
0
0
0
副作用
重篤な副作用
1年未満
(n=41)
1~2年
(n=41)
2~3年
(n=41)
37例(90.2%)
2例(4.9%)
1例(2.4%)
177件
6件
3例(7.3%)
安全性解析対象集団
MedDRA Version 24.1
データ収集完了日:2023年9月29日
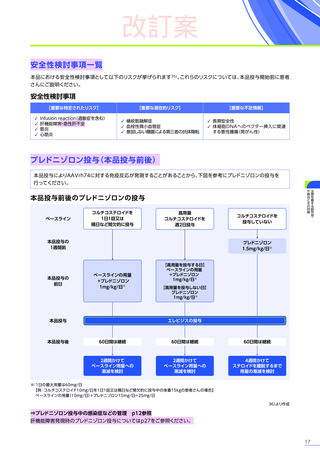
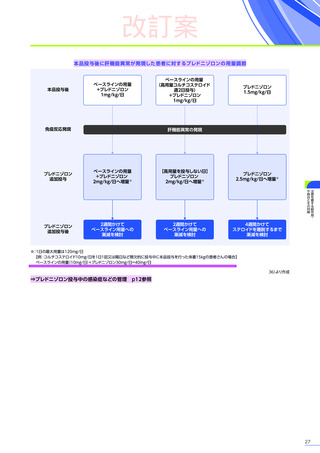
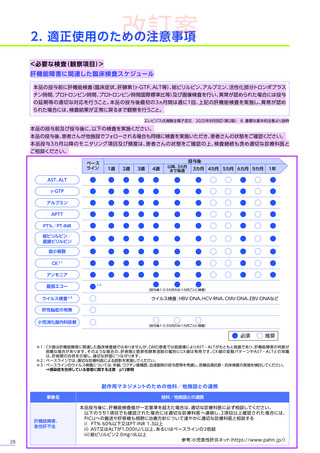
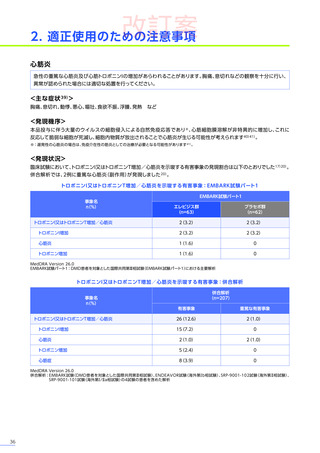
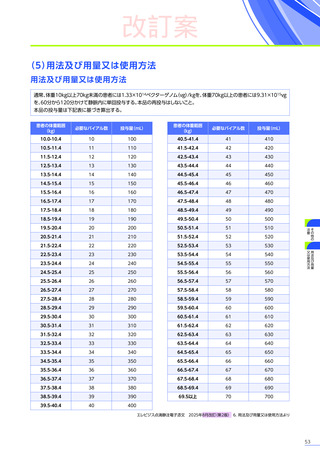
6. 用法及び用量又は使用方法
(抜粋)
通常、体重10kg以上70kg未満の患者には1.33×10 14ベクターゲノム
(vg)
/kgを、体重70kg以上の患者には9.31×10 15vgを、60分から120分かけて
静脈内に単回投与する。本品の再投与はしないこと。
82
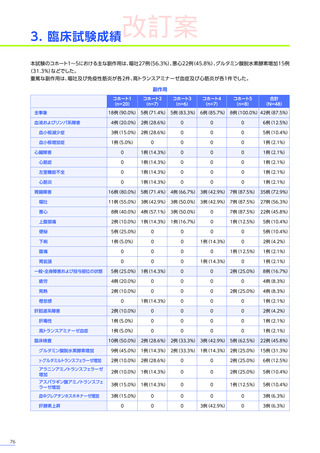
3. 臨床試験成績
【パート2】
本試験のパート2において、副作用はパート1でエレビジス投与を受けた患者20例中4例
(20.0%)
に8件、パート2でエレビ
ジス投与を受けた患者21例中20例
(95.2%)
に115件認められました。
主な副作用は、パート1でエレビジス投与を受けた患者では心筋症、悪心、上腹部痛などが各1例
(5.0%)
、パート2でエレビ
ジス投与を受けた患者では嘔吐16例
(76.2%)
、食欲減退15例
(71.4%)
、悪心10例
(47.6%)
などでした。
本試験のパート2において、重篤な副作用、試験中止に至った副作用、死亡例は認められませんでした。
安全性解析対象集団
MedDRA Version 20.1
データカットオフ日:2021年12月14日
【パート3】
本試験のパート2及びパート3の併合解析では、副作用はパート2までにエレビジス投与を受けた患者41例中24例
(58.5%)
に665件認められました。
主な副作用は、嘔吐16例
(39.0%)
、食欲減退15例
(36.6%)
、悪心11例
(26.8%)
などでした。
重篤な副作用は41例中4例
(9.8%)
に5件認められ、横紋筋融解症
(3件)
、高トランスアミナーゼ血症及び肝損傷が各1件で
した。
本試験のパート2及びパート3の併合解析において、試験中止に至った副作用、死亡例は認められませんでした。
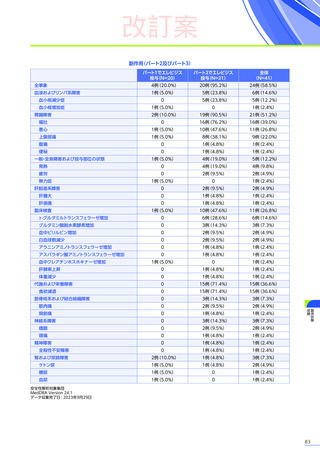
また、本試験におけるエレビジス投与後期間ごとの副作用の概況は以下のとおりでした。
エレビジス投与後期間ごとの副作用の概況
エレビジス投与後期間
3~4年
(n=30)
4年以上
(n=12)
0
0
1件
0
0
0
0
0
0
4件
0
0
0
0
試験中止に
至った副作用
0
0
0
0
0
死亡
0
0
0
0
0
副作用
重篤な副作用
1年未満
(n=41)
1~2年
(n=41)
2~3年
(n=41)
37例(90.2%)
2例(4.9%)
1例(2.4%)
177件
6件
3例(7.3%)
安全性解析対象集団
MedDRA Version 24.1
データ収集完了日:2023年9月29日
6. 用法及び用量又は使用方法
(抜粋)
通常、体重10kg以上70kg未満の患者には1.33×10 14ベクターゲノム
(vg)
/kgを、体重70kg以上の患者には9.31×10 15vgを、60分から120分かけて
静脈内に単回投与する。本品の再投与はしないこと。
82