よむ、つかう、まなぶ。
総-1参考1 (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64319.html |
| 出典情報 | 中央社会保険医療協議会 総会(第619回 10/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
改訂案
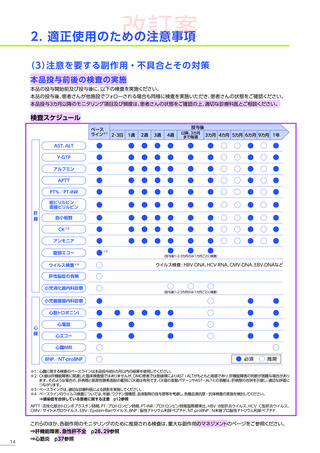
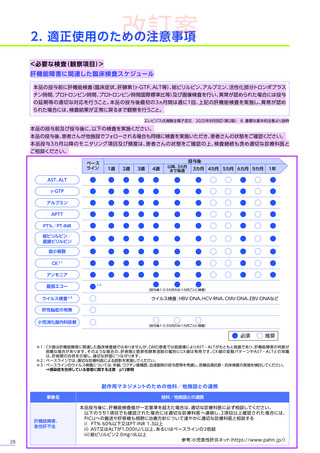
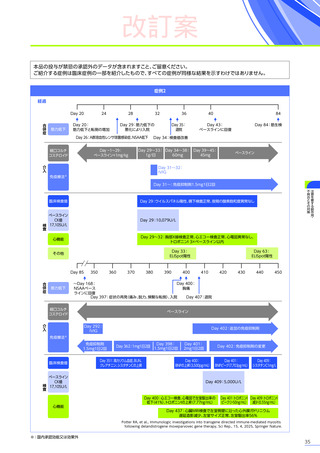
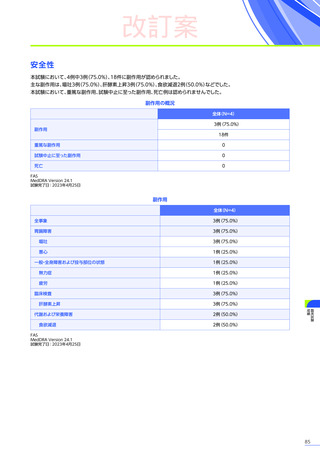
肝機能検査
(投与前)
本品の投与前に肝機能検査
[臨床症状、肝酵素
(γ-GTP、ALT等)
、総ビリルビン、アルブミン、活性化部分トロンボプラス
チン時間、プロトロンビン時間(PT%)、プロトロンビン時間国際標準比(PT-INR)等]及び画像検査を行い、異常が認め
られた場合には投与の延期等の適切な対応を行ってください。
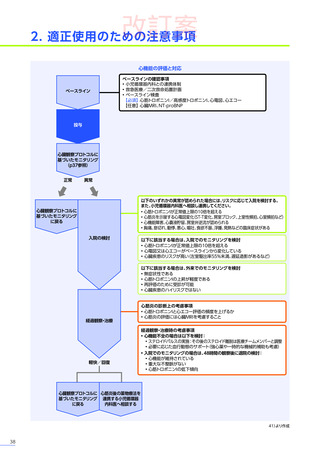
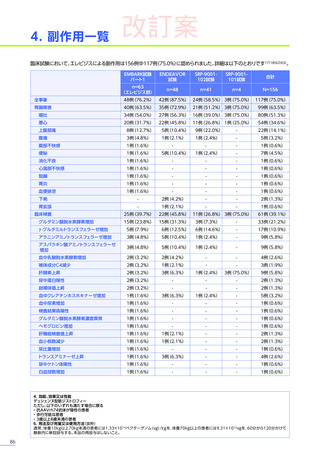
<解説>
• 本品投与前に肝機能検査の異常又は画像検査の異常所見
(脂肪肝、肝腫大、脾腫等)
が認められた場合には、適切な診療
科医と相談し、ベネフィット・リスクを考慮して治療可否
(投与の延期等の適切な対応を含む)
及び治療後のモニタリング
計画をご検討ください。症例ごとの投与可否の判断を含めて、日本小児神経学会による施設認定後に提供される、
(エキスパートパネル)
によるインターネットを用いたコンサルテーションを、全例で活用してください。
BRIDGE-NMD※
⇒肝機能障害患者に関する注意
p11参照
⇒各副作用マネジメントのための他科/他施設との連携
p19参照
• DMD患者では、変性した筋肉に由来する、
トランスアミナーゼや乳酸脱水素酵素の高値(AST・ALTは最高で基準値
上限の22倍に達する)を認め、本品投与前のベースラインより肝機能検査値が正常範囲を超えている場合が想定
されます32)33)。
⇒肝機能障害、急性肝不全
p21参照
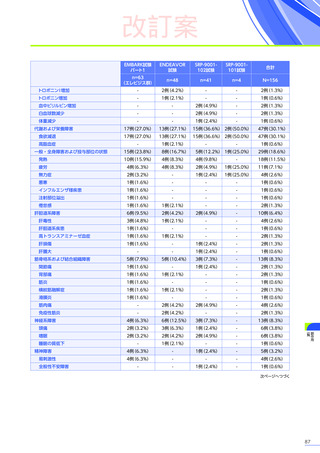
肝機能検査
(投与後)
注意を要する副作用・
不具合とその対策
※:BRIDGE-NMD
(Building Recommendations in Developing Gene Therapy for Neuromuscular Disorders、神経筋疾患遺伝子治療安全性最適化
ネットワーク)
。小児神経、小児肝臓内科、小児肝臓外科、小児循環器、小児免疫、小児腎臓内科、小児血液内科の医師で構成される専門家チーム。
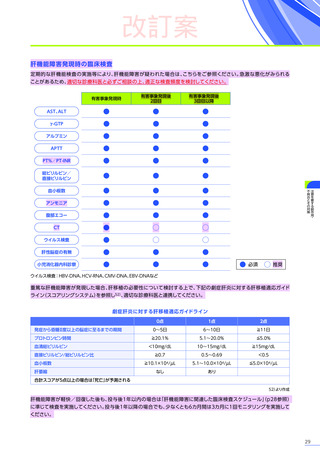
本品の投与後最初の3カ月間は週に1回、上記の肝機能検査を実施し、異常が認められた場合には、検査結果が正常に
戻るまで観察を行ってください。
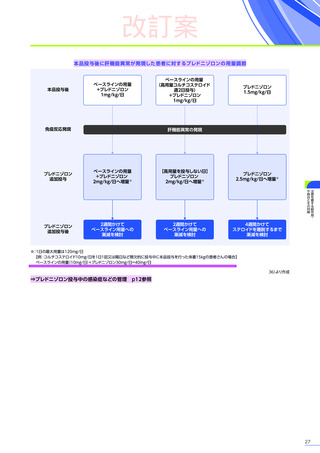
「プレドニゾロン投与
(本品投与前後)
」
に従い本品の投与前及び投与後にプレドニゾロンの投与を行ってください。
⇒プレドニゾロン投与(本品投与前後) p17参照
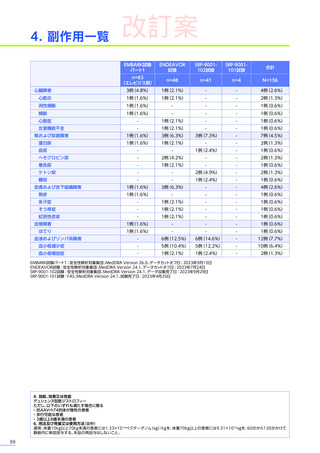
<解説>
• 異常が認められた場合には、本品投与前と同様にBRIDGE-NMDによるインターネットを用いたコンサルテーションを積極的
に活用してください。
⇒各副作用マネジメントのための他科/他施設との連携
p19参照
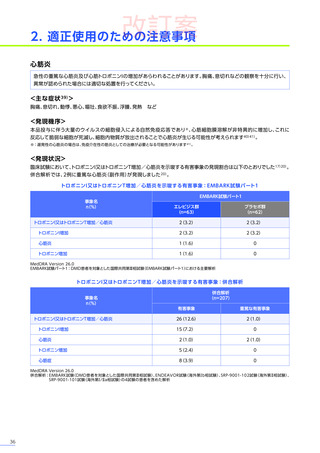
• 臨床試験では、本品投与後に肝機能障害及び肝機能検査値上昇が認められています。また、海外において歩行不能なDMD
患者で、急性肝不全により死亡に至った症例が報告されています※。
⇒肝機能障害・急性肝不全
p21参照
※:エレビジスの効能、効果又は性能は以下のとおりです。
デュシェンヌ型筋ジストロフィー
ただし、以下のいずれも満たす場合に限る
・抗AAVrh74抗体が陰性の患者
・歩行可能な患者
・3歳以上8歳未満の患者
15
肝機能検査
(投与前)
本品の投与前に肝機能検査
[臨床症状、肝酵素
(γ-GTP、ALT等)
、総ビリルビン、アルブミン、活性化部分トロンボプラス
チン時間、プロトロンビン時間(PT%)、プロトロンビン時間国際標準比(PT-INR)等]及び画像検査を行い、異常が認め
られた場合には投与の延期等の適切な対応を行ってください。
<解説>
• 本品投与前に肝機能検査の異常又は画像検査の異常所見
(脂肪肝、肝腫大、脾腫等)
が認められた場合には、適切な診療
科医と相談し、ベネフィット・リスクを考慮して治療可否
(投与の延期等の適切な対応を含む)
及び治療後のモニタリング
計画をご検討ください。症例ごとの投与可否の判断を含めて、日本小児神経学会による施設認定後に提供される、
(エキスパートパネル)
によるインターネットを用いたコンサルテーションを、全例で活用してください。
BRIDGE-NMD※
⇒肝機能障害患者に関する注意
p11参照
⇒各副作用マネジメントのための他科/他施設との連携
p19参照
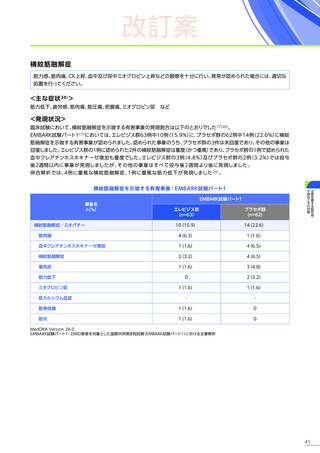
• DMD患者では、変性した筋肉に由来する、
トランスアミナーゼや乳酸脱水素酵素の高値(AST・ALTは最高で基準値
上限の22倍に達する)を認め、本品投与前のベースラインより肝機能検査値が正常範囲を超えている場合が想定
されます32)33)。
⇒肝機能障害、急性肝不全
p21参照
肝機能検査
(投与後)
注意を要する副作用・
不具合とその対策
※:BRIDGE-NMD
(Building Recommendations in Developing Gene Therapy for Neuromuscular Disorders、神経筋疾患遺伝子治療安全性最適化
ネットワーク)
。小児神経、小児肝臓内科、小児肝臓外科、小児循環器、小児免疫、小児腎臓内科、小児血液内科の医師で構成される専門家チーム。
本品の投与後最初の3カ月間は週に1回、上記の肝機能検査を実施し、異常が認められた場合には、検査結果が正常に
戻るまで観察を行ってください。
「プレドニゾロン投与
(本品投与前後)
」
に従い本品の投与前及び投与後にプレドニゾロンの投与を行ってください。
⇒プレドニゾロン投与(本品投与前後) p17参照
<解説>
• 異常が認められた場合には、本品投与前と同様にBRIDGE-NMDによるインターネットを用いたコンサルテーションを積極的
に活用してください。
⇒各副作用マネジメントのための他科/他施設との連携
p19参照
• 臨床試験では、本品投与後に肝機能障害及び肝機能検査値上昇が認められています。また、海外において歩行不能なDMD
患者で、急性肝不全により死亡に至った症例が報告されています※。
⇒肝機能障害・急性肝不全
p21参照
※:エレビジスの効能、効果又は性能は以下のとおりです。
デュシェンヌ型筋ジストロフィー
ただし、以下のいずれも満たす場合に限る
・抗AAVrh74抗体が陰性の患者
・歩行可能な患者
・3歳以上8歳未満の患者
15