よむ、つかう、まなぶ。
総-1参考1 (85 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64319.html |
| 出典情報 | 中央社会保険医療協議会 総会(第619回 10/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
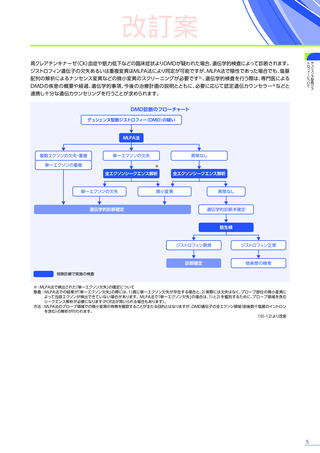
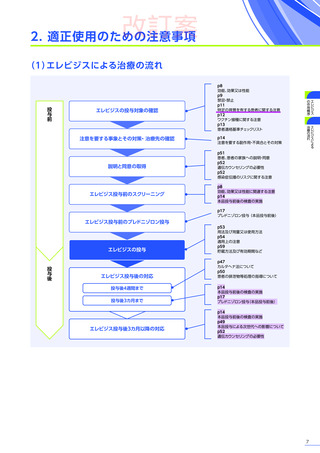
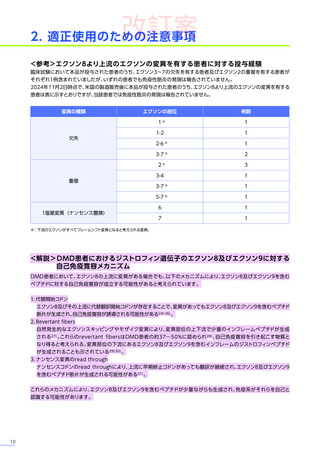
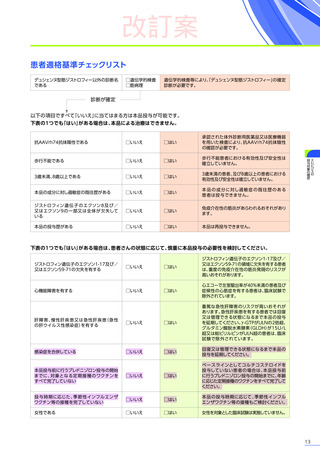
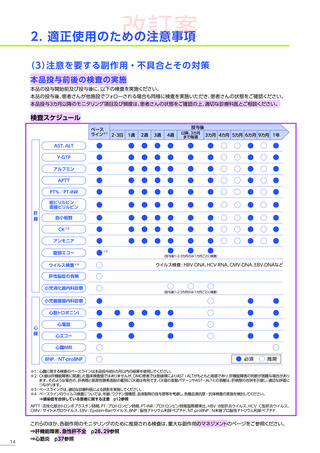
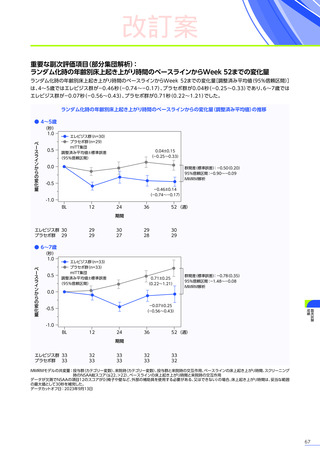
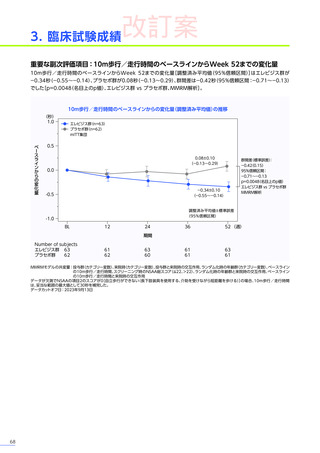
改訂案
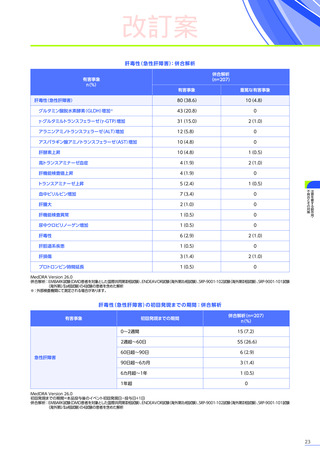
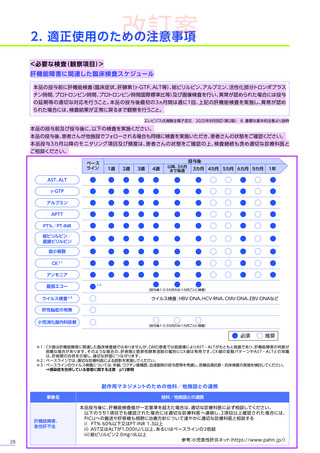
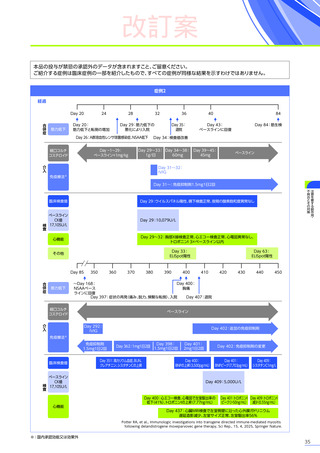
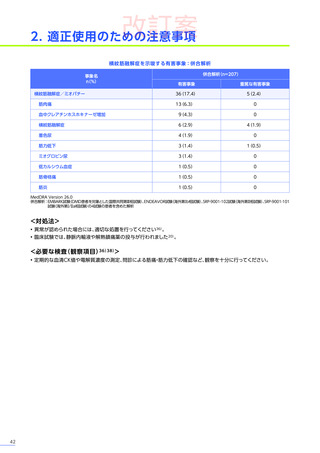
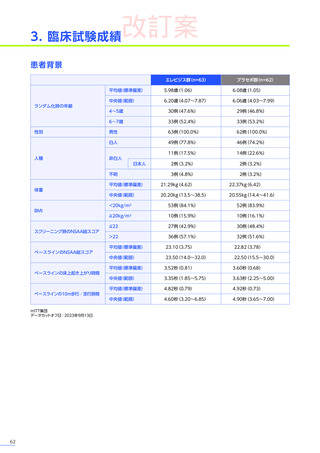
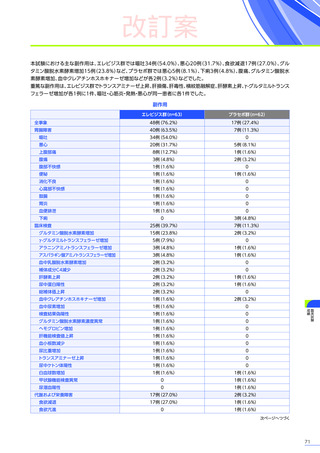
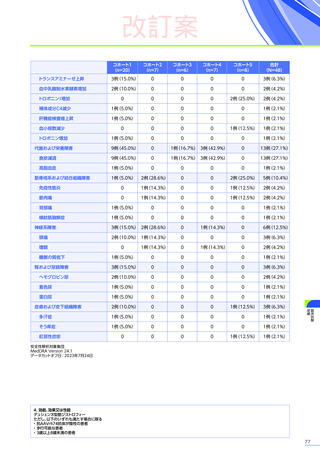
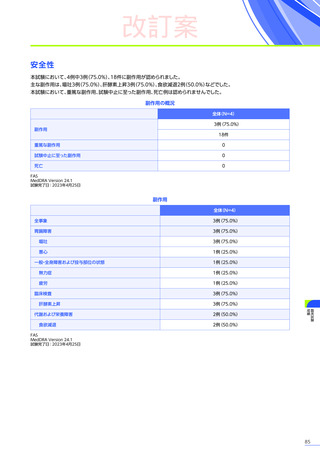
安全性
本試験において、4例中3例
(75.0%)
、18件に副作用が認められました。
主な副作用は、嘔吐3例
(75.0%)
、肝酵素上昇3例
(75.0%)
、食欲減退2例
(50.0%)
などでした。
本試験において、重篤な副作用、試験中止に至った副作用、死亡例は認められませんでした。
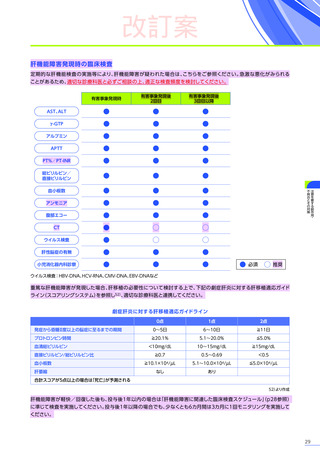
副作用の概況
全体
(N=4)
3例(75.0%)
副作用
18件
重篤な副作用
0
試験中止に至った副作用
0
死亡
0
FAS
MedDRA Version 24.1
試験完了日:2023年4月25日
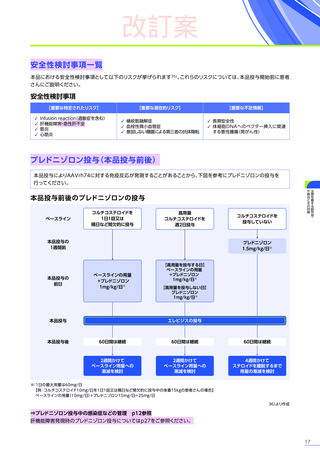
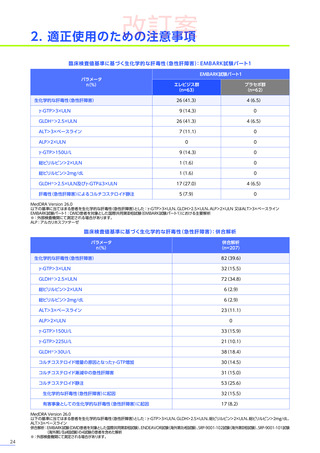
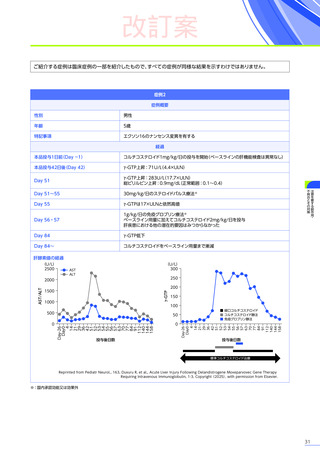
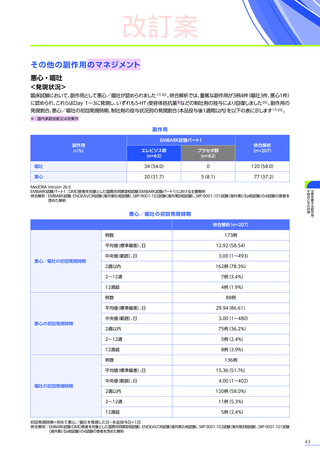
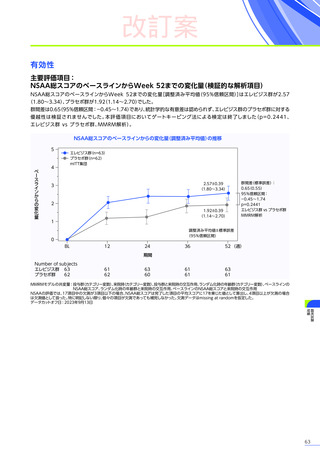
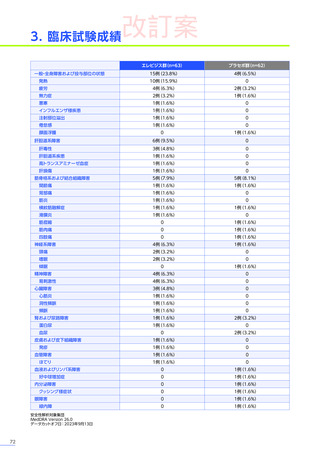
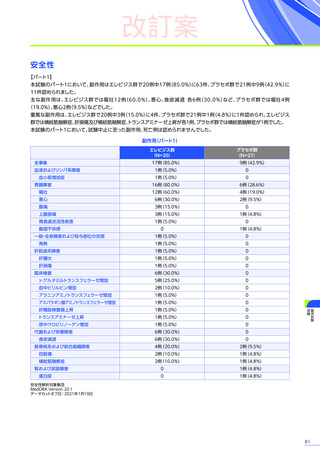
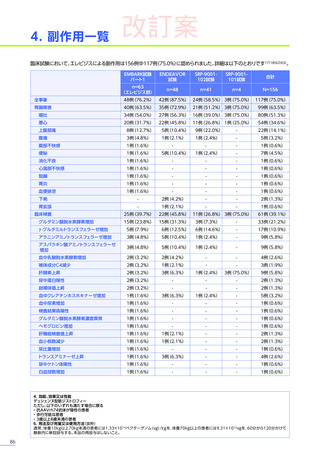
副作用
全体
(N=4)
全事象
3例(75.0%)
胃腸障害
3例(75.0%)
嘔吐
3例(75.0%)
悪心
1例(25.0%)
一般・全身障害および投与部位の状態
1例(25.0%)
無力症
1例(25.0%)
疲労
1例(25.0%)
臨床検査
3例(75.0%)
代謝および栄養障害
食欲減退
3例(75.0%)
2例(50.0%)
臨床試験
成績
肝酵素上昇
2例(50.0%)
FAS
MedDRA Version 24.1
試験完了日:2023年4月25日
85
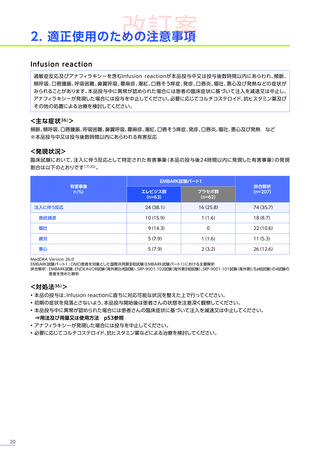
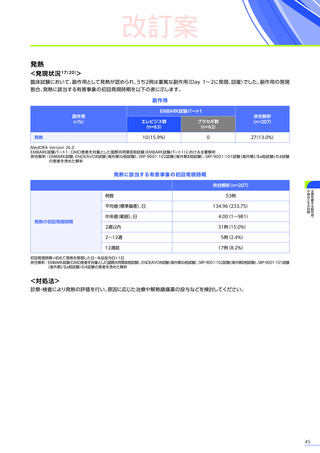
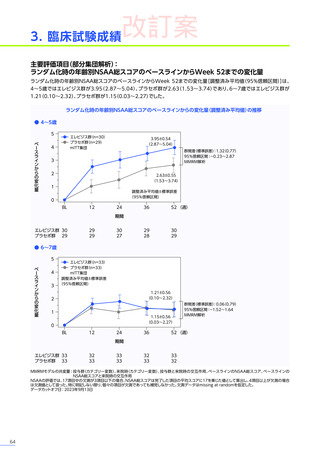
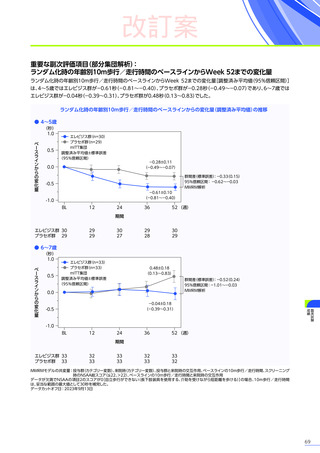
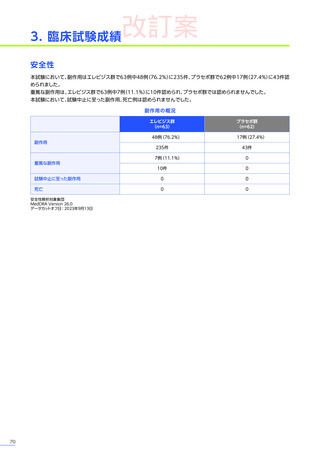
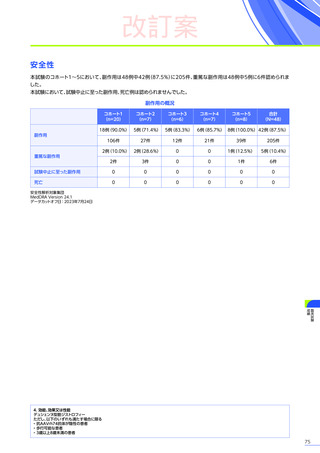
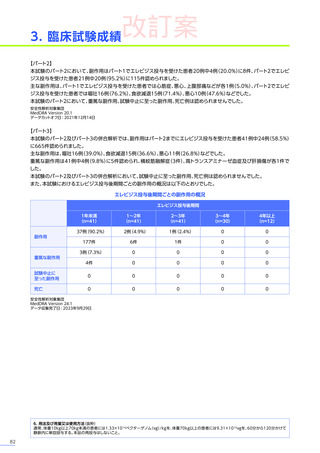
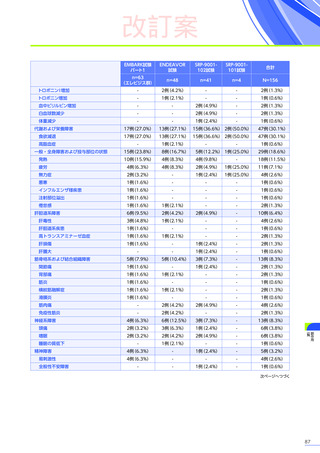
安全性
本試験において、4例中3例
(75.0%)
、18件に副作用が認められました。
主な副作用は、嘔吐3例
(75.0%)
、肝酵素上昇3例
(75.0%)
、食欲減退2例
(50.0%)
などでした。
本試験において、重篤な副作用、試験中止に至った副作用、死亡例は認められませんでした。
副作用の概況
全体
(N=4)
3例(75.0%)
副作用
18件
重篤な副作用
0
試験中止に至った副作用
0
死亡
0
FAS
MedDRA Version 24.1
試験完了日:2023年4月25日
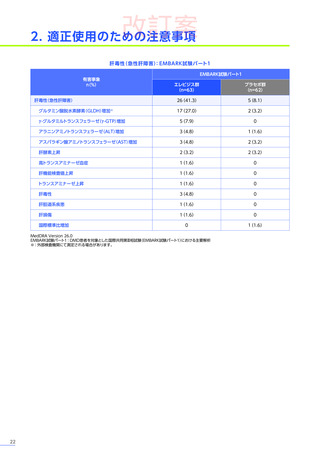
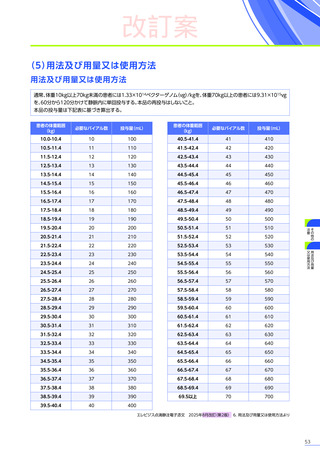
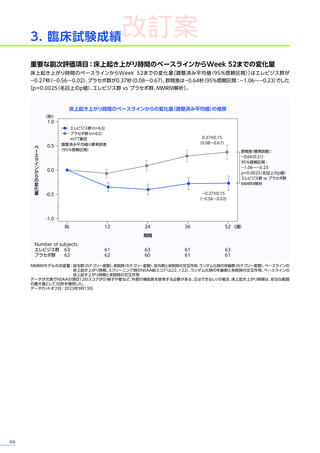
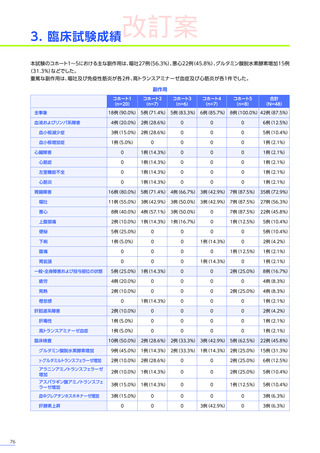
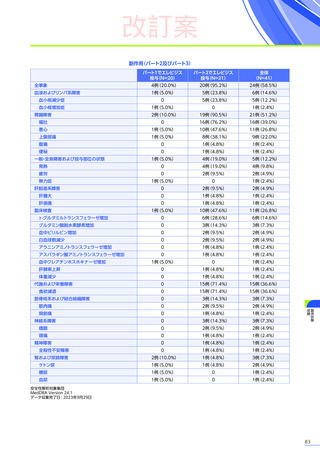
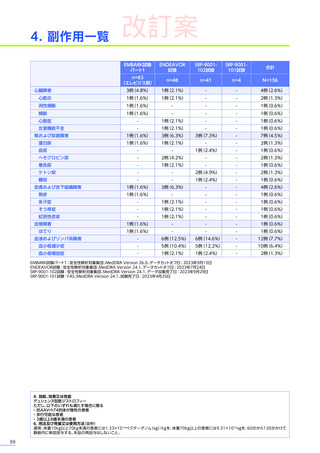
副作用
全体
(N=4)
全事象
3例(75.0%)
胃腸障害
3例(75.0%)
嘔吐
3例(75.0%)
悪心
1例(25.0%)
一般・全身障害および投与部位の状態
1例(25.0%)
無力症
1例(25.0%)
疲労
1例(25.0%)
臨床検査
3例(75.0%)
代謝および栄養障害
食欲減退
3例(75.0%)
2例(50.0%)
臨床試験
成績
肝酵素上昇
2例(50.0%)
FAS
MedDRA Version 24.1
試験完了日:2023年4月25日
85