よむ、つかう、まなぶ。
総-1参考1 (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64319.html |
| 出典情報 | 中央社会保険医療協議会 総会(第619回 10/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
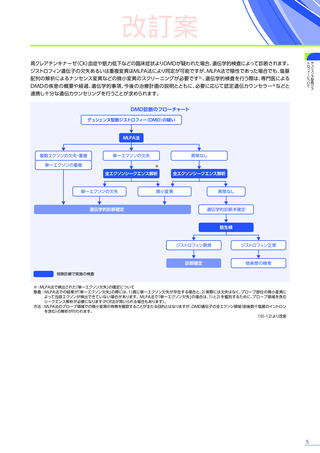
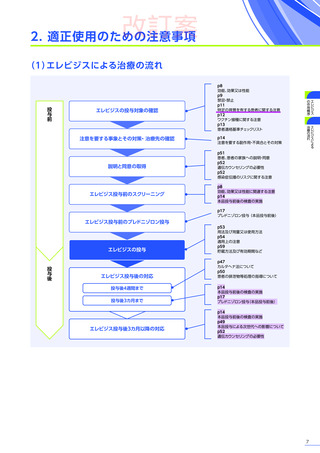
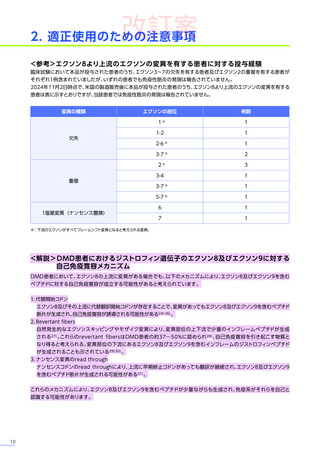
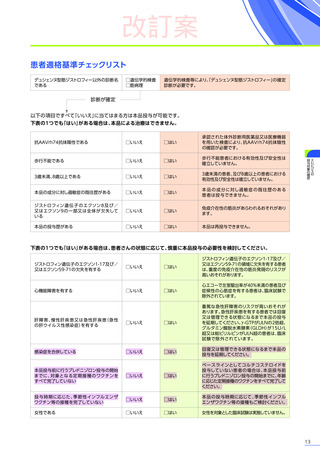
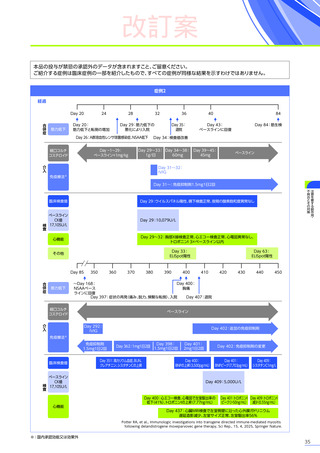
改訂案
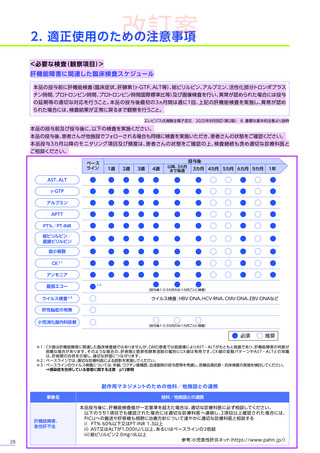
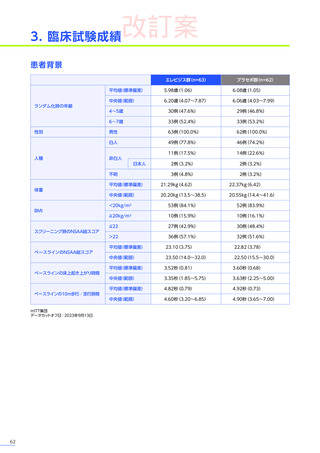
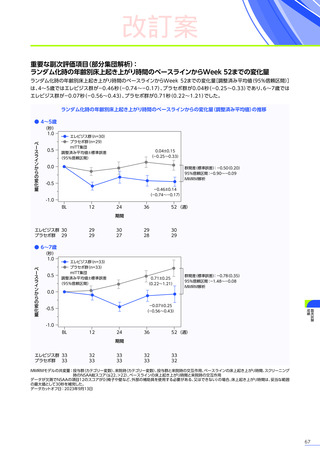
肝機能障害、急性肝不全
肝酵素
(γ-GTP、ALT等)
及び総ビリルビン等の増加を伴う重篤な肝機能障害があらわれることがありますので、異常が
認められた場合には、プレドニゾロンの投与を継続するなどの適切な処置を行ってください。海外において歩行不能な
DMD患者で、急性肝不全により死亡に至った症例が報告されています※1。
<主な症状 37)>
倦怠感、食欲不振、発熱、黄疸、発疹、悪心・嘔吐、そう痒、意識障害、出血傾向
など
<発現機序>
肝機能障害はAAVを用いた遺伝子治療用製品の全身投与でみられる副作用と考えられます。肝機能障害の機序として、直接的
な肝障害と免疫介在性の肝障害の2つが考えられています。免疫介在性の肝障害については、ベクターカプシドや導入遺伝子
に対する自然免疫応答と獲得免疫応答の両方に起因すると考えられています44)。
本品による肝機能障害は、ベクターが取り込まれた肝細胞上に発現するベクターカプシドエピトープ配列に対する細胞傷害性
T細胞介在性免疫応答により発現すると考えられています45)-47)。
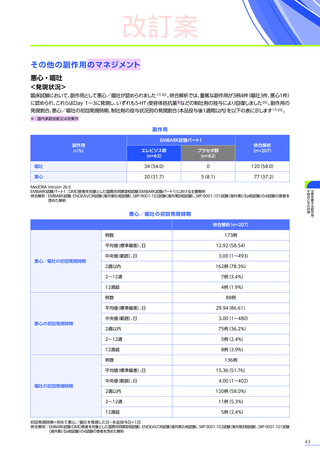
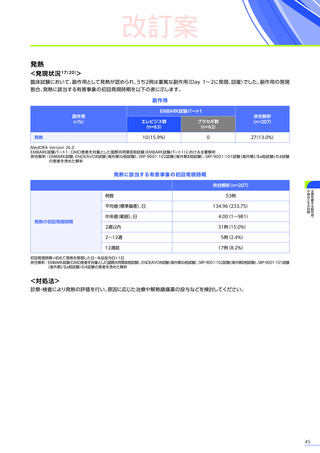
<発現状況>
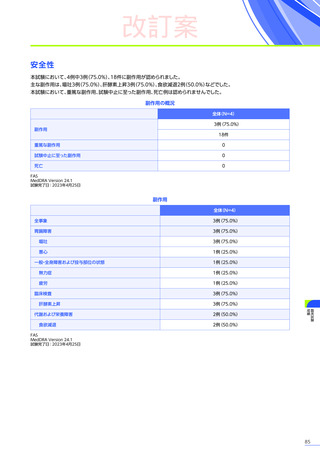
(急性肝障害)
に該当する有害事象は80例
(38.6%)
に159件認められました。肝毒性の有害事象の
併合解析※2において、肝毒性
うち10例10件が重篤
(すべて副作用)
でした。肝毒性の初回発現までの期間は、
80例中70例で本品の投与後60日以内でした。
肝毒性の転帰は、
80例159件のうち、
回復143件、
未回復15件、
不明が1件でした。
重篤な肝毒性の転帰は、
回復9件、
未回復
1件※3でした。
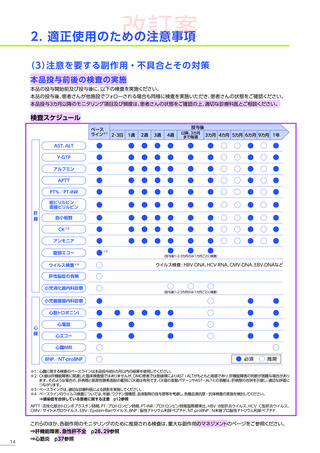
注意を要する副作用・
不具合とその対策
臨床試験において、肝毒性
(急性肝障害)
、臨床検査値基準に基づく生化学的な肝毒性
(急性肝障害)
が認められました。
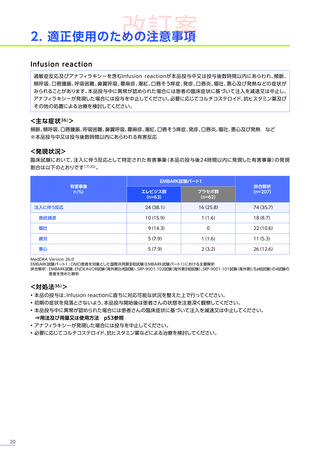
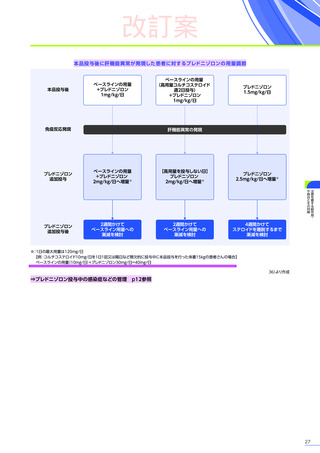
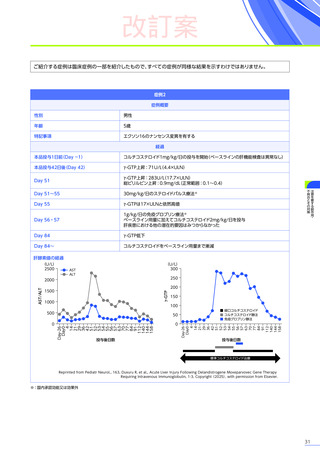
処置としてコルチコステロイドの追加投与などが行われ、肝毒性を発現した80例中14例※4がコルチコステロイドの静脈内
投与を受けました。このうち、13例には高用量ステロイドパルス静脈内投与が行われ、12例が回復、1例が未回復※3でした。
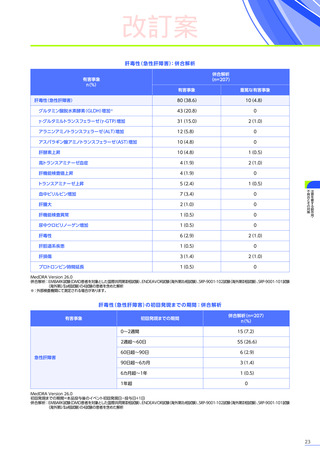
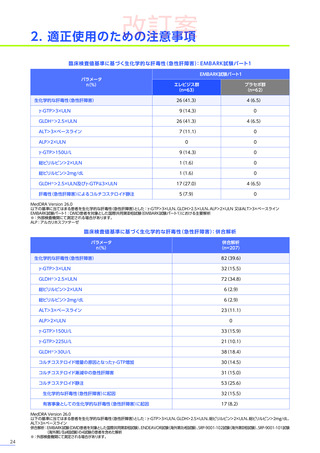
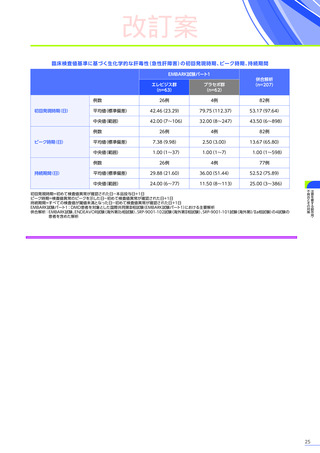
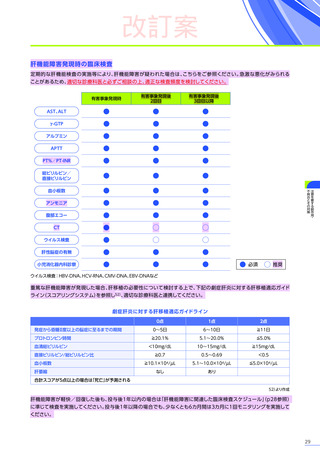
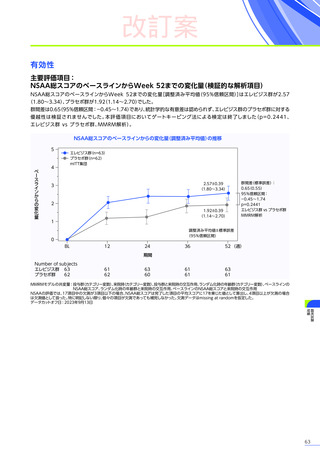
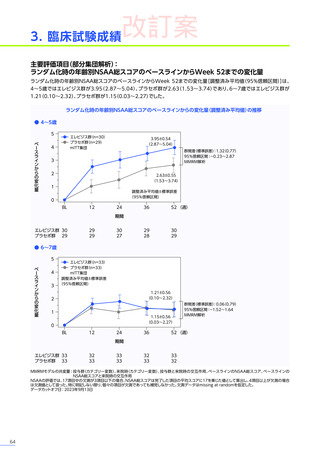
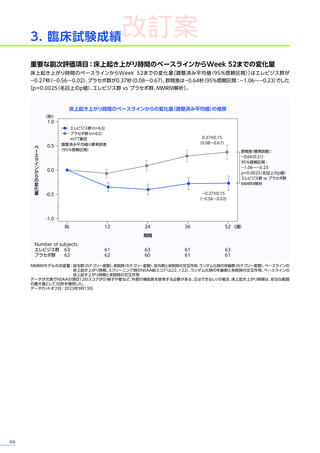
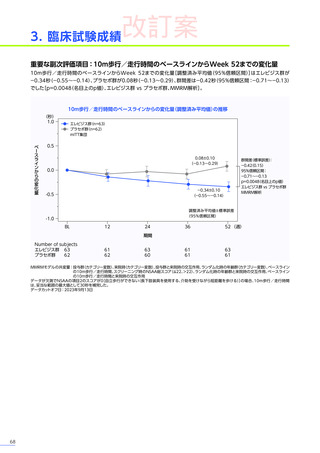
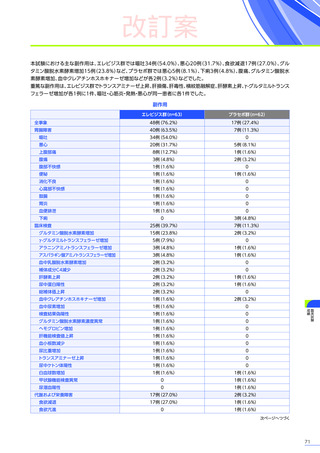
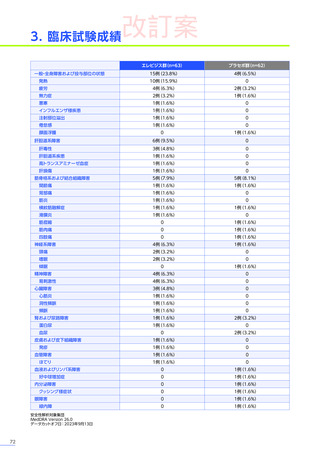
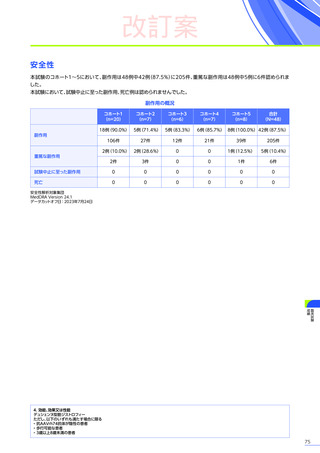
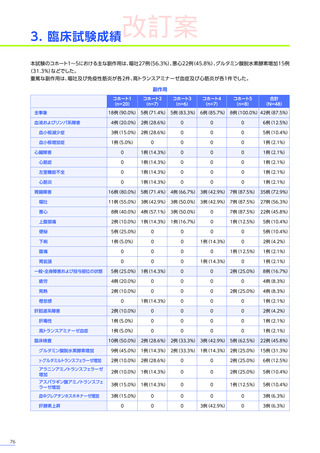
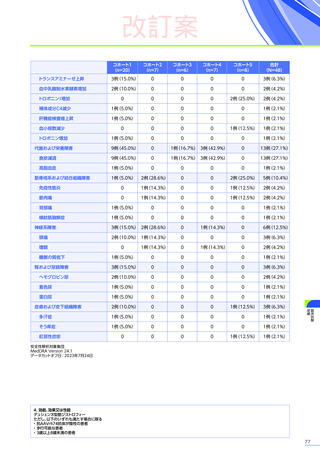
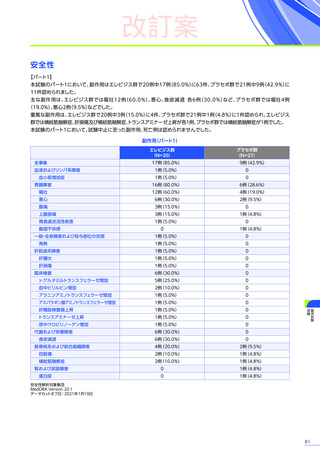
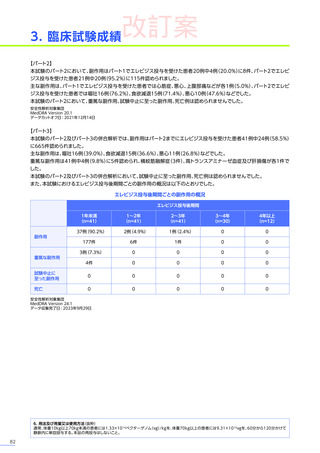
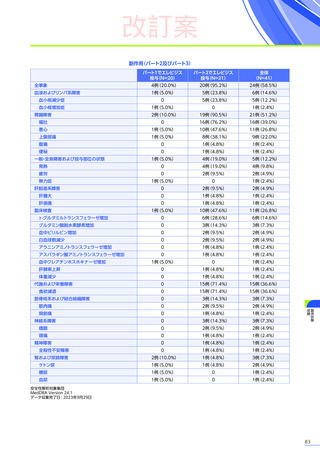
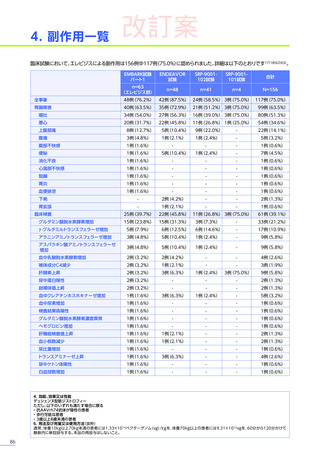
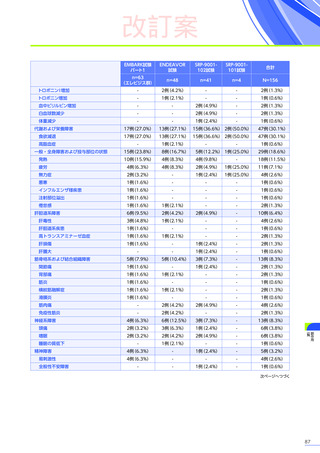
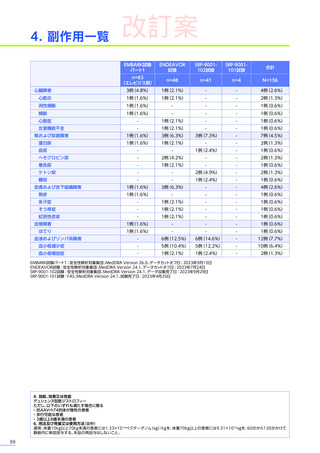
発現割合、初回発現までの期間別の発現割合、初回発現時期・ピーク時期・持続期間を以下の表に示します17)20)。
なお、海外において歩行不能なDMD患者で、急性肝不全により死亡に至った症例が報告されています※1。
※1:エレビジスの効能、効果又は性能は以下のとおりです。
デュシェンヌ型筋ジストロフィー
ただし、以下のいずれも満たす場合に限る
・抗AAVrh74抗体が陰性の患者
・歩行可能な患者
・3歳以上8歳未満の患者
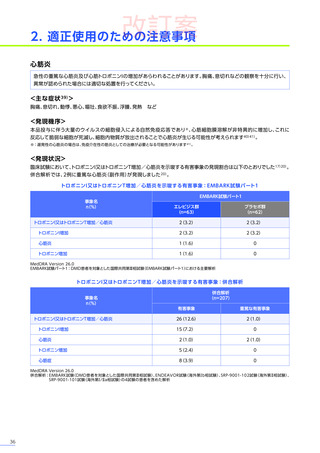
※2:EMBARK試験
(DMD患者を対象とした国際共同第Ⅲ相試験)
、ENDEAVOR試験
(海外第Ⅰb相試験)
、SRP-9001-102試験
(海外第Ⅱ相試験)
、SRP-9001101試験
(海外第Ⅰ/Ⅱa相試験)
の4試験の患者を含めた解析
※3:承認申請のデータカットオフ時点。その後、回復に至っています。
※4:データを収集しなかったSRP-9001-101試験を除く
21
肝機能障害、急性肝不全
肝酵素
(γ-GTP、ALT等)
及び総ビリルビン等の増加を伴う重篤な肝機能障害があらわれることがありますので、異常が
認められた場合には、プレドニゾロンの投与を継続するなどの適切な処置を行ってください。海外において歩行不能な
DMD患者で、急性肝不全により死亡に至った症例が報告されています※1。
<主な症状 37)>
倦怠感、食欲不振、発熱、黄疸、発疹、悪心・嘔吐、そう痒、意識障害、出血傾向
など
<発現機序>
肝機能障害はAAVを用いた遺伝子治療用製品の全身投与でみられる副作用と考えられます。肝機能障害の機序として、直接的
な肝障害と免疫介在性の肝障害の2つが考えられています。免疫介在性の肝障害については、ベクターカプシドや導入遺伝子
に対する自然免疫応答と獲得免疫応答の両方に起因すると考えられています44)。
本品による肝機能障害は、ベクターが取り込まれた肝細胞上に発現するベクターカプシドエピトープ配列に対する細胞傷害性
T細胞介在性免疫応答により発現すると考えられています45)-47)。
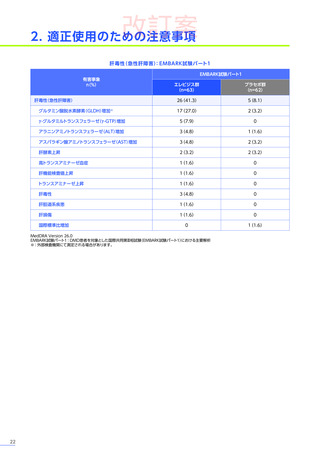
<発現状況>
(急性肝障害)
に該当する有害事象は80例
(38.6%)
に159件認められました。肝毒性の有害事象の
併合解析※2において、肝毒性
うち10例10件が重篤
(すべて副作用)
でした。肝毒性の初回発現までの期間は、
80例中70例で本品の投与後60日以内でした。
肝毒性の転帰は、
80例159件のうち、
回復143件、
未回復15件、
不明が1件でした。
重篤な肝毒性の転帰は、
回復9件、
未回復
1件※3でした。
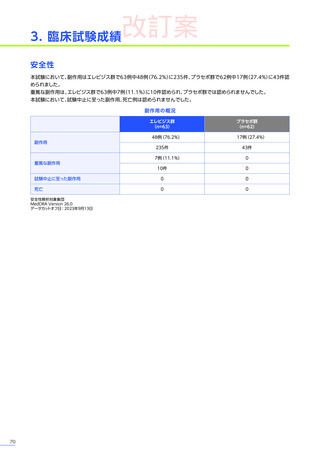
注意を要する副作用・
不具合とその対策
臨床試験において、肝毒性
(急性肝障害)
、臨床検査値基準に基づく生化学的な肝毒性
(急性肝障害)
が認められました。
処置としてコルチコステロイドの追加投与などが行われ、肝毒性を発現した80例中14例※4がコルチコステロイドの静脈内
投与を受けました。このうち、13例には高用量ステロイドパルス静脈内投与が行われ、12例が回復、1例が未回復※3でした。
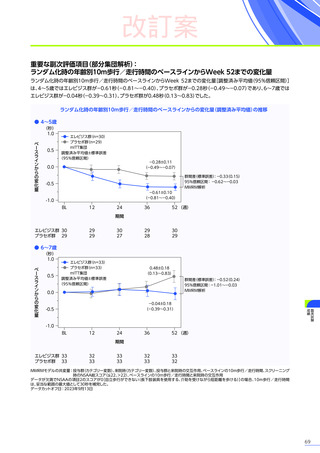
発現割合、初回発現までの期間別の発現割合、初回発現時期・ピーク時期・持続期間を以下の表に示します17)20)。
なお、海外において歩行不能なDMD患者で、急性肝不全により死亡に至った症例が報告されています※1。
※1:エレビジスの効能、効果又は性能は以下のとおりです。
デュシェンヌ型筋ジストロフィー
ただし、以下のいずれも満たす場合に限る
・抗AAVrh74抗体が陰性の患者
・歩行可能な患者
・3歳以上8歳未満の患者
※2:EMBARK試験
(DMD患者を対象とした国際共同第Ⅲ相試験)
、ENDEAVOR試験
(海外第Ⅰb相試験)
、SRP-9001-102試験
(海外第Ⅱ相試験)
、SRP-9001101試験
(海外第Ⅰ/Ⅱa相試験)
の4試験の患者を含めた解析
※3:承認申請のデータカットオフ時点。その後、回復に至っています。
※4:データを収集しなかったSRP-9001-101試験を除く
21