よむ、つかう、まなぶ。
総-1参考1 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64319.html |
| 出典情報 | 中央社会保険医療協議会 総会(第619回 10/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
はじめに
改訂案
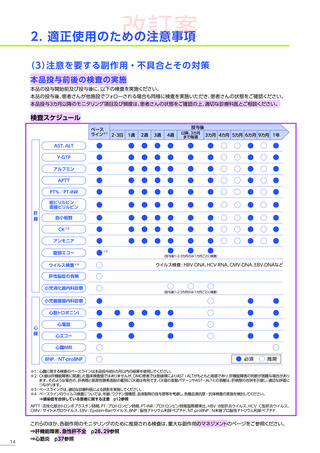
◆適正使用のお願い
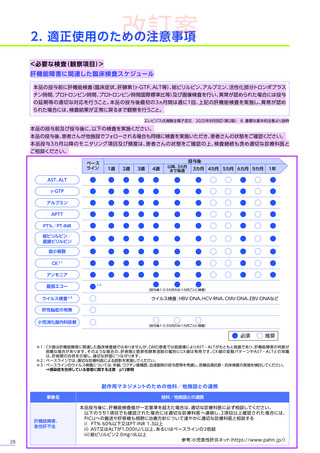
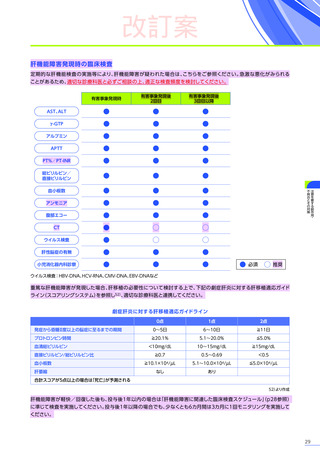
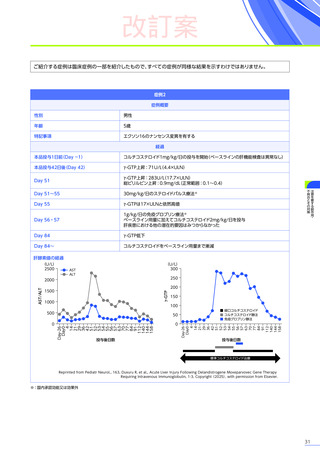
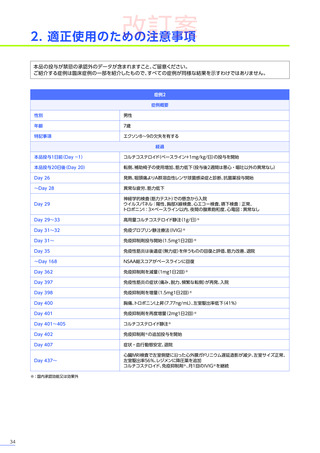
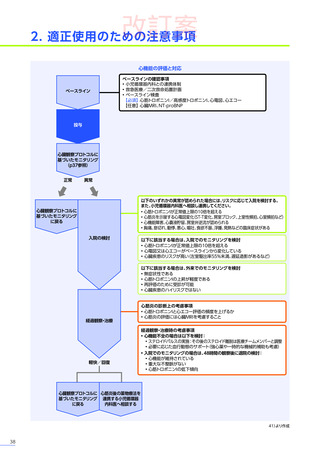
本適正使用ガイドは、エレビジスを適正に使用していただくため、本品投与開始前の適正な患者選択、投与後に特に注意
していただきたいこと、発現する可能性のある重大な副作用・不具合に関する詳細情報と対策及び投与後のフォロー
アップについて解説したものです。最新の電子化された添付文書
(以下、電子添文)
及び本適正使用ガイドを熟読いただき、
エレビジスのご使用にお役立てください。
エレビジス
(一般名:デランジストロゲン
モキセパルボベク)
は、Sarepta Therapeutics, Inc.(以下、Sarepta社)
で
創製された遺伝子組換えを施したアデノ随伴ウイルスrh74型
(AAVrh74)
を用いた再生医療等製品です。本品は、デランジ
ストロゲン モキセパルボベク マイクロジストロフィン
(以下、
マイクロジストロフィン)
をコードする遺伝子を筋細胞に送達し、
マイクロジストロフィンタンパク質を発現させることによりデュシェンヌ型筋ジストロフィー(DMD)
に対して効果を示すと
考えられています1)2)。本品は、単回静脈内投与製剤です。
本品の海外における臨床開発並びに米国での承認申請及び製造販売はSarepta社が担い、米国以外の承認申請及び製造
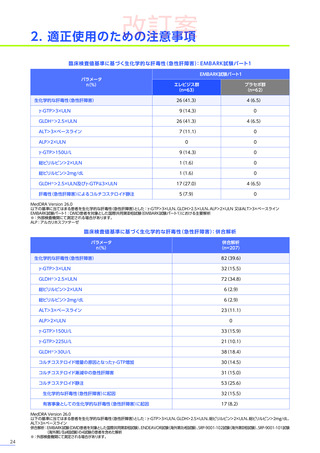
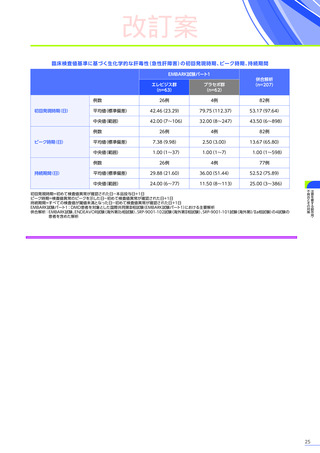
販売は、Sarepta社と提携し、F. Hoffmann-La Roche社が担っています。本邦では、DMD患者を対象とした国際共同
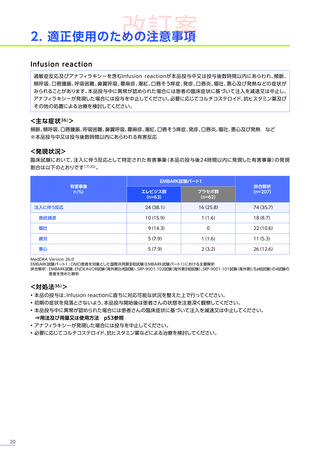
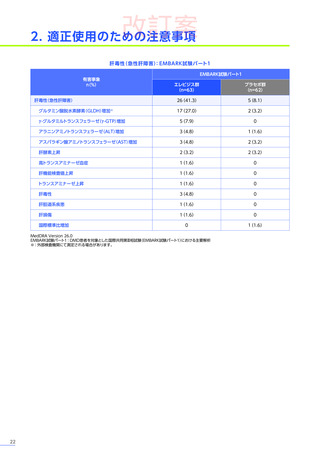
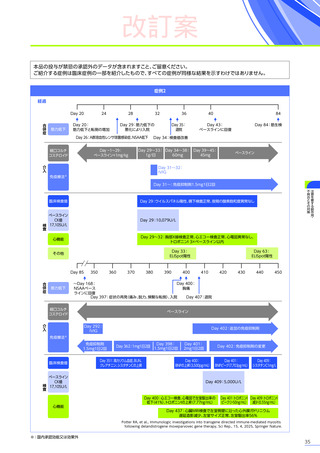
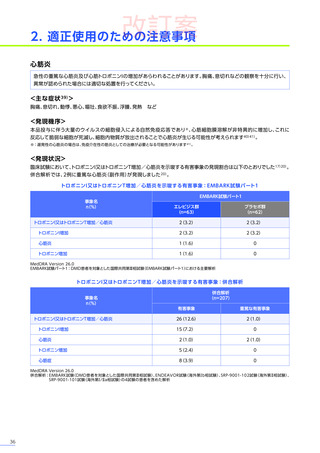
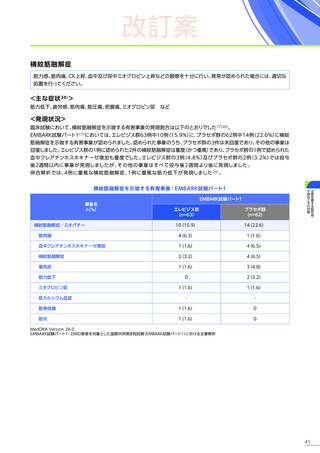
第Ⅲ相臨床試験(EMBARK試験パート1)の結果に基づき、2025年5月に「デュシェンヌ型筋ジストロフィー ただし、
以下のいずれも満たす場合に限る:抗AAVrh74抗体が陰性の患者、歩行可能な患者、3歳以上8歳未満の患者」
において
製造販売承認
(条件及び期限付承認品目)
を取得しました。
本品は、2024年7月30日に厚生労働省より
「デュシェンヌ型筋ジストロフィー」
に対する希少疾病用再生医療等製品
(指定
番号:
(R2再)
第16号)
に指定されました。また、本品は遺伝子組換え生物等の使用等の規制による生物の多様性の確保に
関する法律
(平成15年法律第97号)
第4条第1項の規定に基づき、第一種使用規程の承認を受けた遺伝子組換え生物等を
含む製品です
(名称:delandistrogene moxeparvovec、承認日:令和7年3月19日、承認番号:25-36V-0004)
。
本適正使用ガイドでは、本品の適正使用に関する注意事項や、副作用・不具合及び投与後のフォローアップについて
ご紹介しています。最新の電子添文、関連学会が定める適正使用指針などとともに本適正使用ガイドを熟読いただき、
本品を投与する患者さんの治療にお役立てください。
2
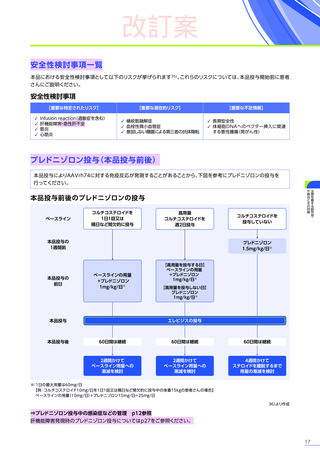
改訂案
◆適正使用のお願い
本適正使用ガイドは、エレビジスを適正に使用していただくため、本品投与開始前の適正な患者選択、投与後に特に注意
していただきたいこと、発現する可能性のある重大な副作用・不具合に関する詳細情報と対策及び投与後のフォロー
アップについて解説したものです。最新の電子化された添付文書
(以下、電子添文)
及び本適正使用ガイドを熟読いただき、
エレビジスのご使用にお役立てください。
エレビジス
(一般名:デランジストロゲン
モキセパルボベク)
は、Sarepta Therapeutics, Inc.(以下、Sarepta社)
で
創製された遺伝子組換えを施したアデノ随伴ウイルスrh74型
(AAVrh74)
を用いた再生医療等製品です。本品は、デランジ
ストロゲン モキセパルボベク マイクロジストロフィン
(以下、
マイクロジストロフィン)
をコードする遺伝子を筋細胞に送達し、
マイクロジストロフィンタンパク質を発現させることによりデュシェンヌ型筋ジストロフィー(DMD)
に対して効果を示すと
考えられています1)2)。本品は、単回静脈内投与製剤です。
本品の海外における臨床開発並びに米国での承認申請及び製造販売はSarepta社が担い、米国以外の承認申請及び製造
販売は、Sarepta社と提携し、F. Hoffmann-La Roche社が担っています。本邦では、DMD患者を対象とした国際共同
第Ⅲ相臨床試験(EMBARK試験パート1)の結果に基づき、2025年5月に「デュシェンヌ型筋ジストロフィー ただし、
以下のいずれも満たす場合に限る:抗AAVrh74抗体が陰性の患者、歩行可能な患者、3歳以上8歳未満の患者」
において
製造販売承認
(条件及び期限付承認品目)
を取得しました。
本品は、2024年7月30日に厚生労働省より
「デュシェンヌ型筋ジストロフィー」
に対する希少疾病用再生医療等製品
(指定
番号:
(R2再)
第16号)
に指定されました。また、本品は遺伝子組換え生物等の使用等の規制による生物の多様性の確保に
関する法律
(平成15年法律第97号)
第4条第1項の規定に基づき、第一種使用規程の承認を受けた遺伝子組換え生物等を
含む製品です
(名称:delandistrogene moxeparvovec、承認日:令和7年3月19日、承認番号:25-36V-0004)
。
本適正使用ガイドでは、本品の適正使用に関する注意事項や、副作用・不具合及び投与後のフォローアップについて
ご紹介しています。最新の電子添文、関連学会が定める適正使用指針などとともに本適正使用ガイドを熟読いただき、
本品を投与する患者さんの治療にお役立てください。
2