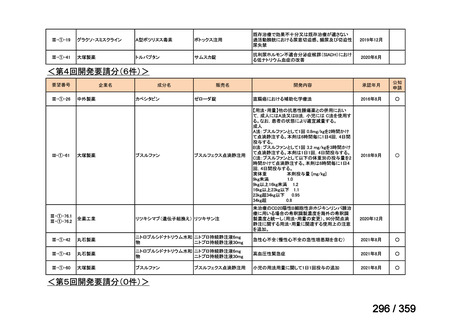
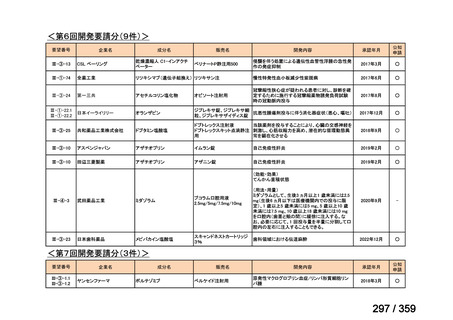
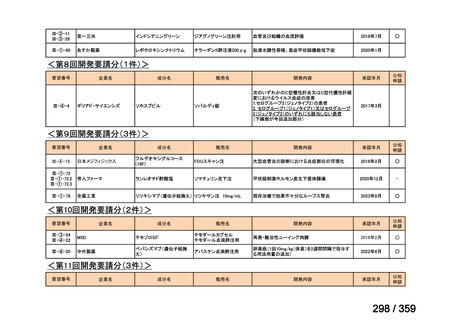
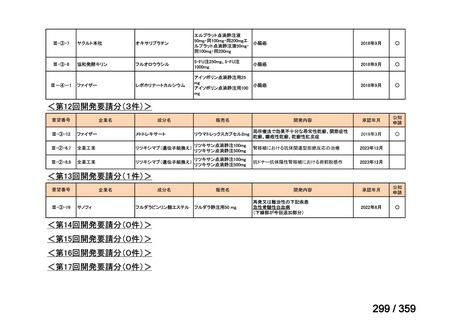
会議資料 (84 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
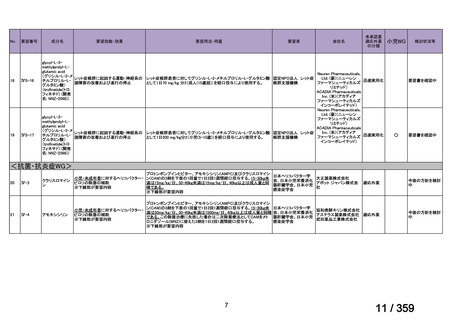
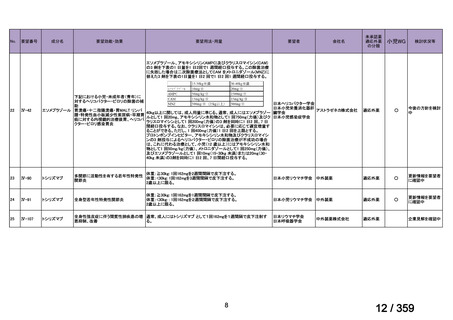
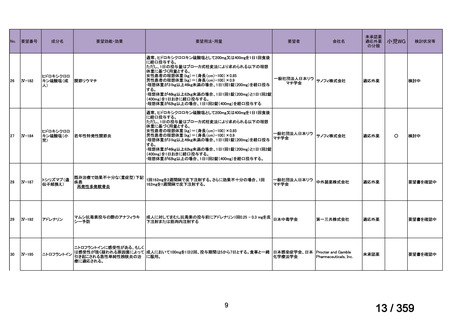
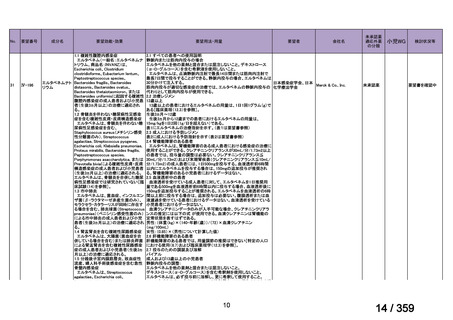
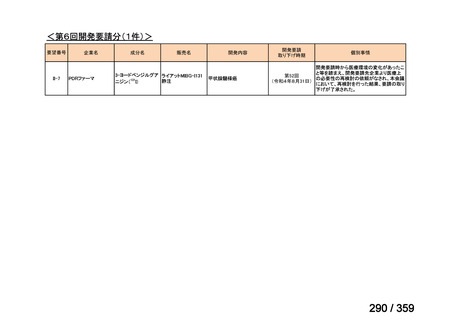
要望番号;IV-168
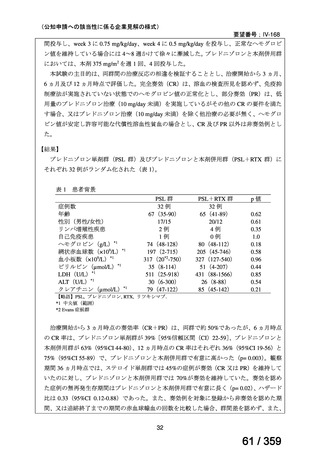
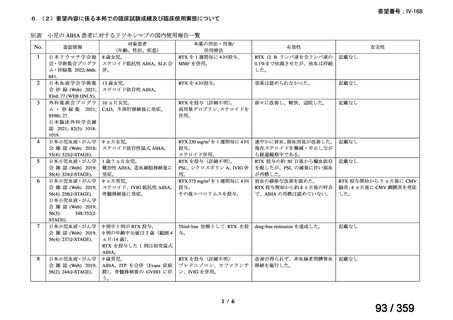
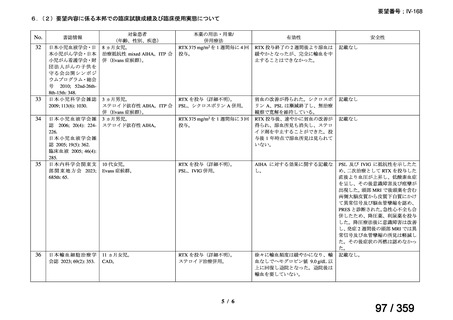
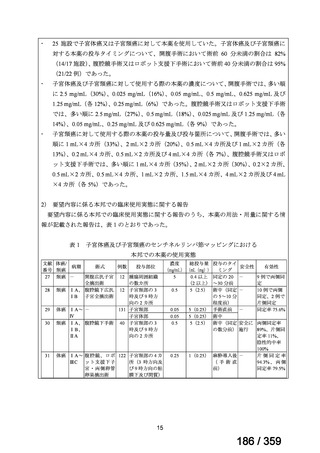
本邦において、本剤の小児 AIHA に対する開発は行われていない。
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
「5. 要望内容に係る国内外の公表文献・成書等について」に記載したとおり、本邦での臨
床試験成績に関する報告はないが、小児の AIHA 患者に対する本剤の症例報告が公表されて
いる(別表参照)。
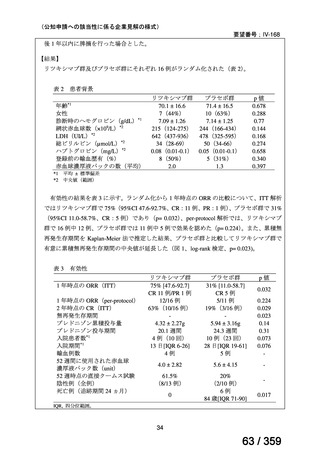
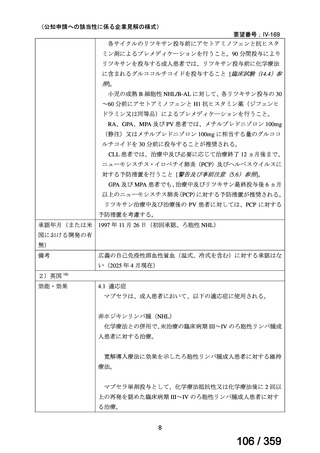
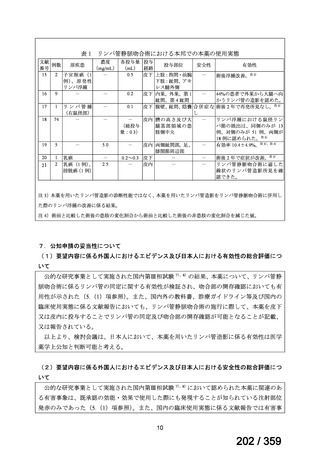
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
「5.要望内容に係る国内外の公表文献・成書等について」及び「6.本邦での開発状況
(経緯)及び使用実態について」に示したとおり、海外では成人の AIHA 患者を対象にした
比較試験等が実施され、本剤 375 mg/m2 を 1 週間間隔で 4 週間投与した場合の有効性が報告
されている。また、国内外で小児の AIHA 患者を対象とした本剤の比較試験は実施されてい
ないが、海外においては小児の AIHA 患者を対象にレジストリー研究や前方視的解析等が実
施され、本剤 375 mg/m2 を 1 週間間隔で 4 週間投与の有効性が報告されている。
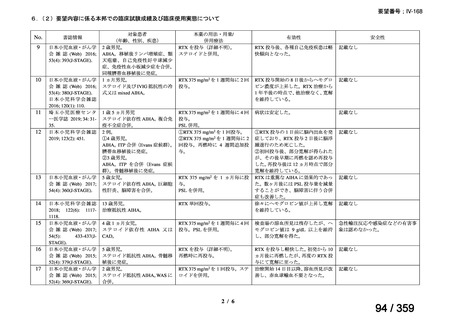
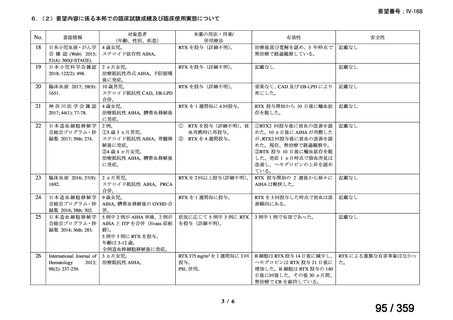
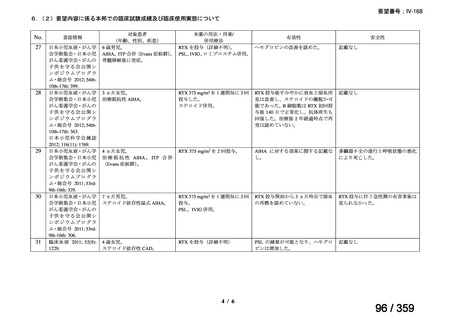
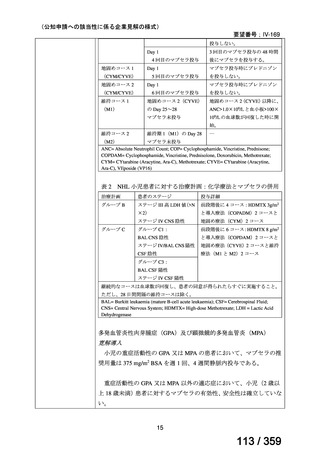
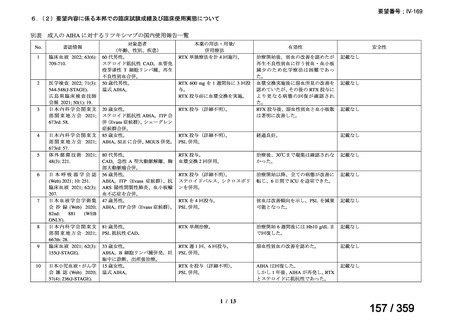
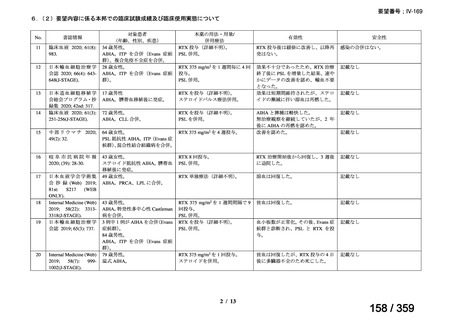
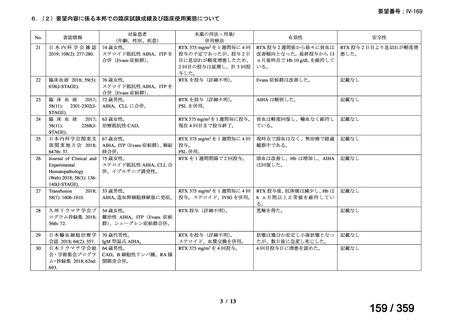
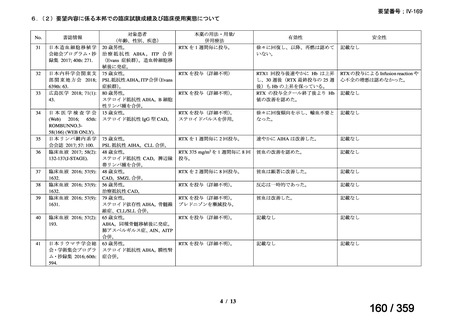
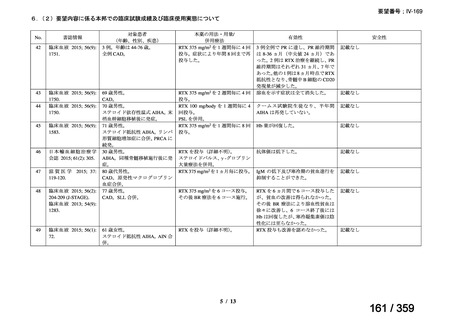
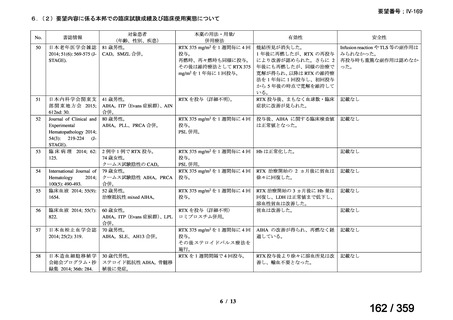
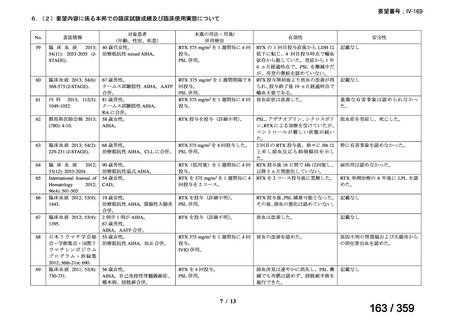
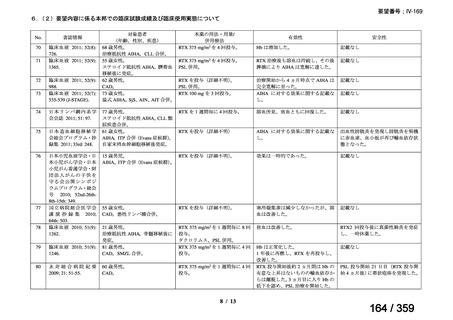
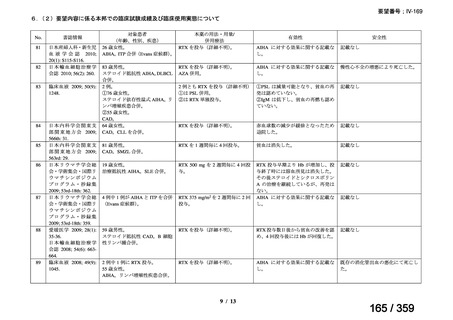
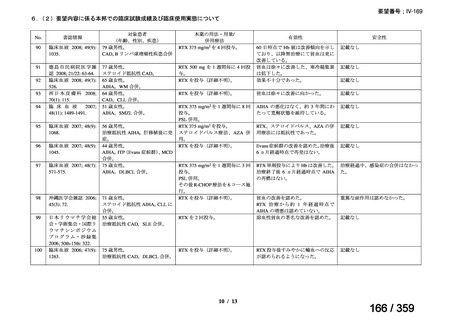
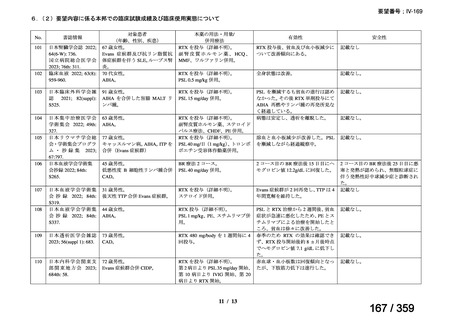
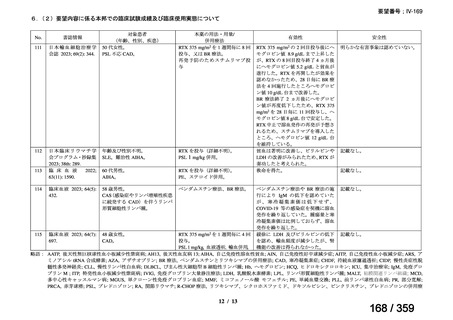
その他、国内における臨床使用実態が 37 件確認されており(別表参照)、文献報告間で患
者背景や併用薬剤に相違はあるものの、本剤を投与することにより、貧血、溶血所見の改善、
併用副腎皮質ステロイド薬の漸減や輸血への依存からの脱却等の効果が認められたと報告さ
れている。
本剤は、B 細胞表面の CD20 抗原に対するモノクローナル抗体であり、作用発現に人種差
はないことから、上記の海外で実施された臨床試験等の結果、メタ・アナリシス/システマ
ティックレビュー、総説、国内外の診療ガイドライン及び教科書の記述、並びに国内の使用
実態の状況を踏まえ、本剤の小児の AIHA 患者に対する有効性が期待できると考える。
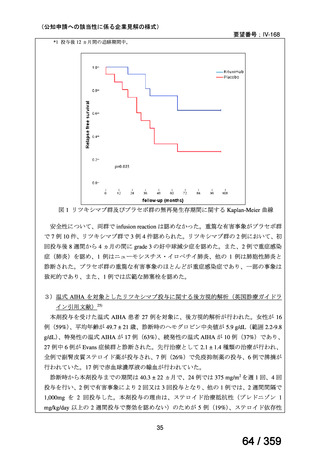
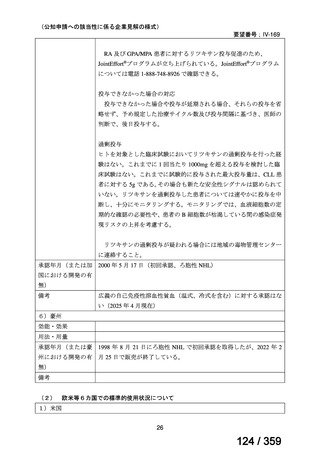
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
「5.要望内容に係る国内外の公表文献・成書等について」及び「6.本邦での開発状況
(経緯)及び使用実態について」に示したとおり、成人の AIHA 患者での忍容性が認められ
ており、さらに小児の AIHA 患者に対して本剤を投与した場合に確認された安全性情報は、
これまでに蓄積された本剤の安全性情報と同様であると考えられることから、本剤の特徴的
な副作用である infusion reaction や感染症に十分注意し、予防処置を実施することで、本邦に
おいても小児の AIHA 患者に対して本剤の投与は可能であると考える。
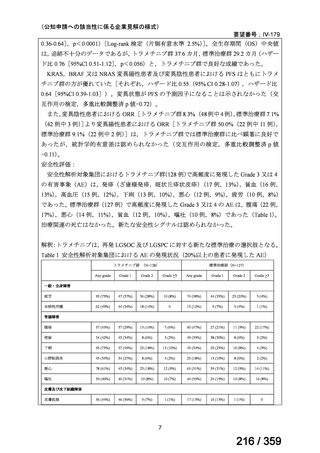
その他、国内における臨床使用実態が 37 件確認されているが(別表参照)
、本剤投与によ
る新たな有害事象の発現や、小児の AIHA 患者で特有な有害事象等は認められていない。
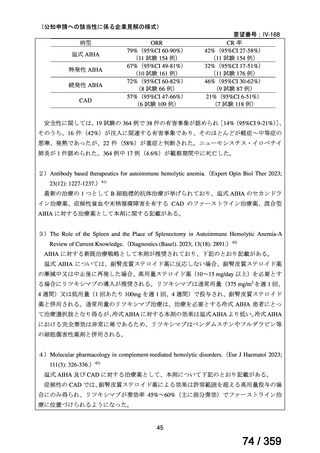
小児の AIHA 患者に対する本剤の投与によって報告された有害事象の多くは軽症から中等
55
84 / 359