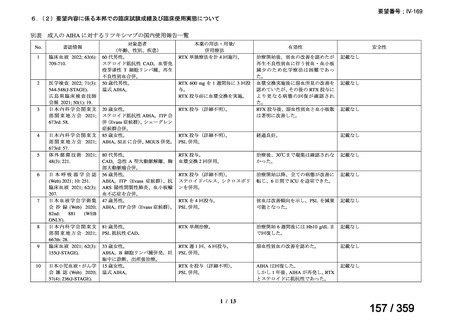
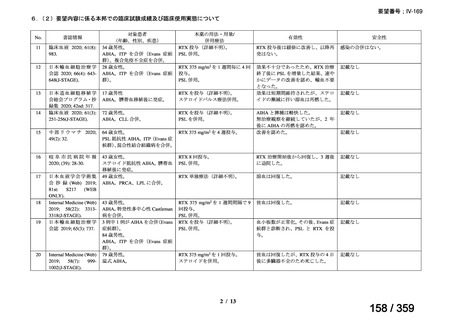
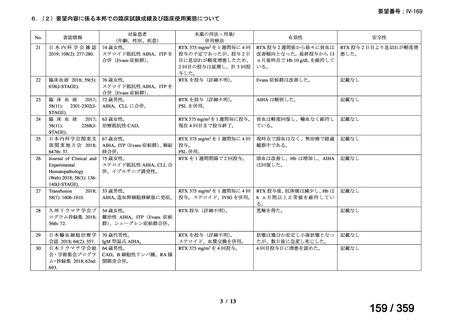
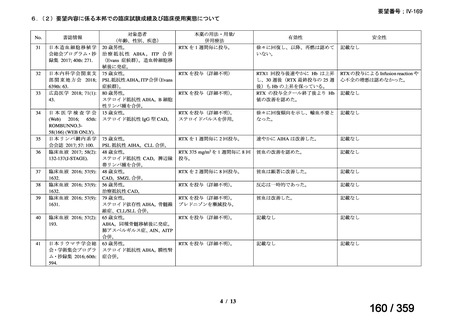
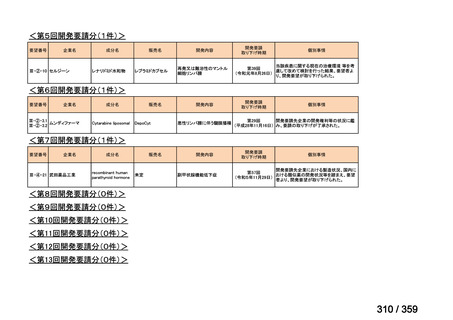
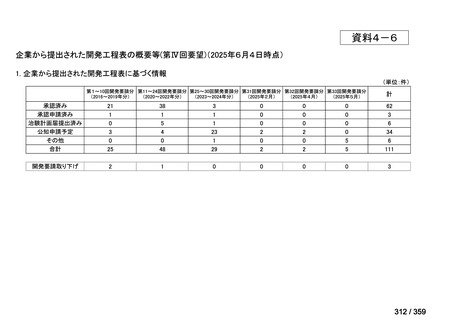
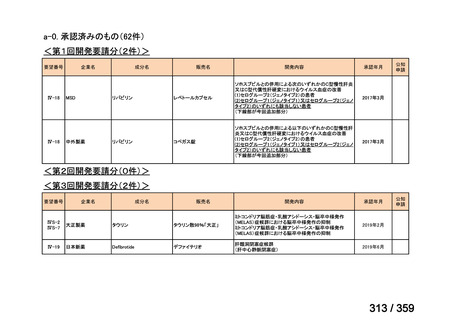
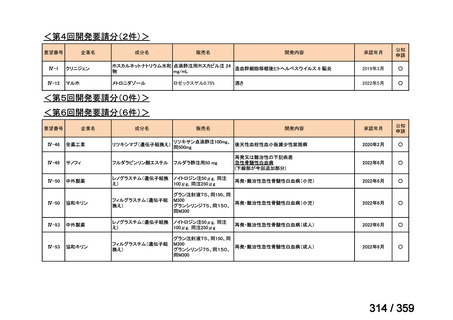
会議資料 (72 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
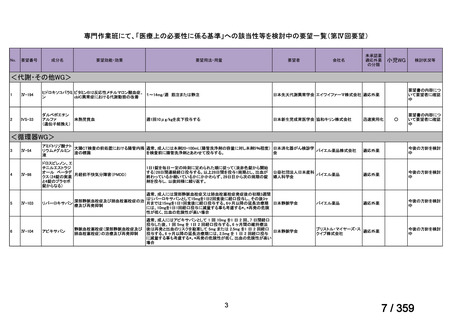
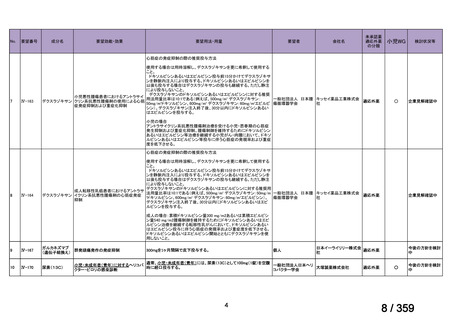
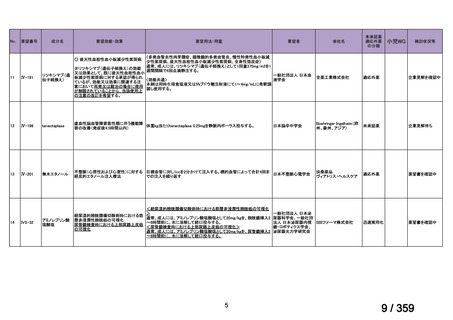
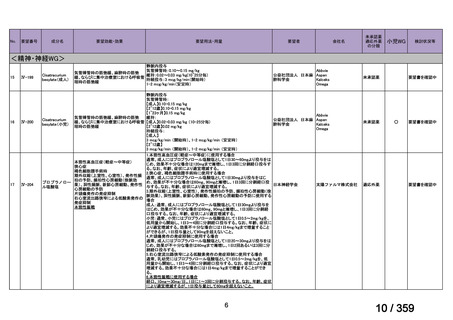
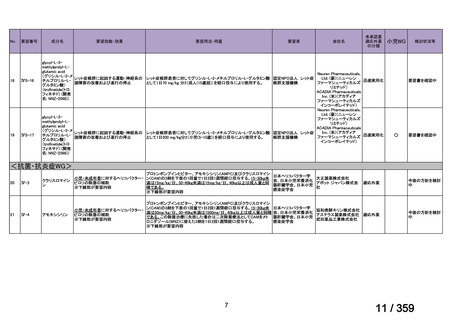
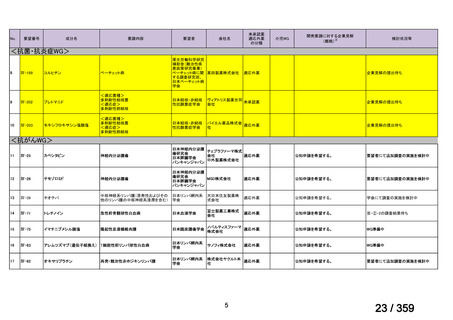
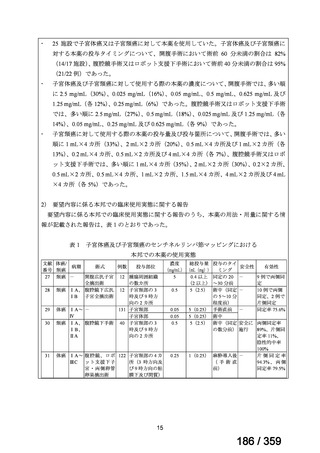
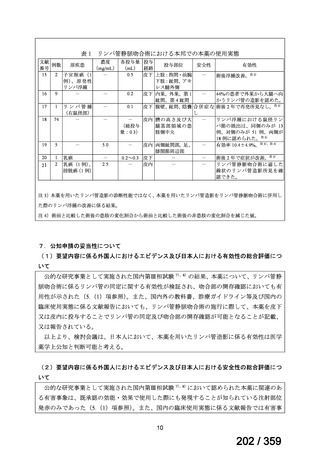
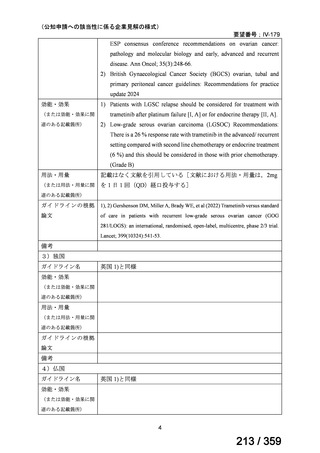
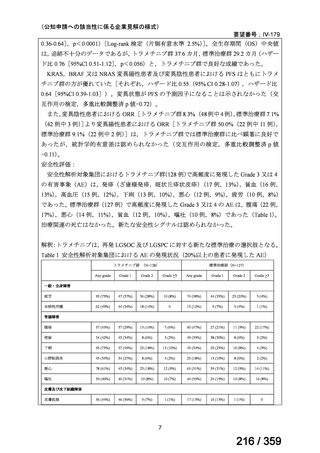
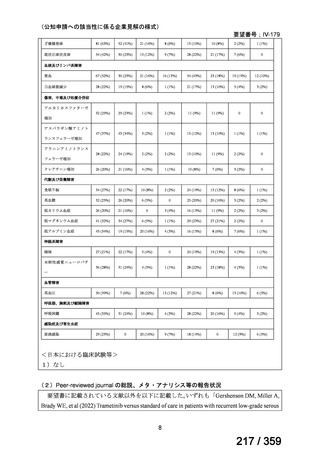
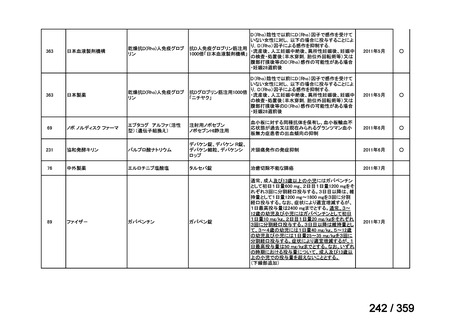
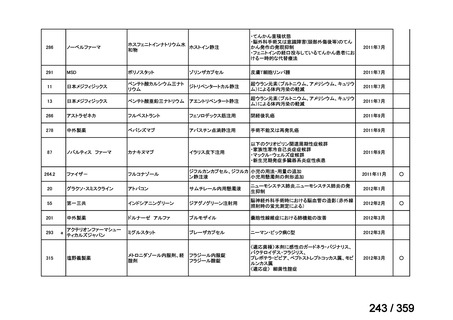
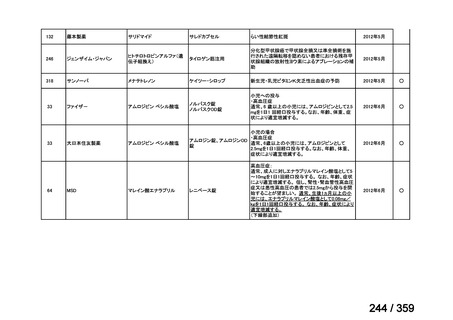
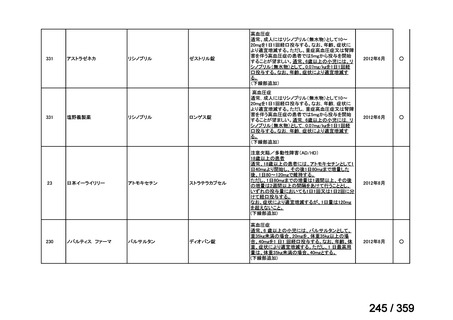
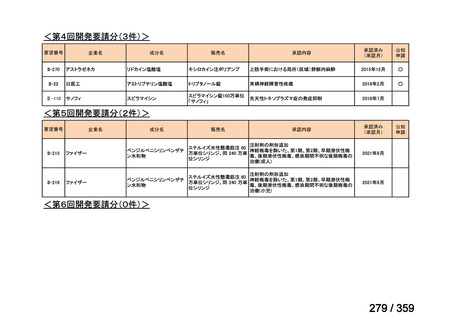
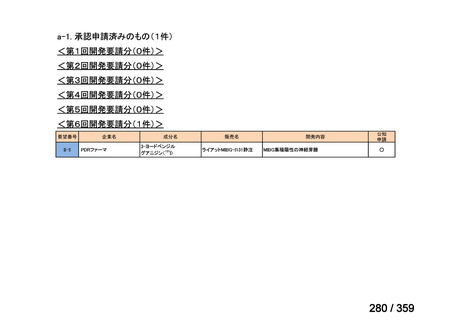
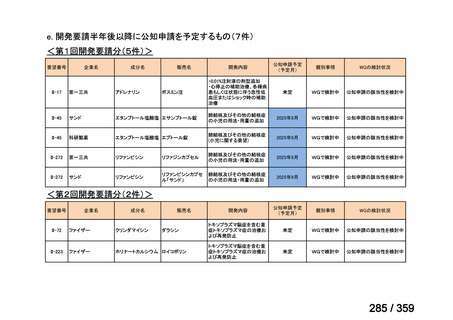
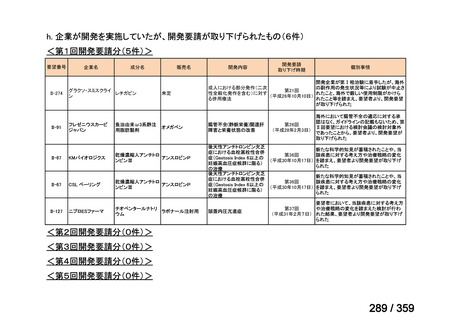
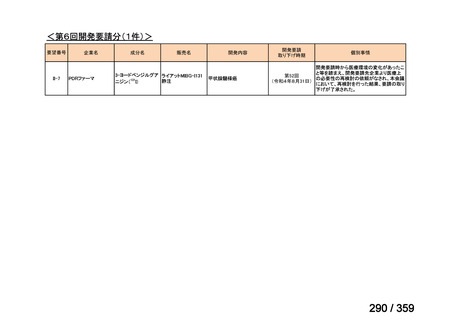
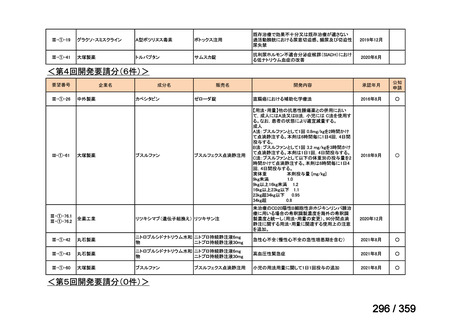
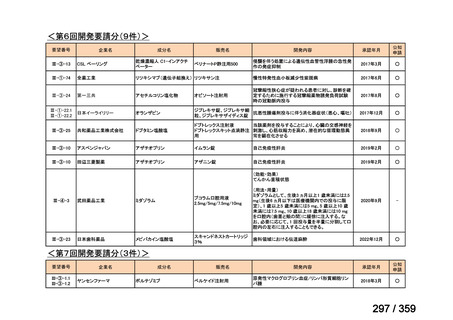
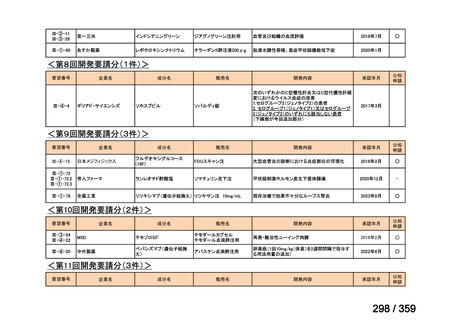
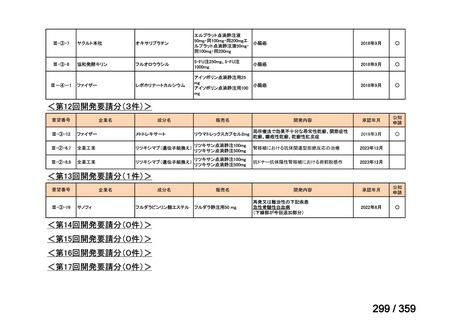
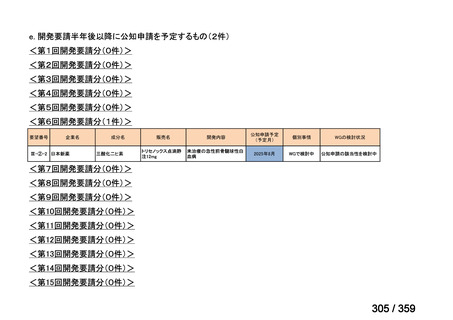
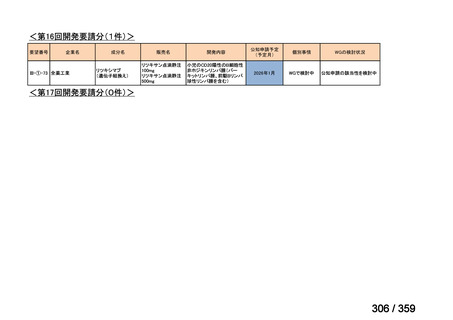
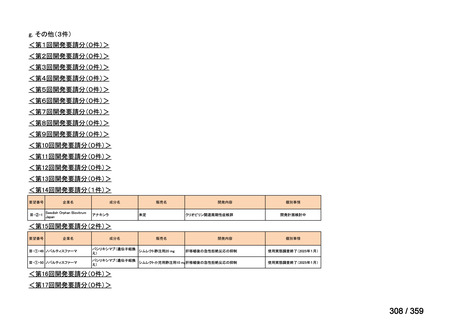
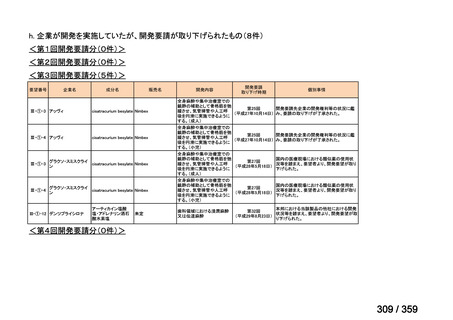
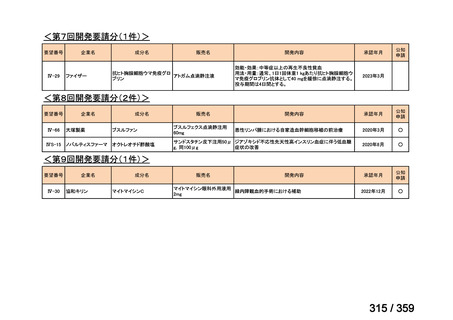
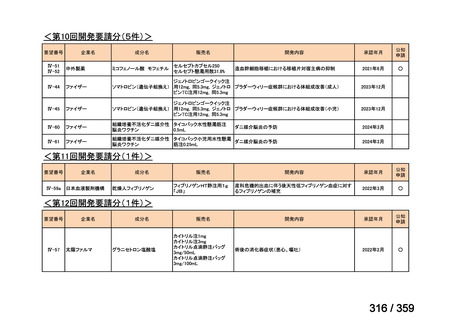
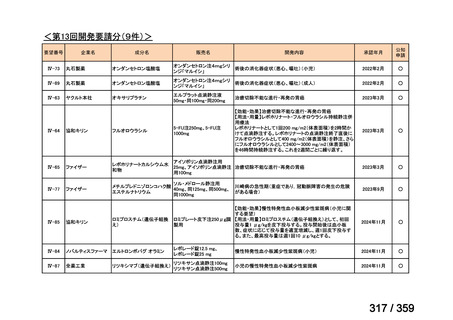
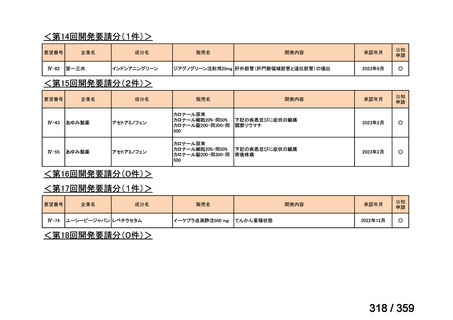
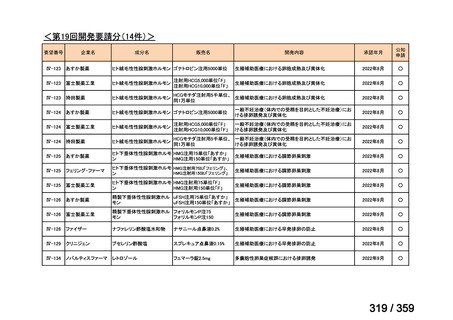
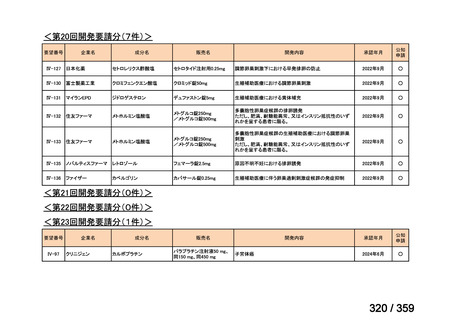
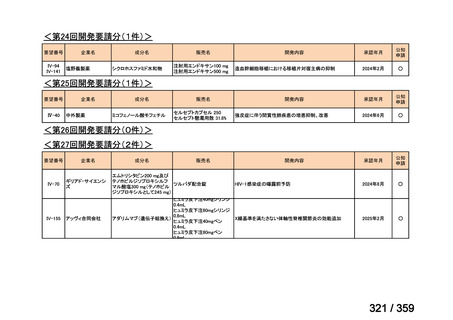
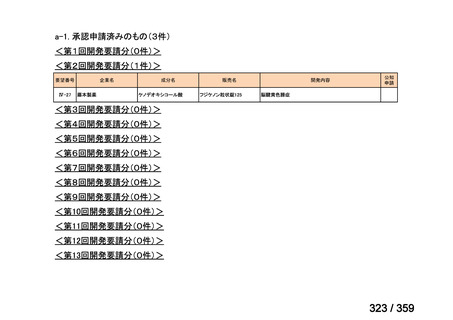
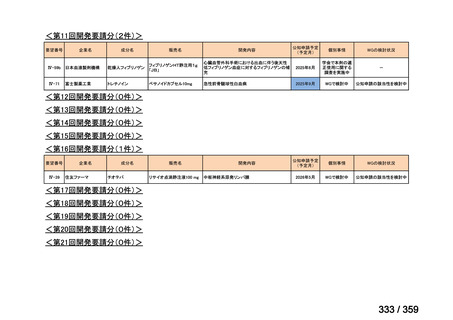
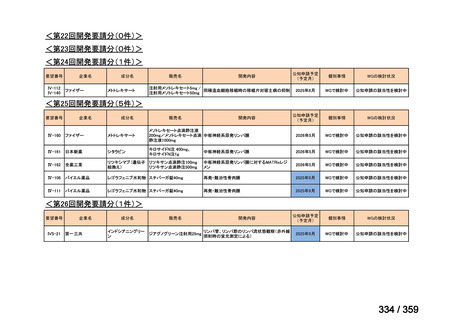
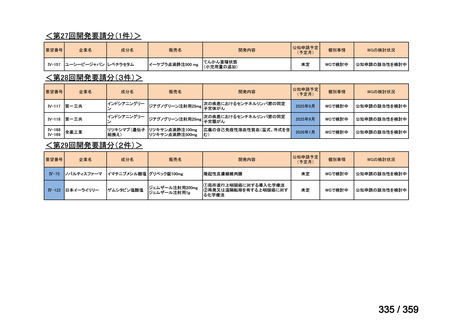
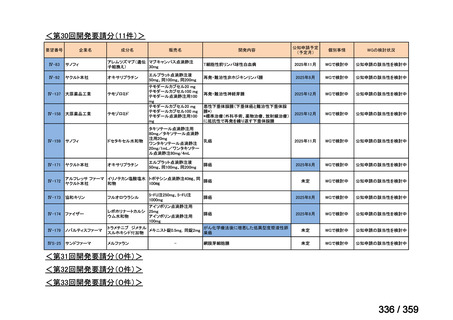
要望番号;IV-168
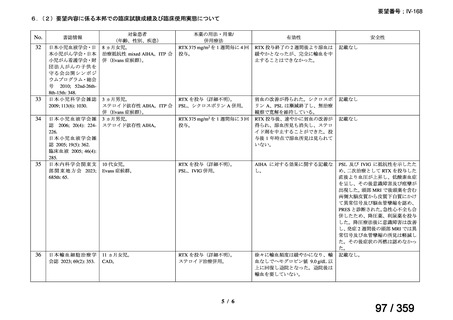
た副腎皮質ステロイド薬及び免疫抑制薬の漸減・中止が可能であった。奏効例の 3 例では
再発を認めたため(本剤初回投与から 7 ヵ月後、8 ヵ月後又は 10 ヵ月後)
、全例で本剤の
再投与を行ったところ、全例で奏効が認められた。1 例では再発に対して 3 コース及び 4
コース目の再投与が実施され、いずれも奏効を認めた。残りの 10 例については、治療後中
央値 13 ヵ月(範囲 10-28 ヵ月)時点で免疫抑制薬が不要であった。
本剤の忍容性は良好であり、3 例で中等症の infusion reaction(発熱が 2 例、上気道浮腫
が 1 例)を認めたものの対症療法で回復し、また、1 例では本剤投与から 2 ヵ月後に水痘
帯状疱疹ウイルス感染症を認めたが、抗ウイルス治療で回復し後遺症は認めなかった。
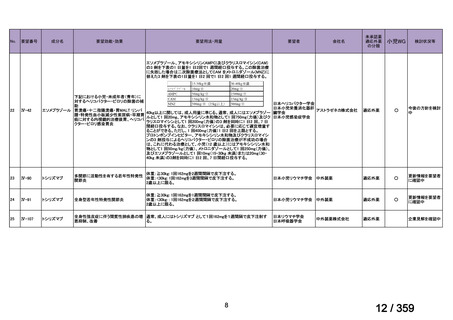
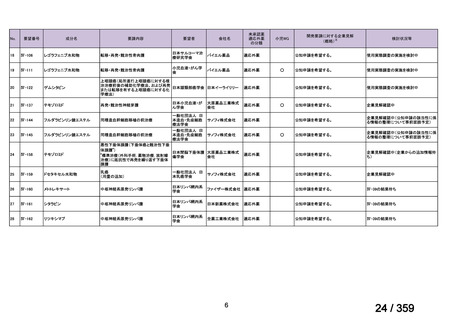
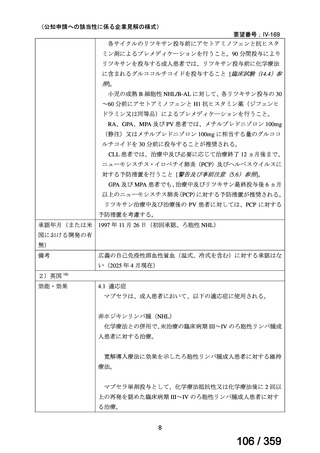
5)小児 AIHA を対象としたリツキシマブの有効性及び安全性に関するコホート研究 39)
仏国の小児 AIHA 又は Evans 症候群患者に対する本剤の有効性及び安全性を確認する前
方視的観察試験(OBS'CEREVANCE cohort)の結果について報告された。
2000 年 1 月から 2014 年 12 月の間に、Evans 症候群(AIHA に ITP が併存又は既往がある
15 例)又は AIHA(46 例)と診断された 61 例を対象に本剤が投与された。本剤は 375 mg/m2
を週 1 回、4 週間投与した。
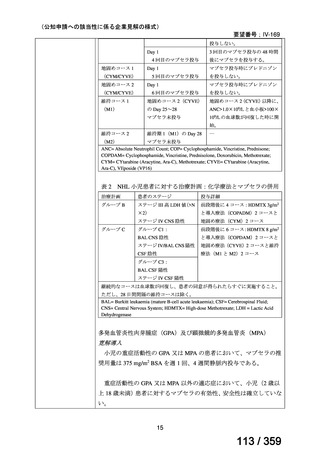
有効性評価の定義について、非奏効(NR)はヘモグロビン値が 70 g/L 未満、PR はヘモ
グロビン値が 70-110 g/L 及び/又は網状赤血球数が 120×109/L 超、
CR は直接クームス試験
及び治療に関係なくヘモグロビン値が 110 g/L 以上及び/又は網状赤血球数が 120×109/L
以下、持続的な CR(CCR)は無治療で再発を認めず CR が 1 年間持続する場合、ORR は
PR と CR の合計とした。
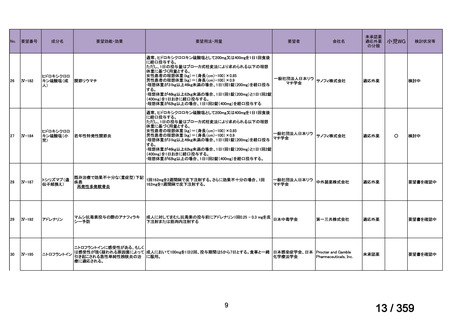
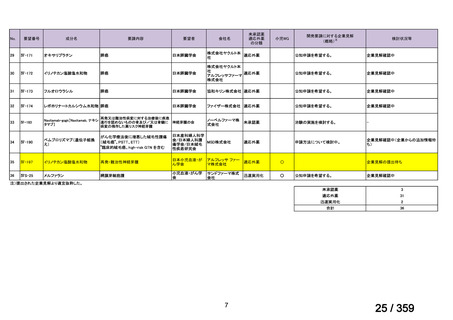
61 例の診断時の年齢中央値は 5.5 歳(IQR 2.7-12.4)
、ヘモグロビン値中央値 55 g/L(IQR
43-73)
、網状赤血球数中央値が 288.1×109/L(IQR 139-440)
、直接クームス試験 IgG 陽性が
28 例、IgG+C3d 陽性が 31 例、C3d のみ及び IgG+C3d と IgA 陽性がそれぞれ 1 例であった。
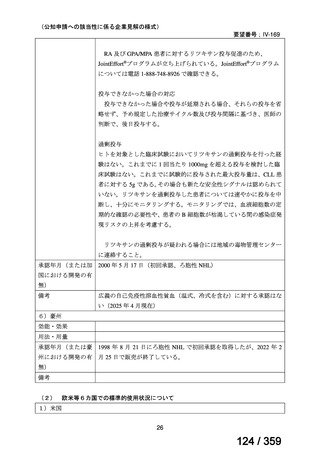
本剤投与開始時の年齢中央値は 8.5 歳(IQR 3.3-14.9)
、診断から本剤投与までの期間中央値
は 9.9 ヵ月(IQR l.6-28.5)
、本剤の投与回数は 4 回(範囲 2-12 回)
、前治療の種類は 1 種類
(範囲 1-5)であった。追跡期間中央値は、診断時から 6 年(IQR 3.8-9.3)
、本剤投与開始
後 4.3 年(IQR 2.5-7.8)であった。
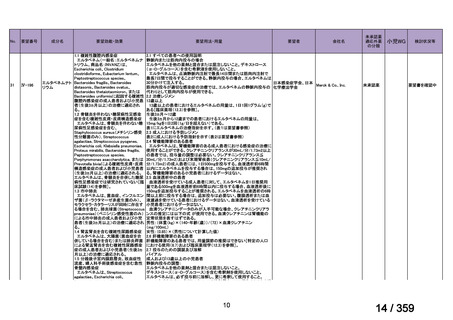
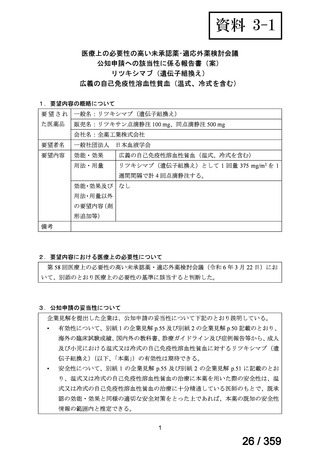
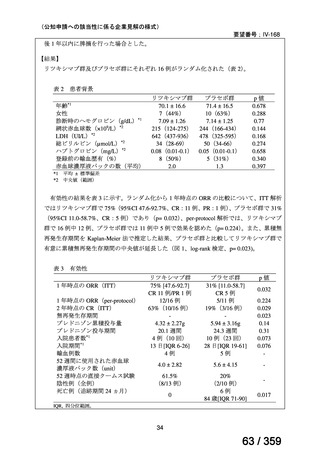
有効性について、ORR は 75%(46/61 例、CR 40 例、PR 6 例)
、治療効果を認めるまでの
期間中央値は 1.6 ヵ月(IQR 0.9-2.8)であり、本剤の投与が 4 回未満の 7 例中 4 例が CR で
あった。20 例で再発を認め、本剤投与開始後から再発までの期間中央値は 10.8 ヵ月(IQR
3.9-18.7)であり、PR 例で有意に短い傾向にあった[PR 例:2.7 ヵ月(IQR 2.3-5.7)、CR 例:
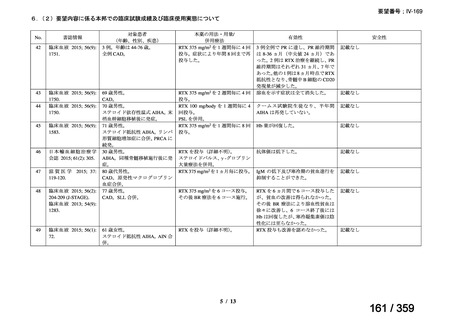
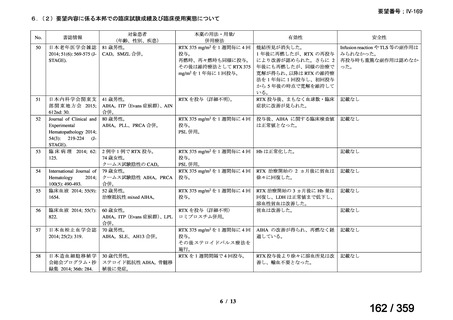
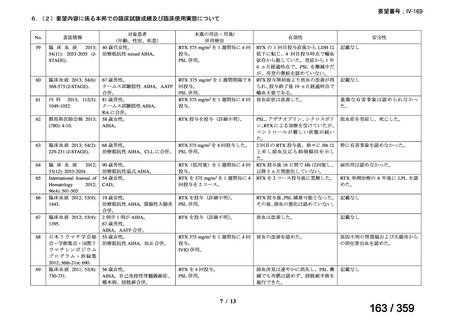
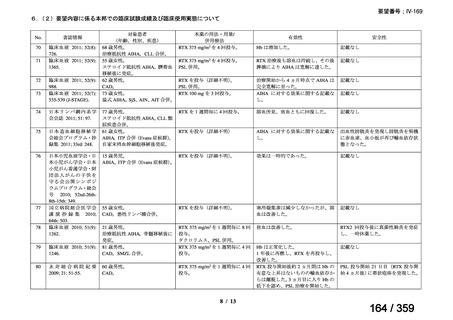
15.3 ヵ月(IQR 6.5-28.5)
]。6 年無再発生存率(RFS)は 48%であった。44 例(72%)では
副腎皮質ステロイド薬からの離脱が可能であった。Evans 症候群の症例と比較し、AIHA の
みの症例では CR 率が高く(AIHA のみ:74%、Evans 症候群:46%、p= 0.02)
、6 年 RFS 率
が有意に高かった(AIHA のみ:53%、Evans 症候群:36%、p= 0.04)
。61 例中 10 例は乳児
であり、そのうち 7 例で奏効を認め、6 年 RFS 率は 71%であった。
安全性について、2 例でアレルギー反応、1 例で血清病を認め、最長 11 年の追跡期間中
43
72 / 359