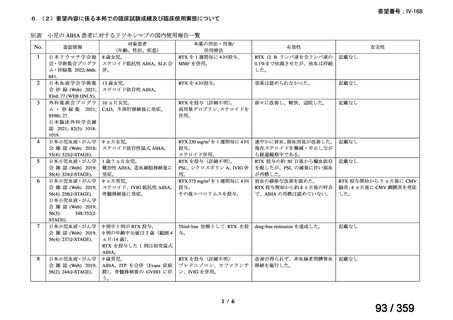
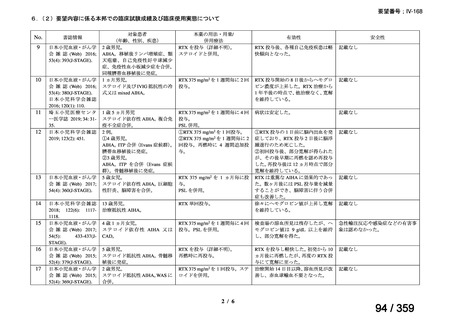
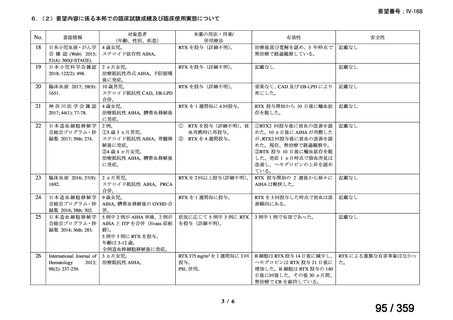
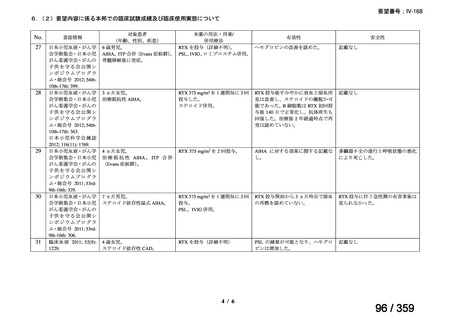
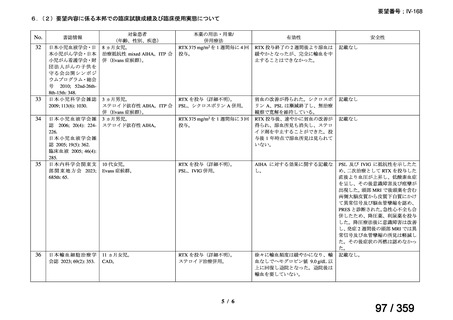
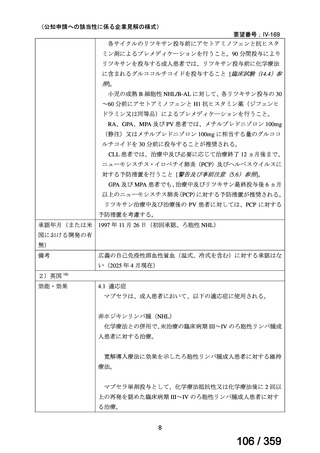
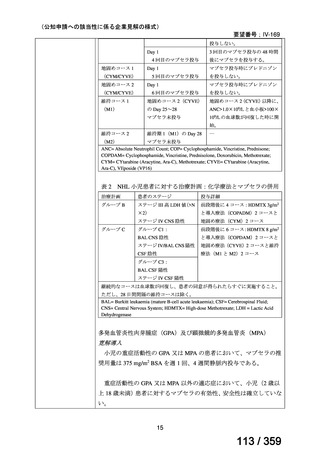
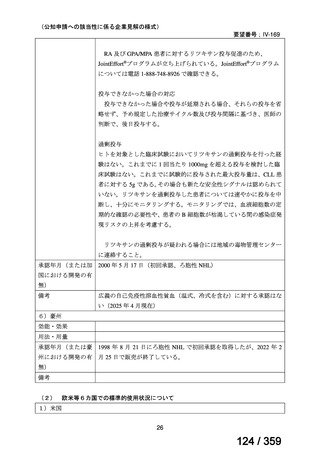
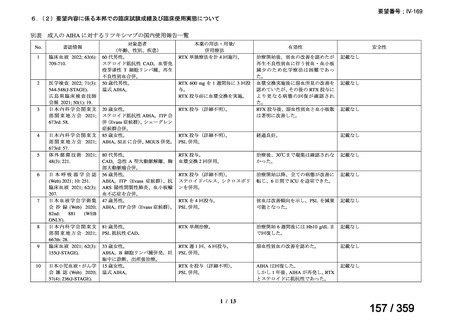
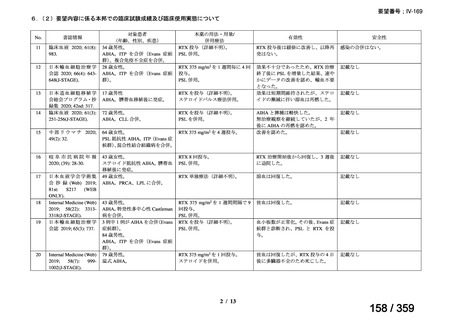
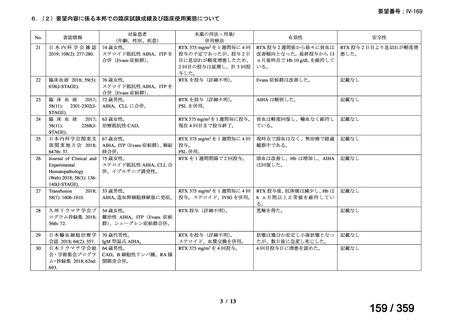
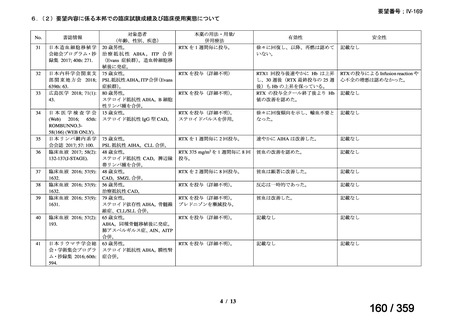
会議資料 (127 ページ)
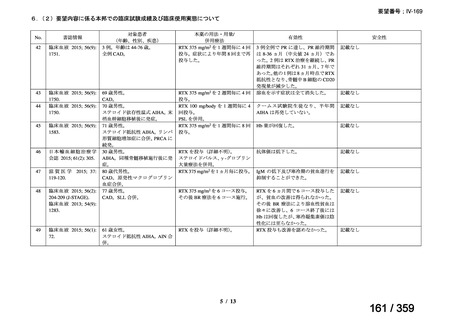
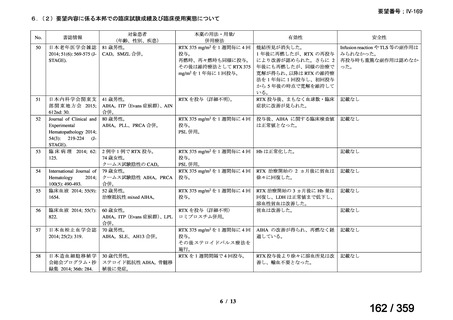
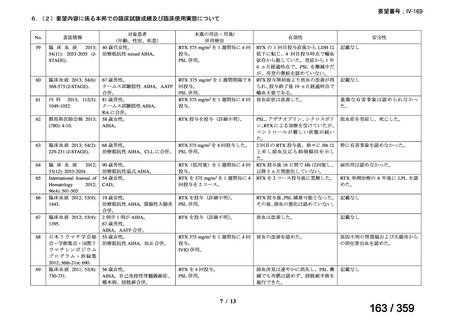
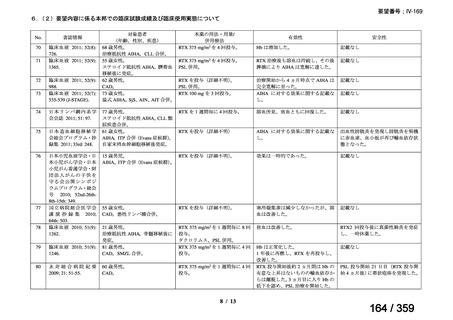
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
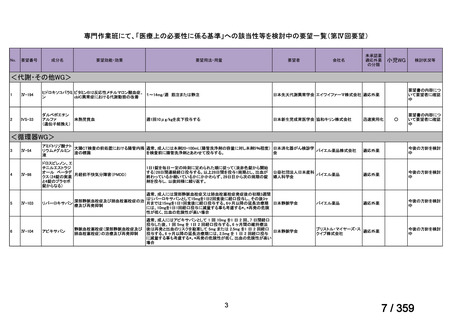
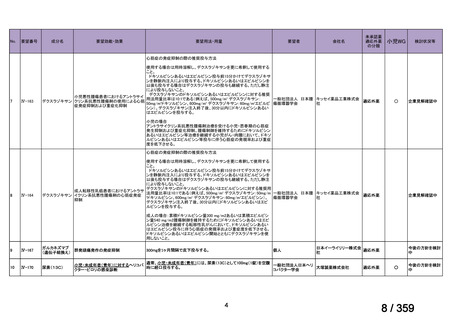
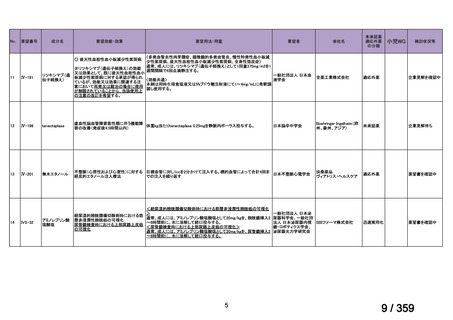
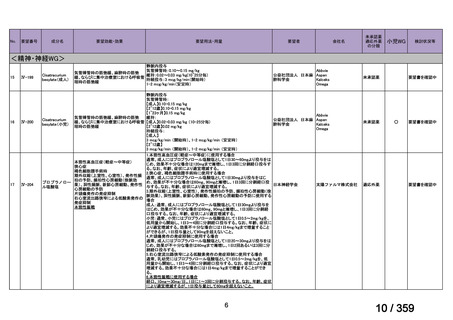
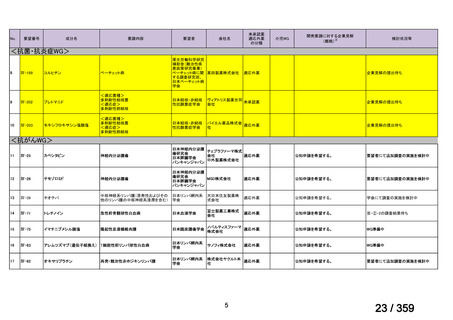
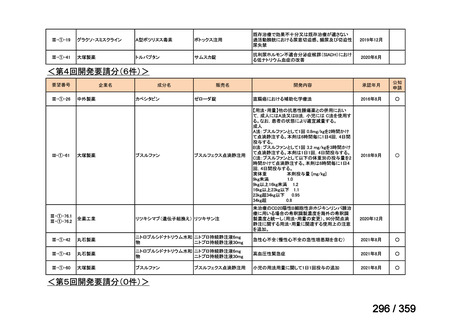
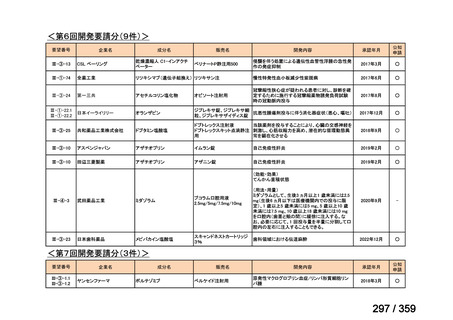
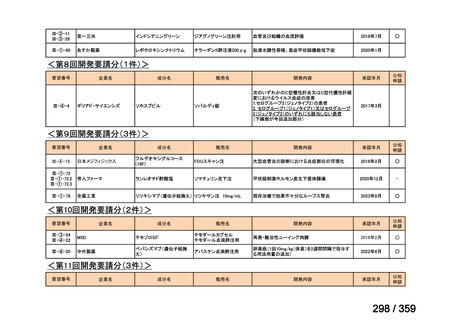
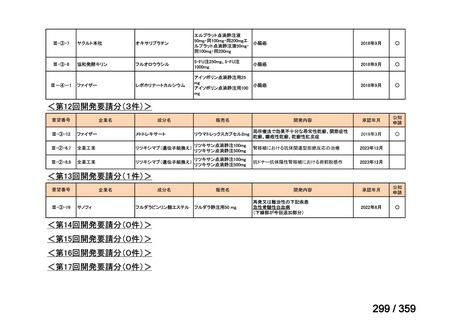
要望番号;IV-169
weekly for 4 weeks was 51% (27/53) [n= 4/6 (Berentsen et al, 2001), n=
14/27 (Berentsen et al, 2004), n= 9/20 (primary and secondary CHAD)
(Schollkopf et al, 2006)] and treatment was well tolerated. However
57-89% relapsed with a median response duration of 6.5-11 months. In a
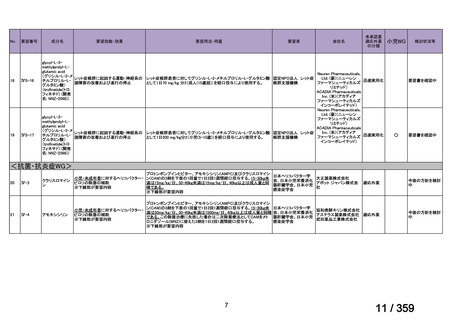
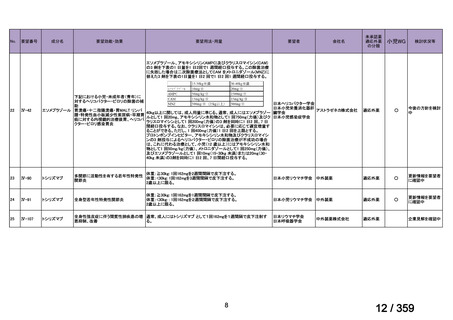
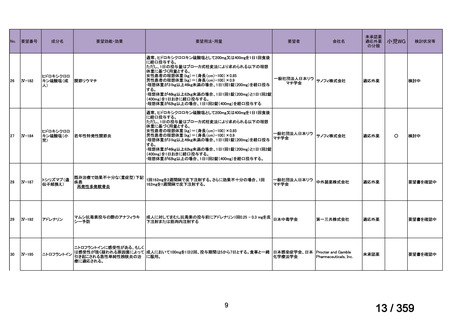
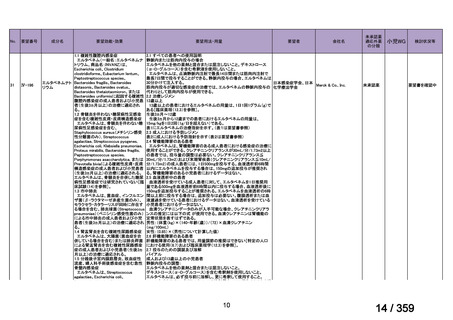
prospective study of rituximab combined with fludarabine, the response
rate was 76% and estimated median response duration >66 months
although 44% had grade 3-4 haematological toxicity (Berentsen et al,
2010).
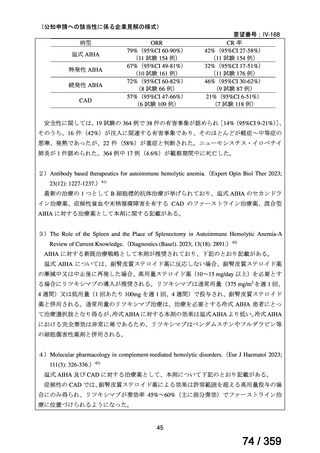
前向き研究において、リツキシマブ 375 mg/m2 を週 1 回、4 週間投
与した場合の全奏効率は 51%(27/53 例)
[n= 4/6(Berentsen et al,
2001)
、n= 14/27(Berentsen et al, 2004)
、n= 9/20(primary and secondary
CHAD)
(Schollkopf et al, 2006)
]であり、治療に対する忍容性は良
好であった。しかし、57~89%が再発し、奏効期間中央値は 6.5~
11 ヵ月であった。リツキシマブとフルダラビンを併用した前向き
試験では、奏効率は 76%、奏効期間中央値は 66 ヵ月以上であった
が、44%に grade 3 又は 4 の血液毒性が認められた(Berentsen et al,
2010)
。
(下線部は要望内容に係る部分)
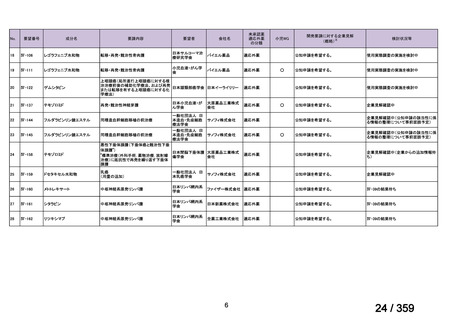
ガイドラインの根拠
1. 温式 AIHA:24), 25), 26), 27), 28), 29), 55), 56)
論文
2. CAD:30), 31), 32), 57)
備考
原発性免疫不全症に合併する血球減少(AIHA を含む)に対する本剤
治療について、保険償還有り 33)。
(用法・用量に関する記載はなし)
3)独国
ガイドライン名
該当なし
効能・効果
(または効能・効果に関
連のある記載箇所)
用法・用量
(または用法・用量に関
連のある記載箇所)
ガイドラインの根拠
論文
備考
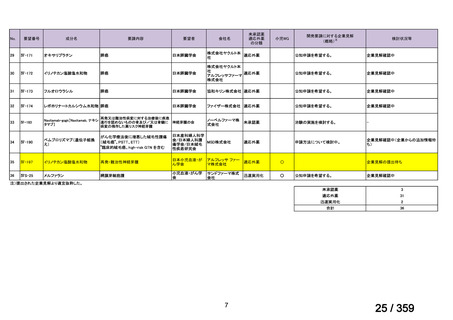
4)仏国
ガイドライン名
該当なし*1
効能・効果
(または効能・効果に関
29
127 / 359