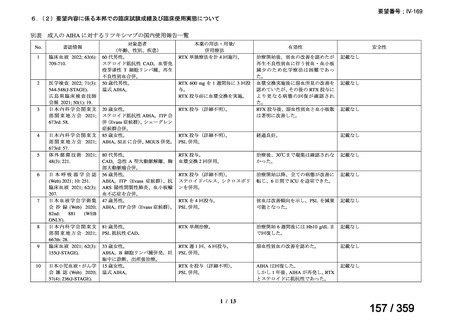
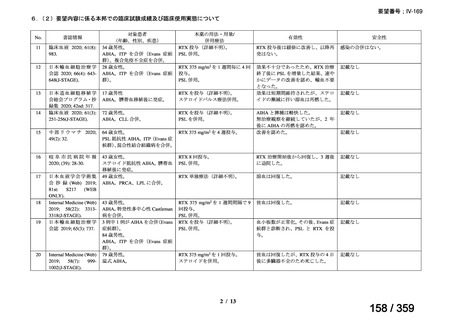
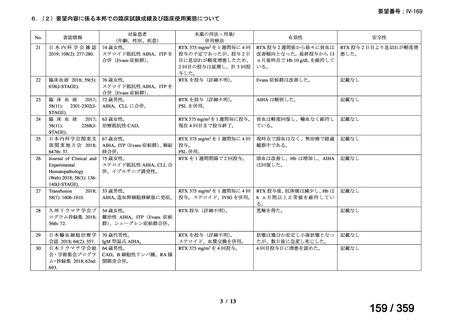
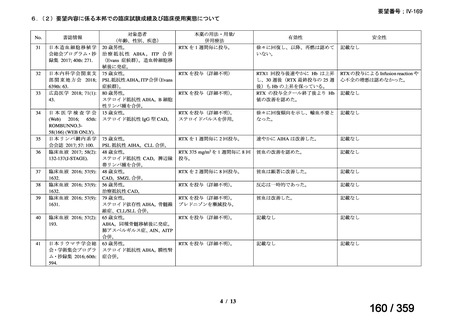
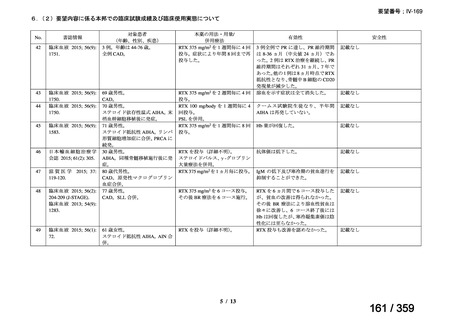
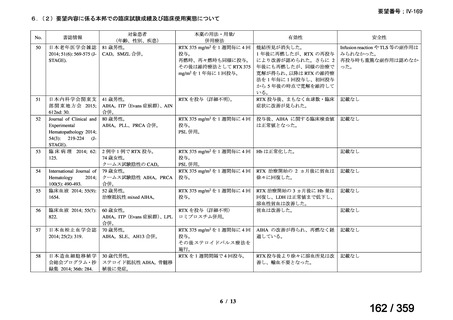
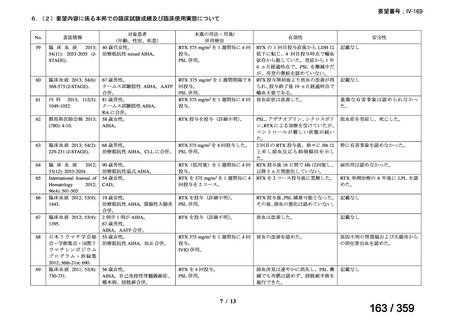
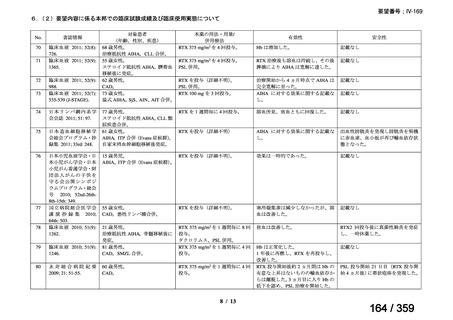
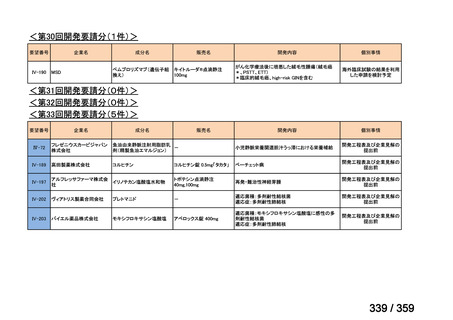
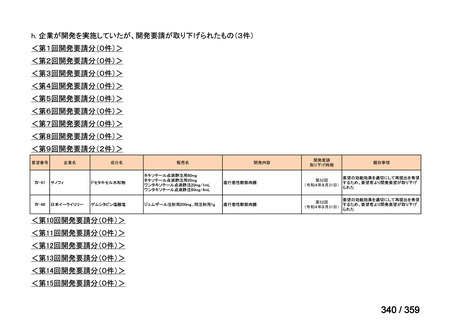
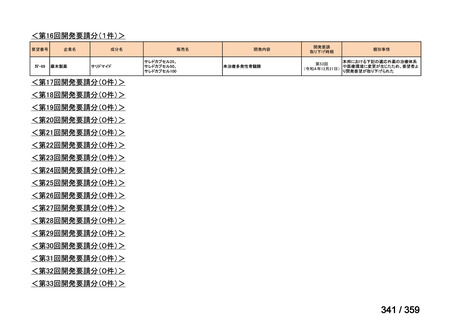
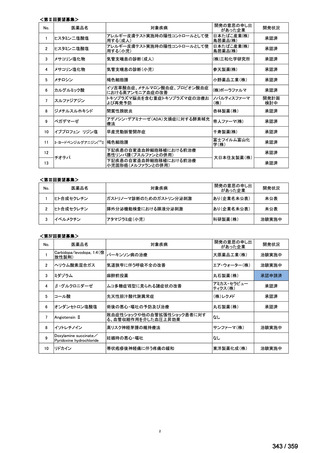
会議資料 (52 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
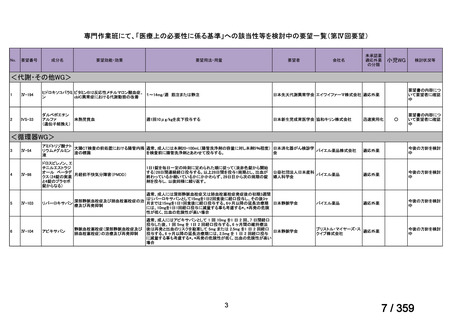
要望番号;IV-168
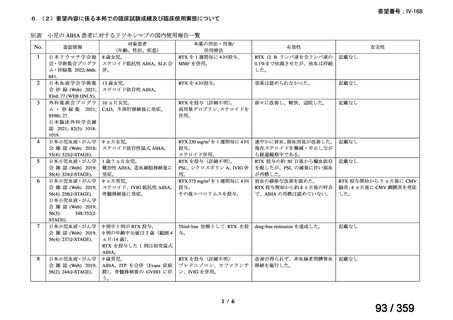
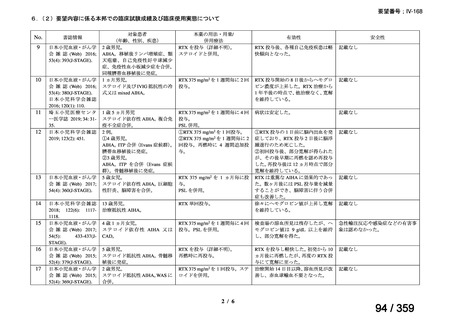
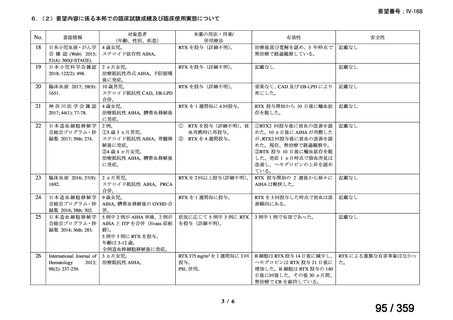
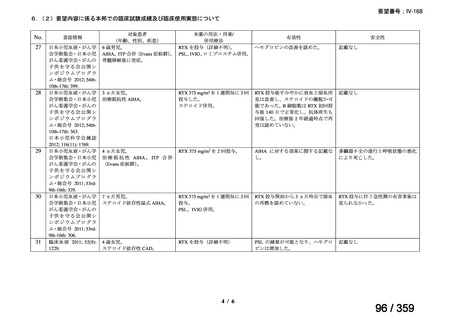
再治療は、前回治療から 24 週後に疾患活動性の評価を行い、疾患活
動性が残存する場合又は疾患活動性が再度 DAS28-ESR の 2.6 を超えた
場合に考慮する(寛解導入)。前回治療から 16 週間以内に再治療を行
わないこと。
多発血管炎性肉芽腫症(GPA、ヴェゲナ肉芽腫症)及び顕微鏡的多発
血管炎(MPA)
GPA/MPA に対するリツキサンの推奨投与量は 375 mg/m2(体表面
積)とし、週 1 回、4 週間投与する。
重症の血管炎症状を有する患者では、メチルプレドニゾロン 1000
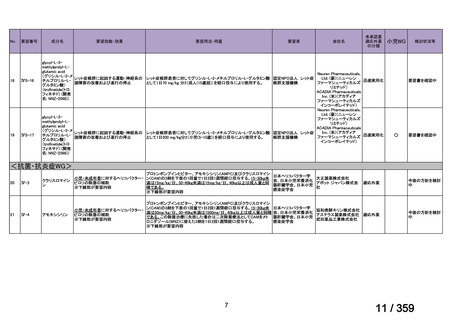
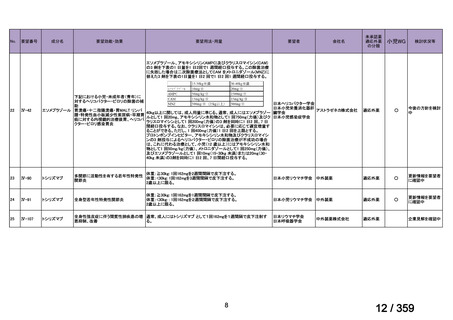
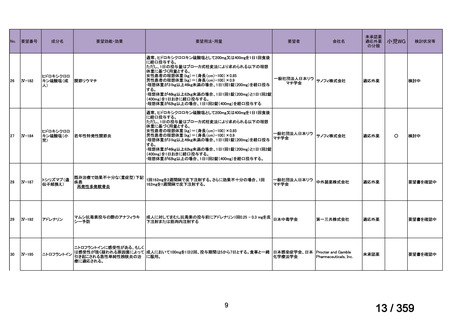
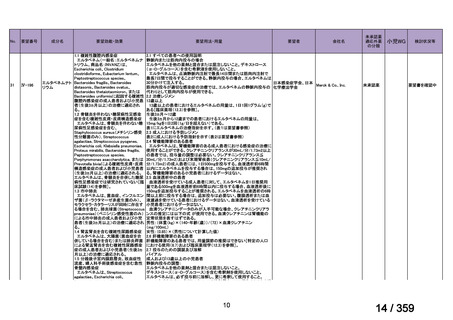
mg/day を 1~3 日間投与し、その後、経口プレドニゾン 1 mg/kg/day(但
し、80 mg/day を超えることなく臨床経過に応じて漸減する)の併用を
推奨する。この治療は、リツキサン投与開始前の 14 日以内、又はリツ
キサン投与開始と同時に開始し、リツキサン投与中及び 4 週間の投与
終了後も継続する。
リツキサン再治療時の安全性及び有効性については確立していない
(7 WARNINGS AND PRECAUTIONS 及び 14 CLINICAL TRIALS 参
照)
。
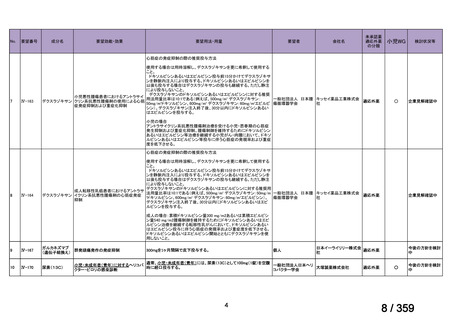
4.3 調製
非経口薬剤:
投与準備:
適切な無菌操作を用いること。無菌の注射針及びシリンジを用いる。
リツキサンは防腐剤や静菌剤を含有していない。必要量のリツキサン
を採取して輸注バッグ中の最終濃度が1~4 mg/mLとなるよう0.9%生
理食塩液(米国薬局方)又は5%ブドウ糖液(米国薬局方)で希釈する。
泡立ちを防ぐため、穏やかにバッグを反転し液を混和すること。バイ
アル中に残存する未使用の薬剤は全て破棄すること。バイアル中の薬
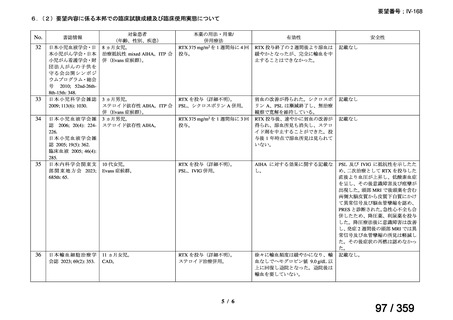
剤は、投与に先立ち、異物や微粒子、変色を目視で検査する。使用中
の安定性については製品情報の11 STRAGE, STABILITY AND
DISPOSALを参照。
配合変化
リツキサンは、ポリ塩化ビニル又はポリエチレンバッグによる配合変
化は確認されていない。
23
52 / 359