会議資料 (190 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
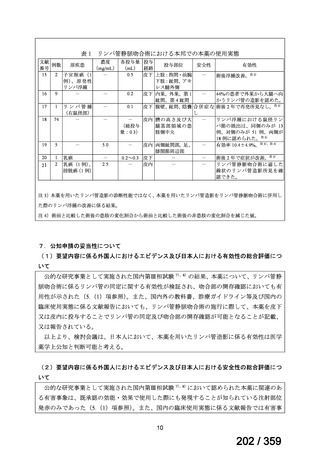
における総投与量は 0.25~2.5 mg であり、海外の承認用法・用量における総投与量(5 mg)
の投与実態は直接的には確認できないが、国内のアンケート調査の結果から、約 4 割(開
腹手術:42%、腹腔鏡手術又はロボット支援下手術:41%)の施設で 1.25 mg/mL 又は 2.5 mg/mL
の濃度、過半数(開腹手術:60%、腹腔鏡手術又はロボット支援下手術:80%)の施設で 4 mL
以上の容量が使用されていることが確認できることから(6.(2)項参照)、総投与量とし
て 5 mg は、本邦における使用実態の範囲内と考える。以上より、総投与量は 4 mL(5 mg)
とすることが妥当と判断する。
3)RI 法との併用について
本薬の既承認の効能・効果である乳癌及び悪性黒色腫のセンチネルリンパ節の同定につ
いて、用法・用量に関連する注意において、
「可能な限り本剤とラジオアイソトープ法を併
用することが望ましい。その際には、併用する薬剤の電子添文を参照した上で使用するこ
と。」とされている。一方、子宮体癌及び子宮頸癌のセンチネルリンパ節の同定について、
国内外の診療ガイドラインにおいて、本薬を用いた蛍光法と RI 法の併用を推奨する記載は
なく、海外のメタ・アナリシスにおいて、本薬を用いた子宮体癌及び子宮頸癌のセンチネ
ルリンパ節の同定率が RI 法と同等かそれ以上であることが報告されている(5.(2)及び 5.
(4)項参照)。以上より、子宮体癌及び子宮頸癌のセンチネルリンパ節の同定における本
薬の使用においては、可能な限り RI 法と併用する旨の注意喚起を行う必要はないと判断す
る。
9.要望内容に係る更なる使用実態調査等の必要性について
(1)要望内容について現時点で国内外のエビデンスまたは臨床使用実態が不足している点
の有無について
検討会議は、要望内容に関して不足しているエビデンスはないと判断した。
(2)上記(1)で臨床使用実態が不足している場合は、必要とされる使用実態調査等の内
容について
なし。
(3)その他、製造販売後における留意点について
なし。
10.備考
なし
19
190 / 359