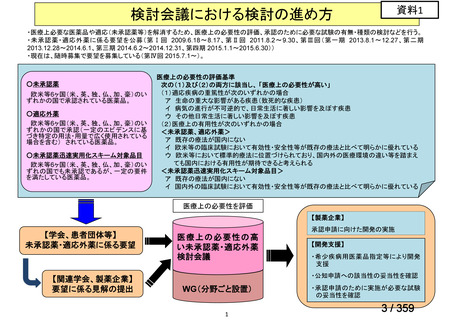
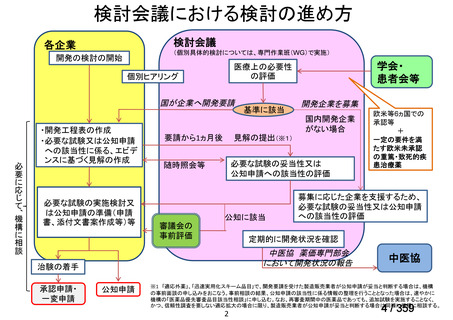
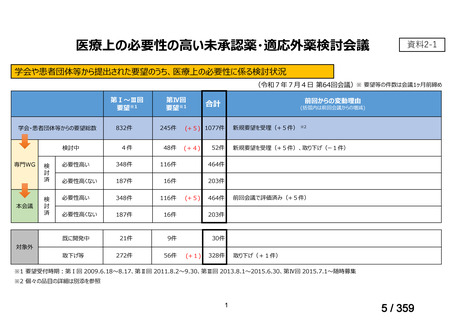
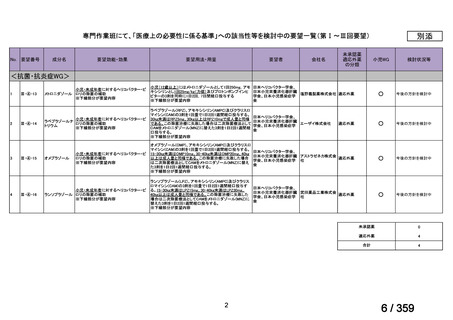
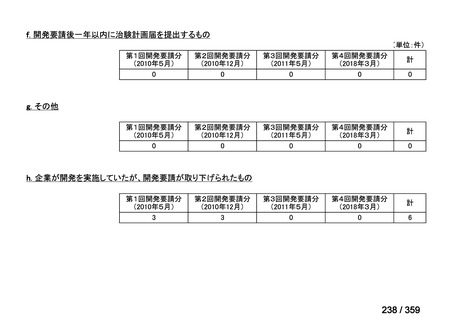
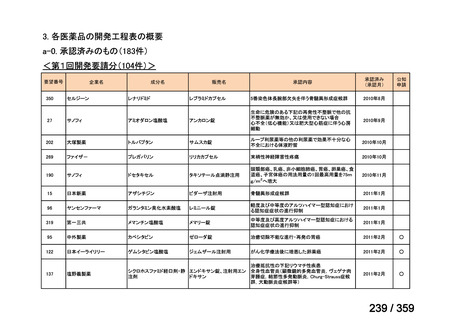
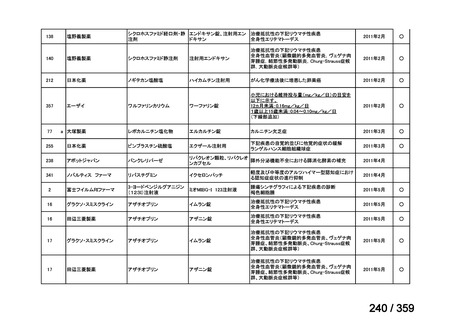
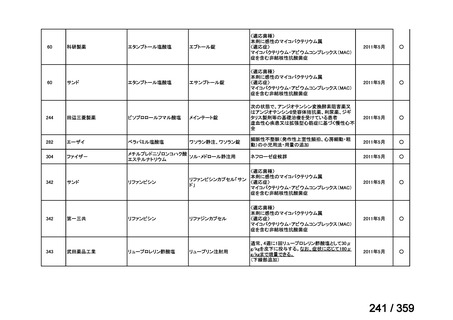
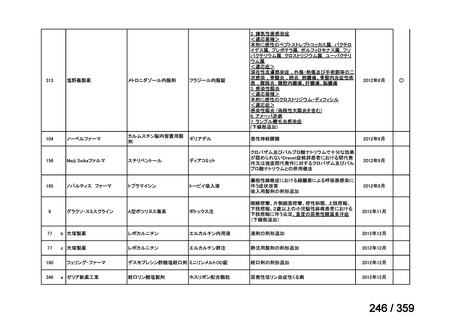
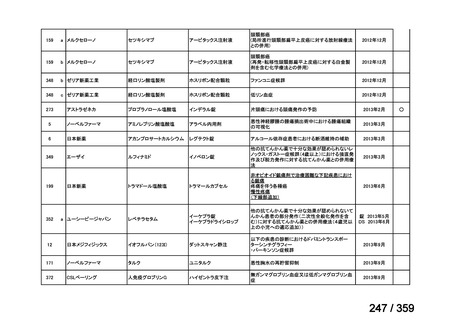
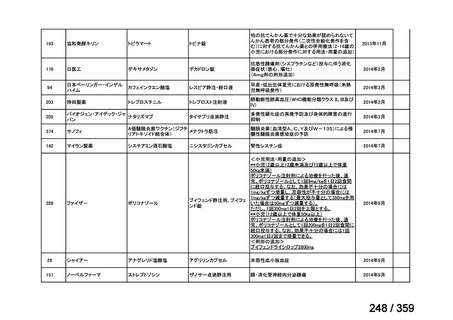
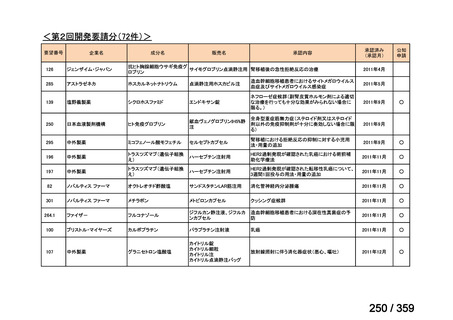
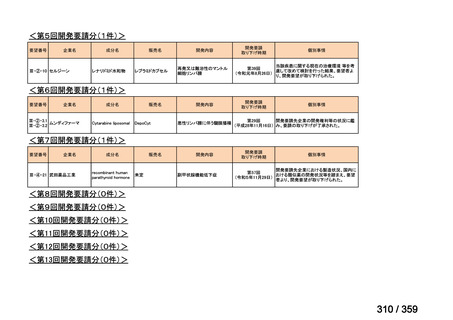
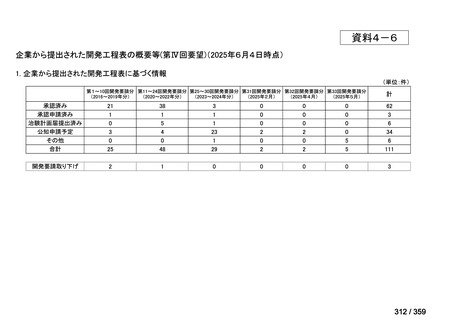
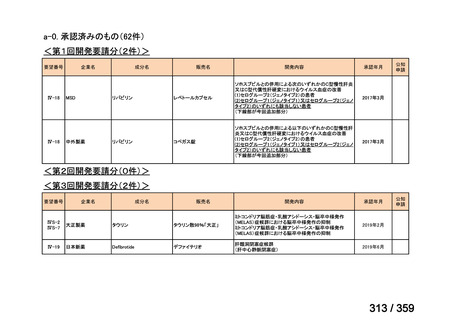
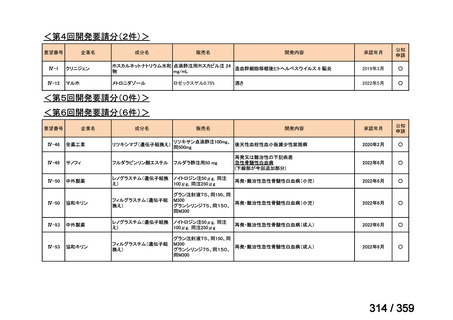
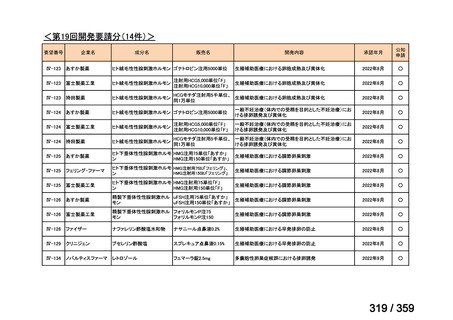
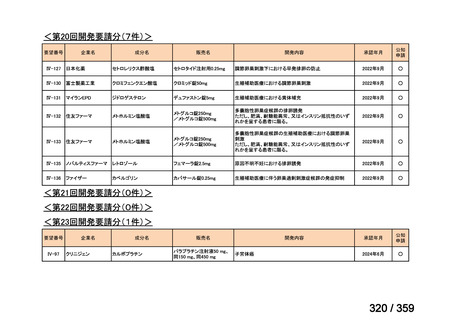
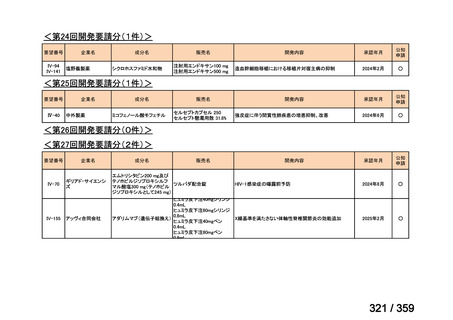
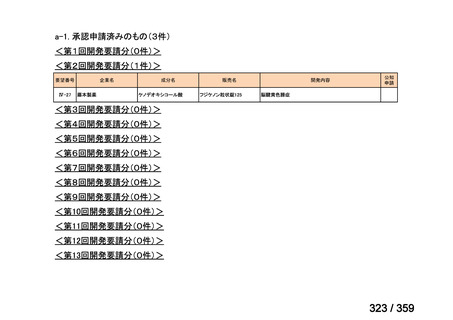
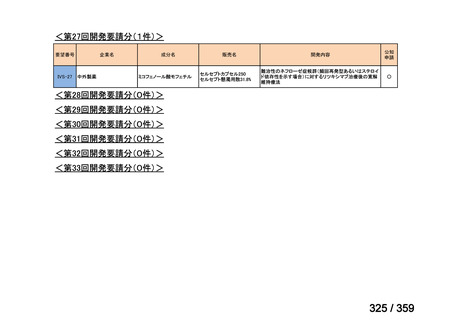
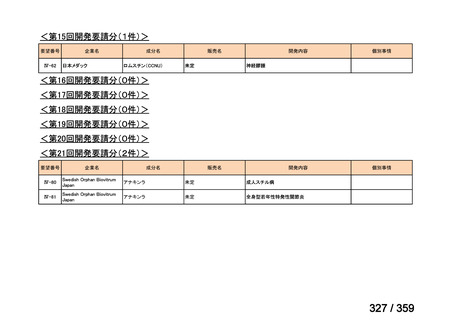
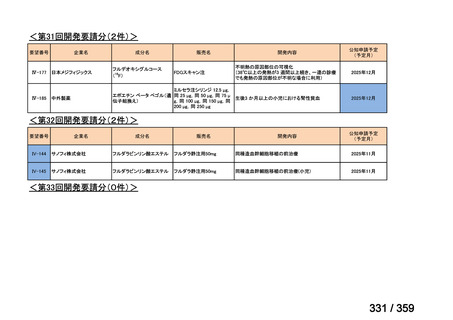
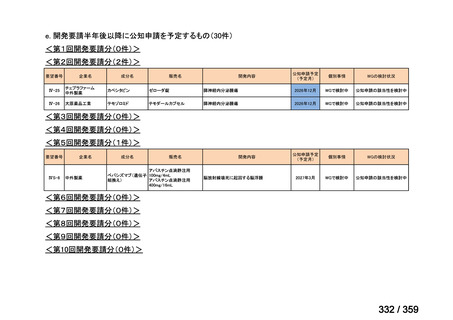
会議資料 (129 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
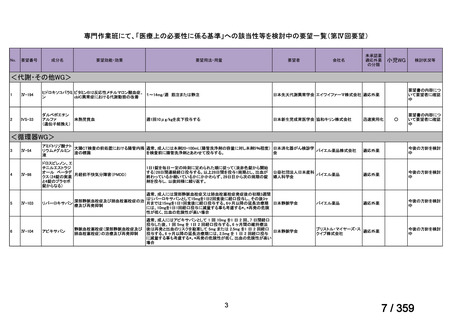
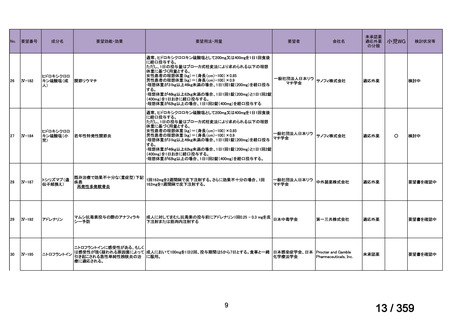
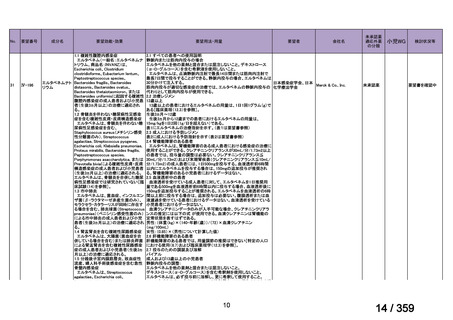
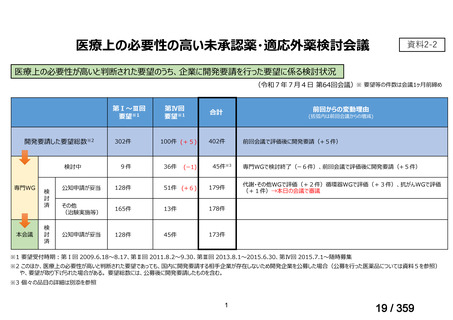
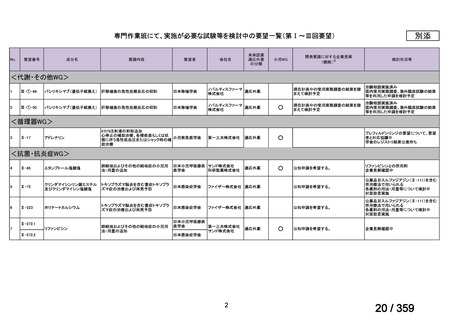
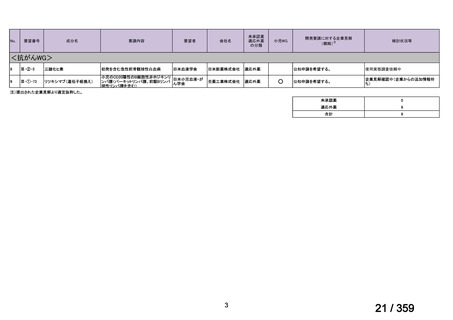
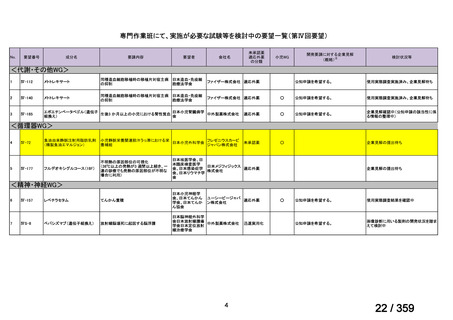
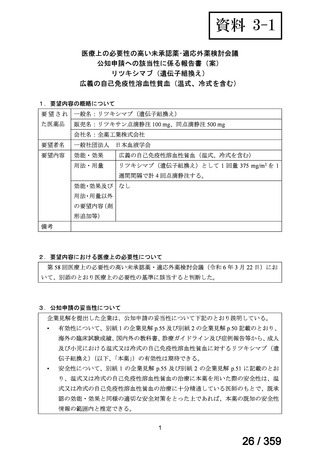
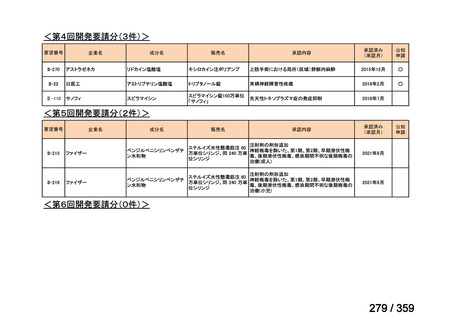
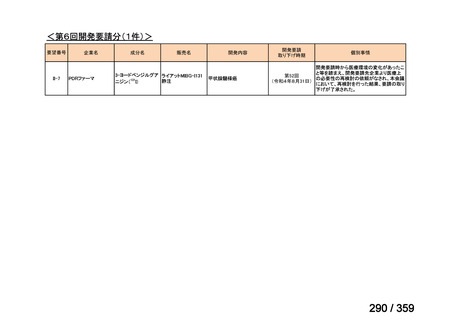
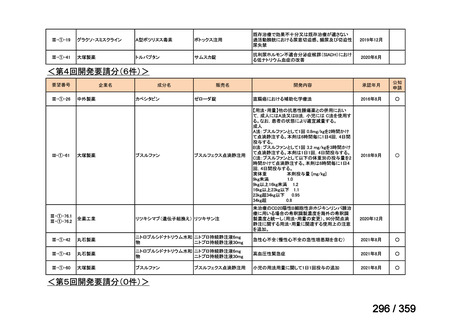
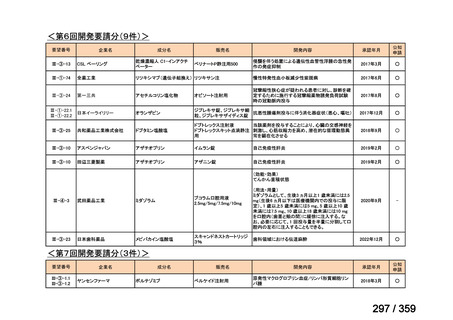
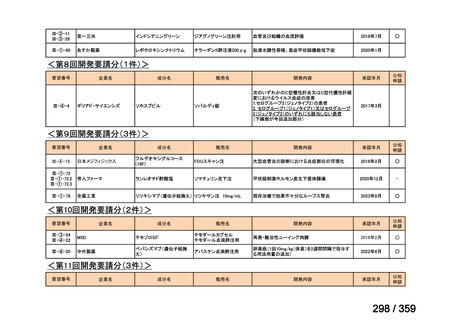
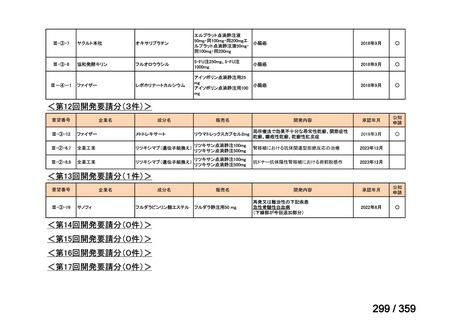
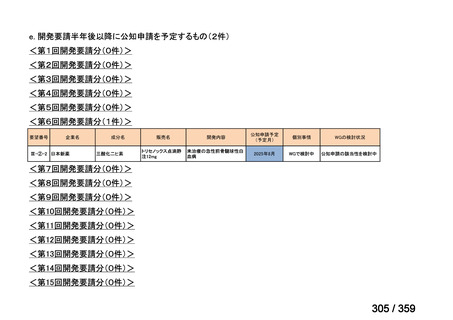
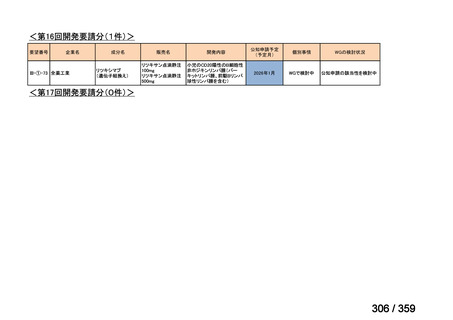
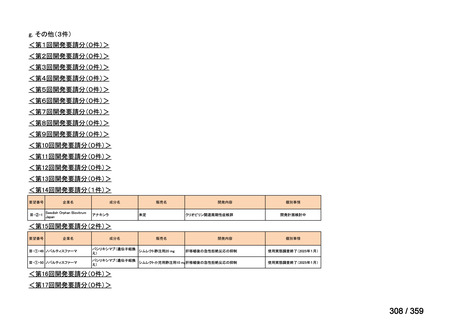
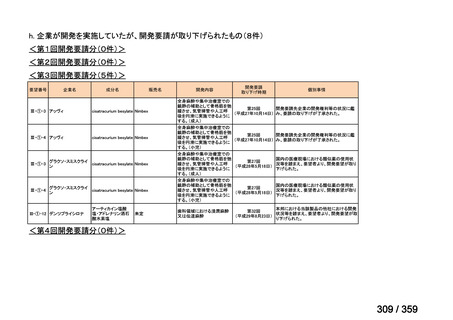
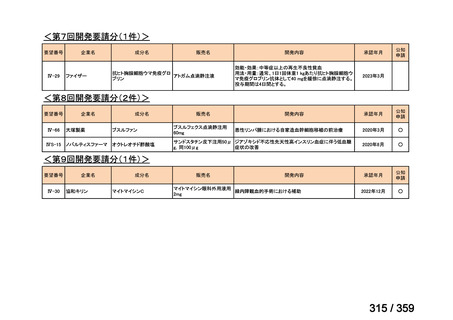
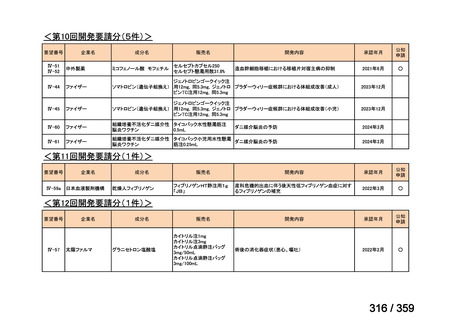
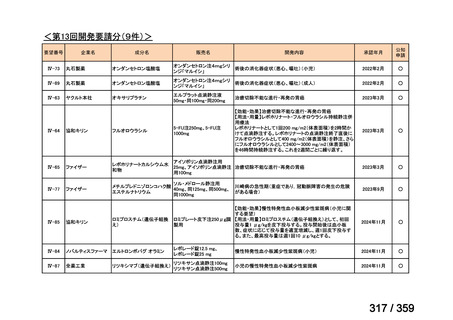
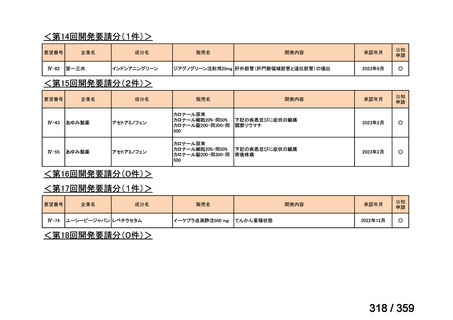
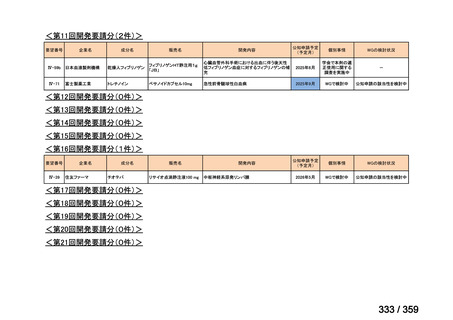
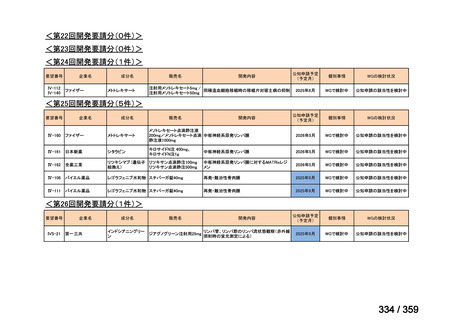
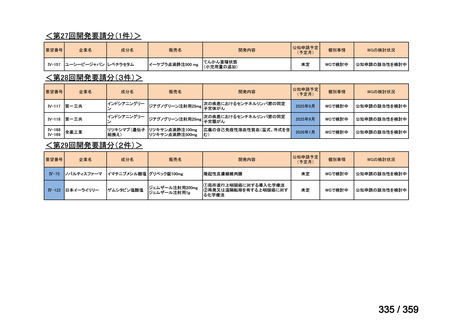
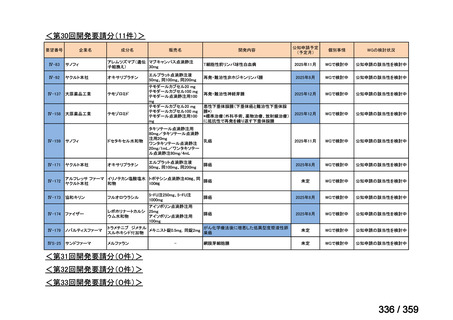
要望番号;IV-169
5.要望内容に係る国内外の公表文献・成書等について
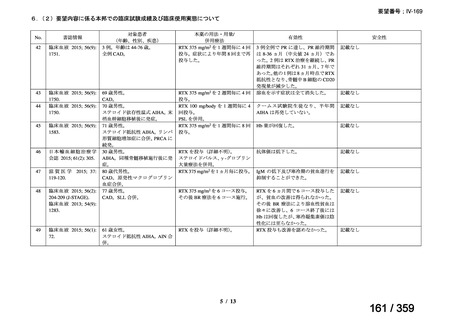
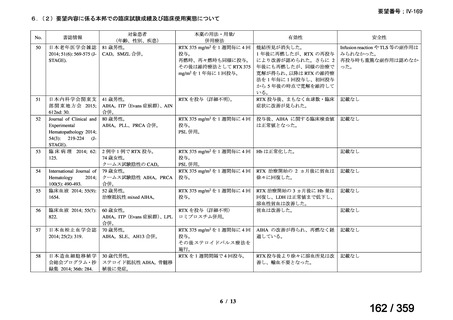
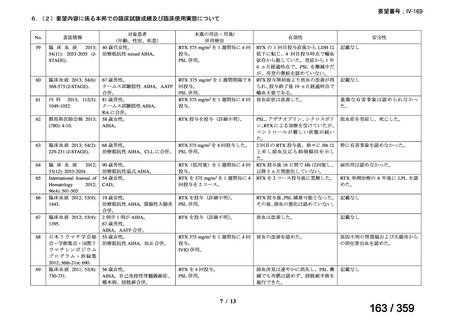
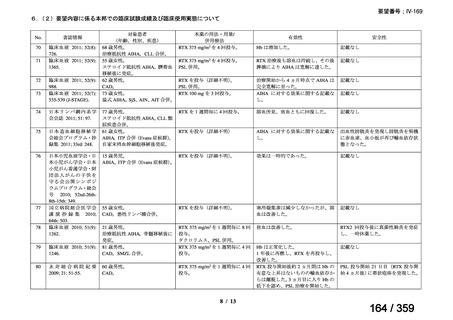
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
<文献の検索方法(検索式や検索時期等)
、検索結果、文献等の選定理由の概略等>
2024 年 3 月 26 日に PubMed.gov
(http://www.ncbi.nlm.nih.gov/pubmed)
において“rituximab and
(autoimmune hemolytic anemia)”で検索し、日本語又は英語で記載された文献 634 報を得た。
そのうち、要望効能・効果並びに用法・用量に係る臨床試験報告及び診療ガイドラインで
引用されている報告計 8 報の概要を以下に示した。
<海外における臨床試験等>
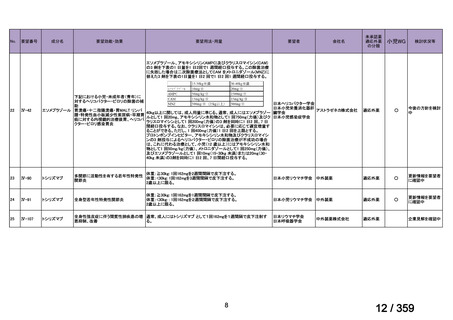
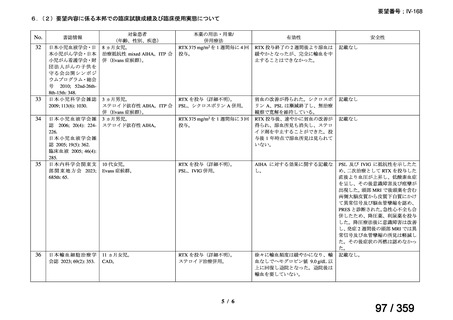
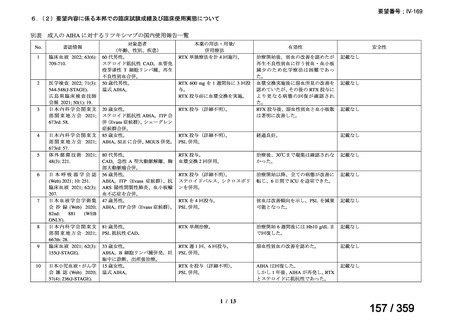
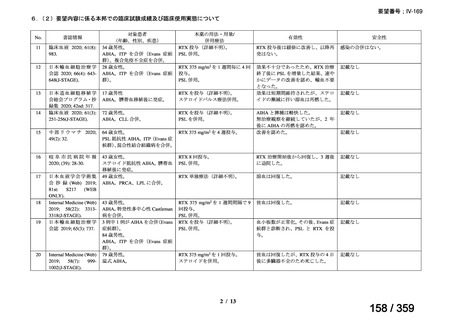
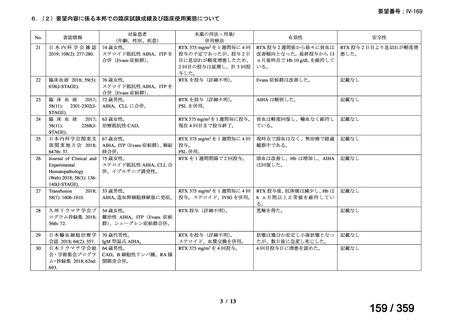
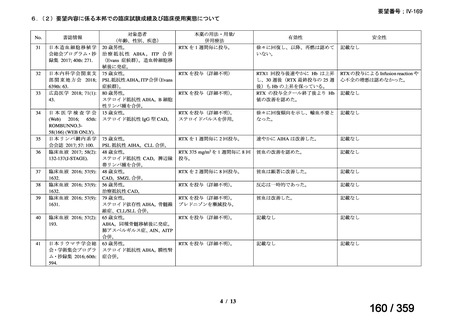
(1)温式 AIHA に関する報告
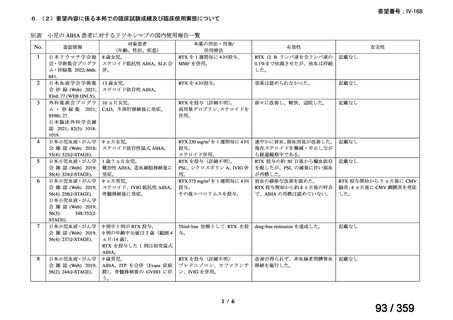
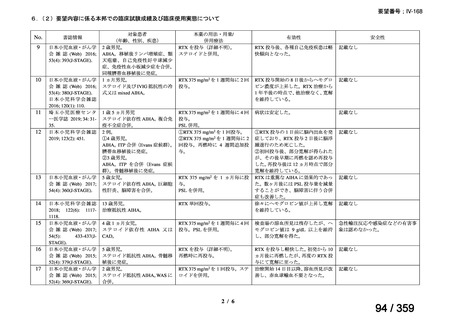
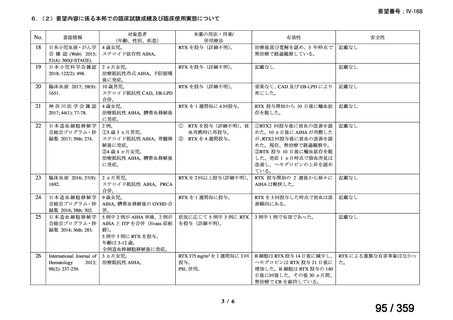
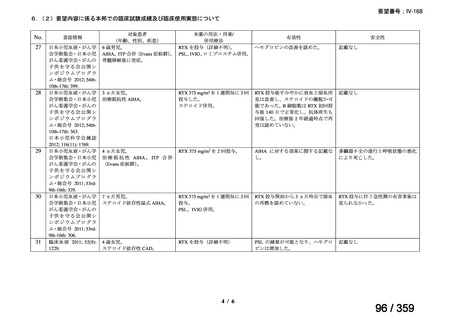
1)温式 AIHA を対象としたリツキシマブのランダム化臨床第 III 相試験(英国診療ガイド
ライン引用文献)24)
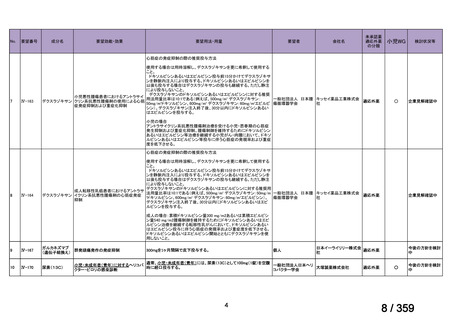
本試験は、新規に温式 AIHA と診断された未治療の 64 例を対象とした、多施設共同ラン
ダム化オープンラベル臨床第 III 相比較試験(NCT001134432)で、デンマークの 8 施設に
おいて、2005~2012 年の期間で実施された。特発性 AIHA が対象であるが、自己免疫疾患
や低悪性度 B 細胞リンパ増殖性の悪性腫瘍を併発した症例も含まれた。
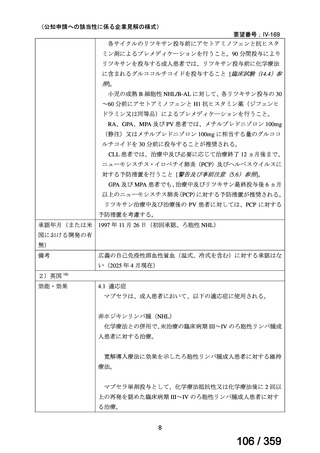
【方法】
直接クームス試験(IgG のみ、又は IgG と C3)陽性、かつ症状を認める新規に温式 AIHA
と診断された未治療の患者を、1:1 の割合で、プレドニゾロン単剤群とプレドニゾロンと
本剤併用群にランダム化割付けした。全ての患者で、プレドニゾロン 1.5 mg/kg/day を 2 週
間投与し、week 3 に 0.75 mg/kg/day、week 4 に 0.5 mg/kg/day を投与し、正常なヘモグロビ
ン値を維持している場合には 4~8 週かけて徐々に漸減した。プレドニゾロンと本剤併用群
においては、本剤 375 mg/m2 を週 1 回 4 週間投与した。
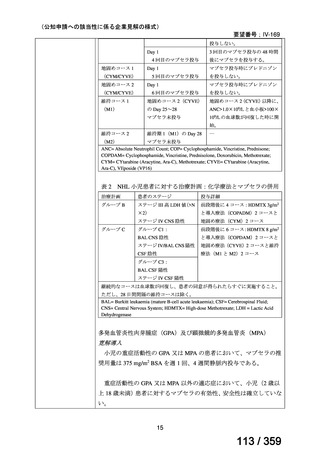
本試験の主目的は、両群間の治療反応の相違を検証することとし、治療開始から 3 ヵ月、
6 ヵ月及び 12 ヵ月時点で評価した。完全奏効(CR)は、溶血の検査所見を認めず、免疫抑
制療法が実施されていない状態でのヘモグロビン値の正常化とし、部分奏効(PR)は、低
用量のプレドニゾロン治療(10 mg/day 未満)を実施しているがその他の CR の要件を満た
す場合、又はプレドニゾロン治療(10 mg/day 未満)を除く他治療の必要が無く、ヘモグロ
ビン値が安定し許容可能な代償性溶血性貧血の場合とし、CR 及び PR 以外は非奏効例とし
た。
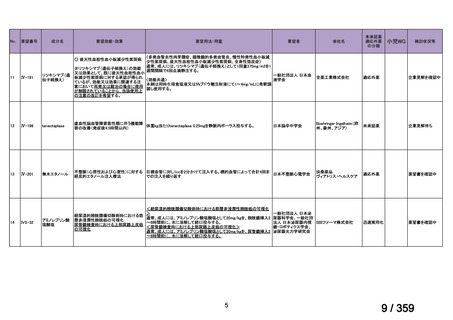
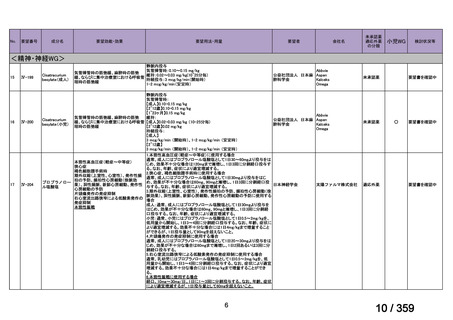
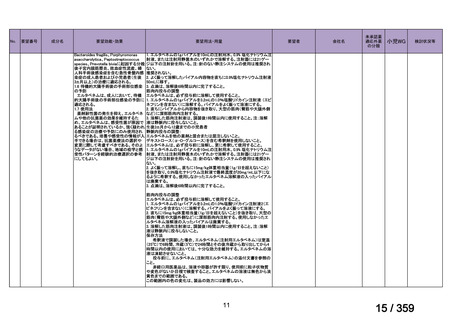
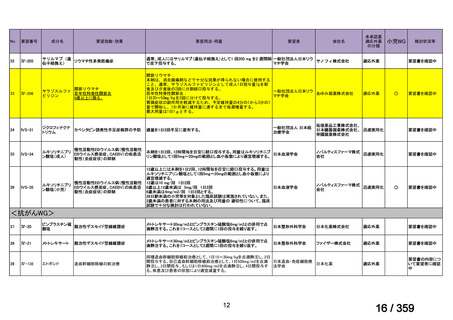
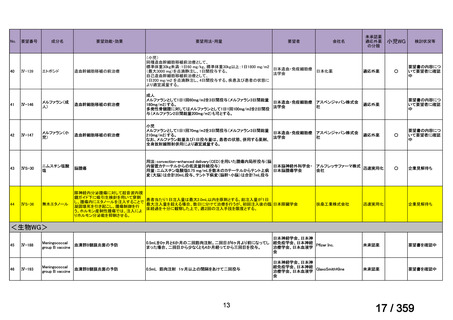
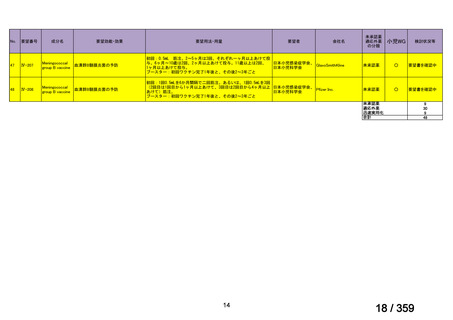
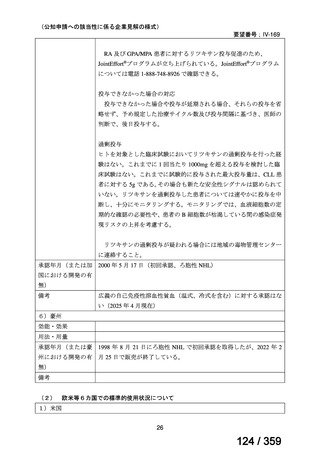
【結果】
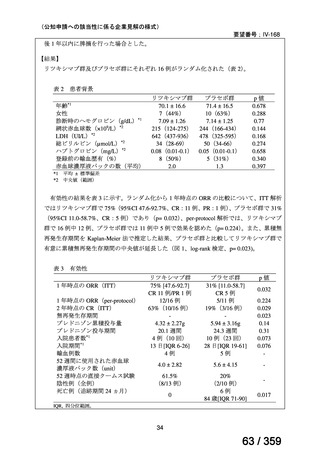
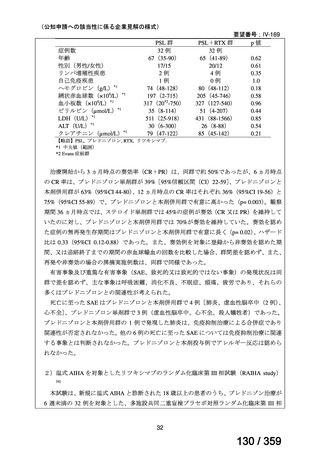
プレドニゾロン単剤群(PSL 群)及びプレドニゾロンと本剤併用群(PSL+RTX 群)に
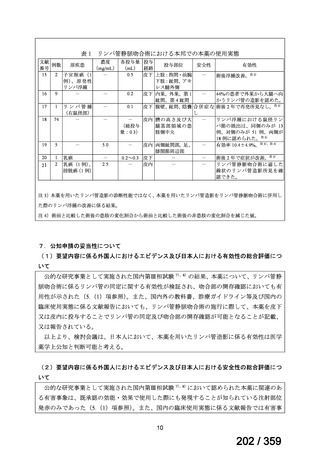
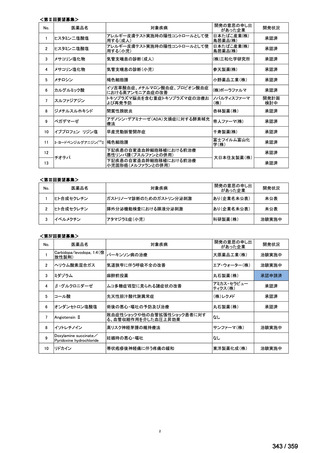
それぞれ 32 例がランダム化された(表 1)
。
表1
患者背景
31
129 / 359