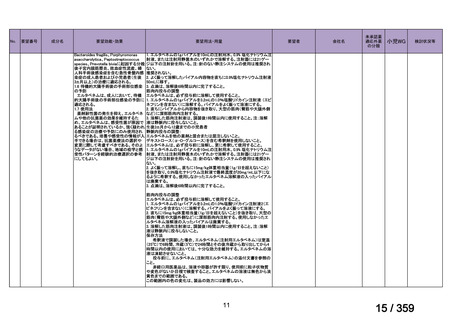
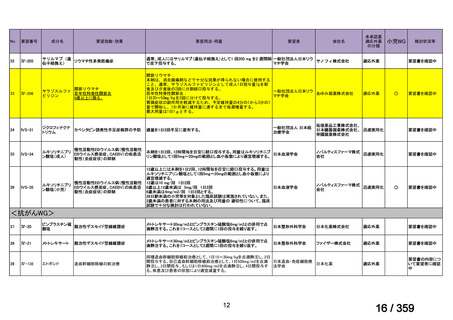
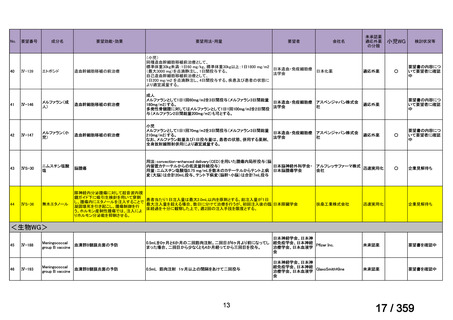
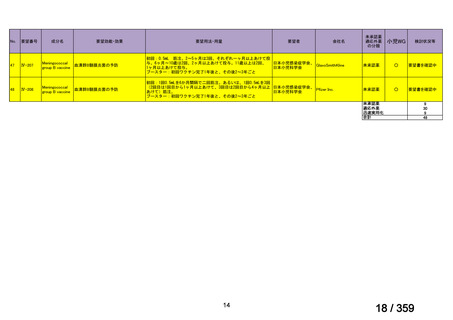
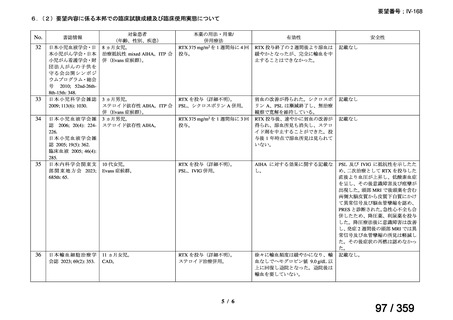
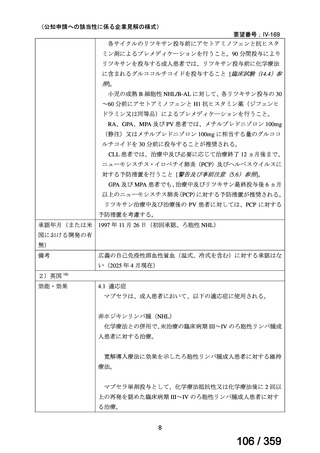
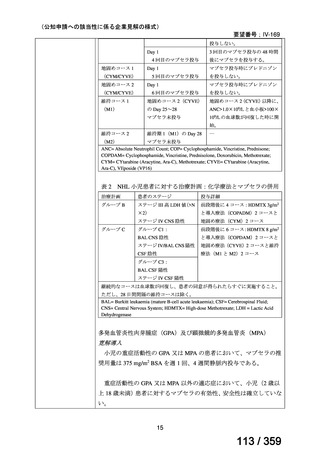
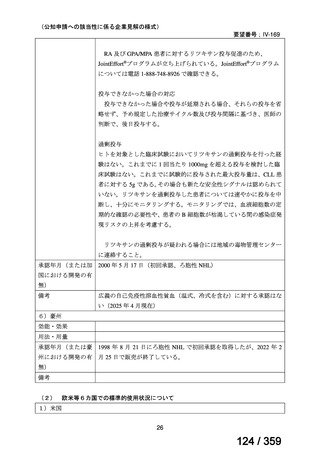
会議資料 (208 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
用法・用量については、以下のように設定することが適当と検討会議は考える。
【用法・用量】(要望内容に関連する部分のみ抜粋)
通常、成人にはトラメチニブとして 2 mg を 1 日 1 回、空腹時に経口投与する。なお、患
者の状態により適宜減量する。
【用法・用量に関連する注意】(要望内容に対して追加する部分のみ抜粋)
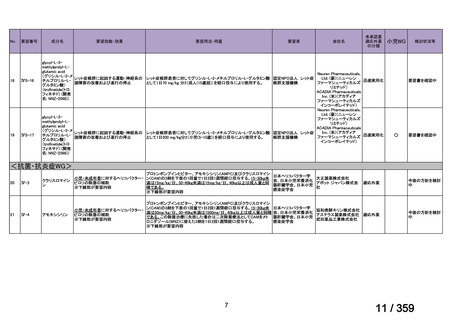
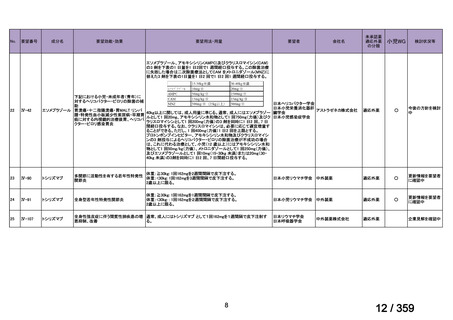
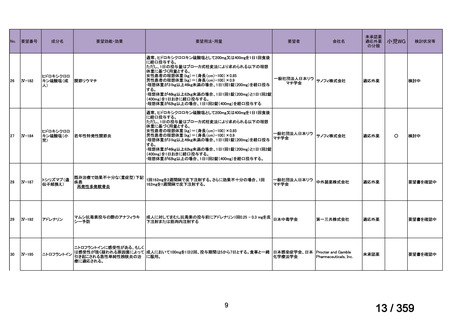
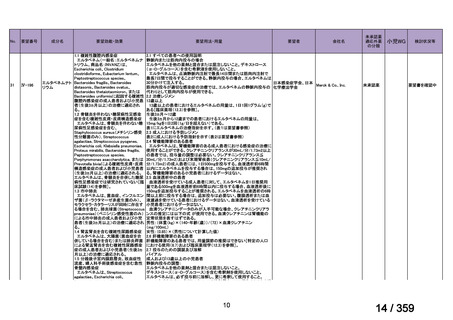
〈低異型度漿液性卵巣癌〉
他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
【設定の妥当性について】
本報告書に記載した情報に基づき、がん化学療法後に増悪した低異型度漿液性卵巣癌に
対する本薬の臨床的有用性は、説明可能と考える(3.
「公知申請の妥当性について」の項
参照)ことから、上記のとおり設定することが適切と判断した。
5.要望内容に係る更なる使用実態調査等の必要性について
(1)要望内容について現時点で国内外のエビデンスまたは臨床使用実態が不足している点
の有無について
検討会議は、要望内容に関して不足しているエビデンスはないと判断した。
(2)上記(1)で臨床使用実態が不足している場合は、必要とされる使用実態調査等の内
容について
なし
(3)その他、製造販売後における留意点について
本薬に対しては、既承認の効能・効果に係る審査を踏まえ、医薬品リスク管理計画(以
下、「RMP」
)2が策定されている。
「3.公知申請の妥当性について」及び上記(1)における検討等を踏まえ、本要望に係
る効能・効果の追加に際し、現在公表されている RMP における安全性検討事項及び有効性
に関する検討事項を変更する必要はないと考える。また、がん化学療法後に増悪した低異
型度漿液性卵巣癌に対して既承認の効能・効果と同様の追加のリスク最小化活動(下表参
照)を実施することが適切と考える。
追加の医薬品安全性監視活動
2
有効性に関する調査・試験
追加のリスク最小化活動
「メキニスト錠 0.5 mg、メキニスト錠 2 mg、メキニスト小児用ドライシロップ 4.7 mg に係る RMP(2024 年
11 月 20 日提出)
」
3
208 / 359