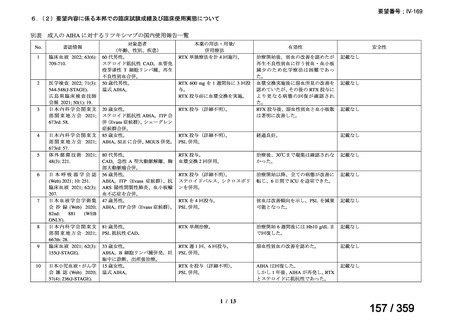
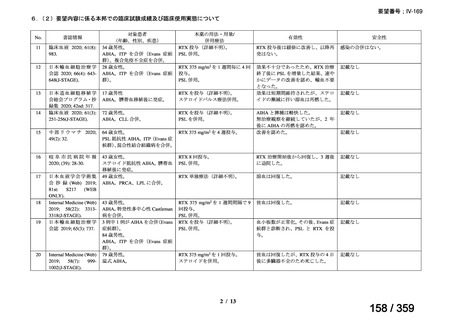
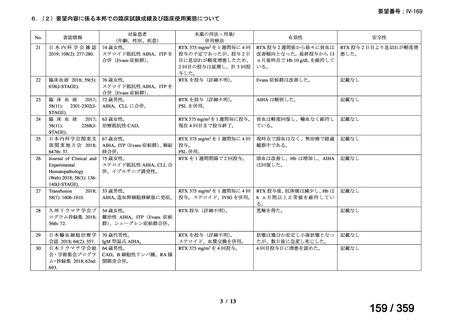
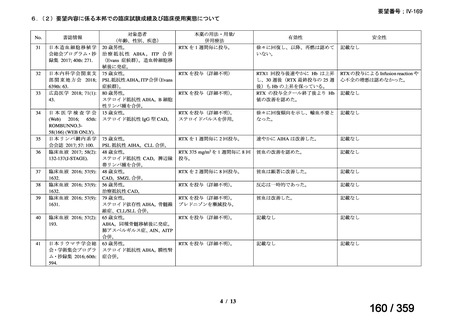
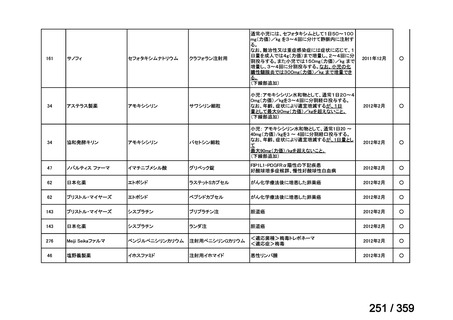
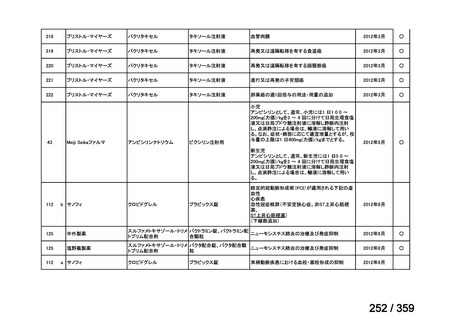
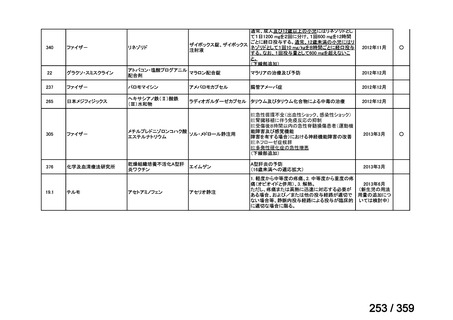
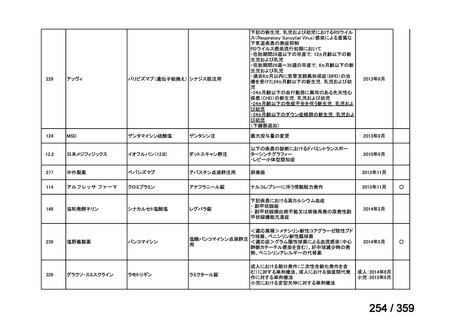
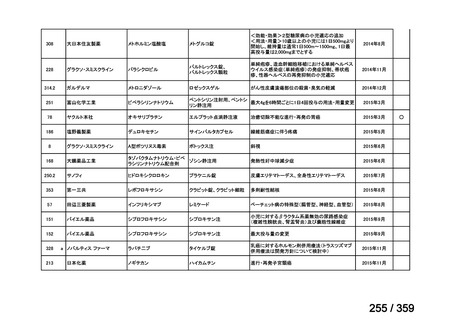
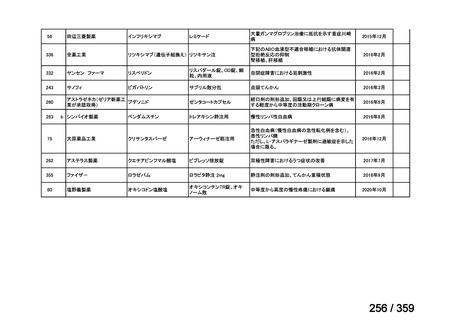
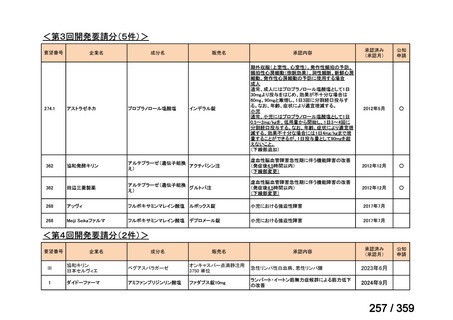
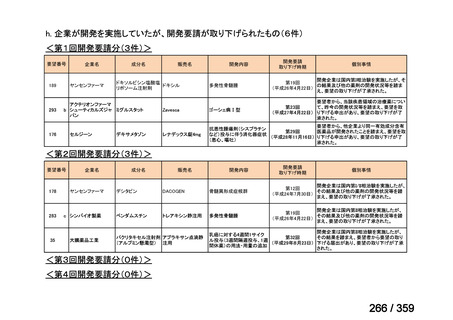
会議資料 (212 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
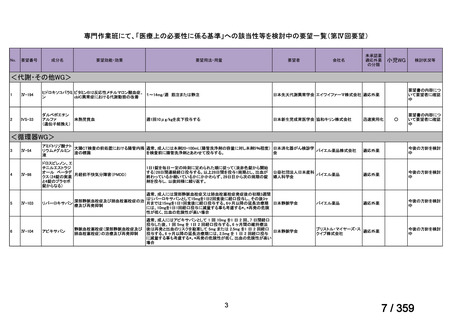
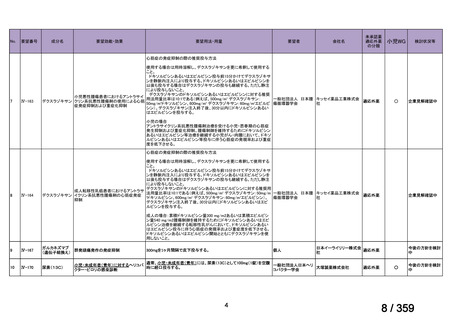
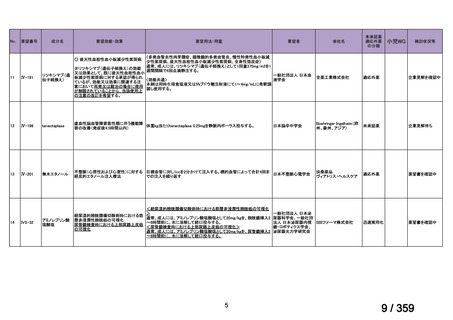
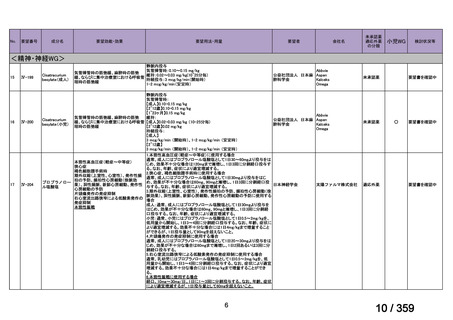
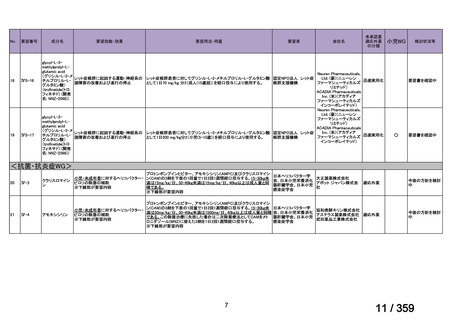
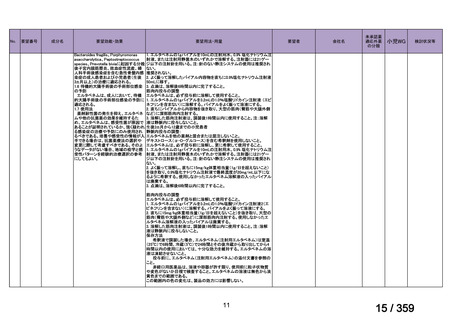
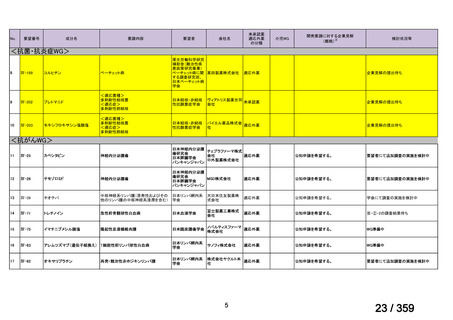
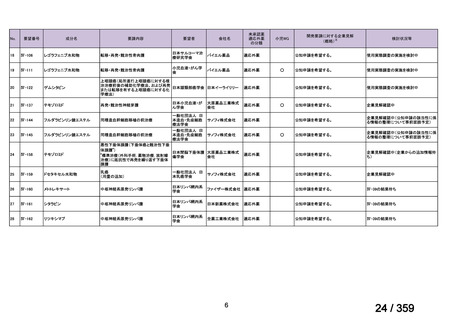
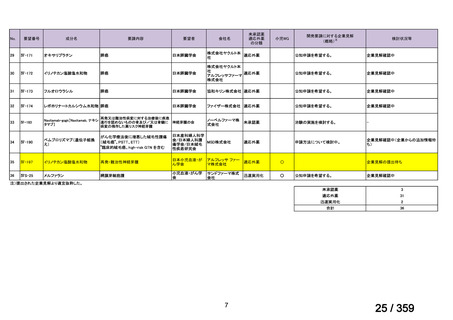
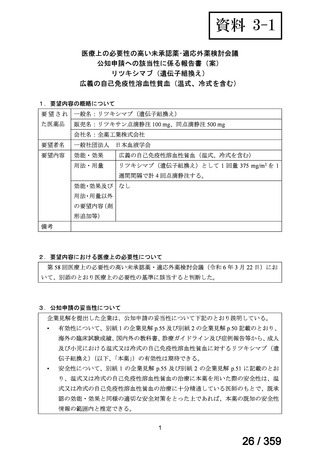
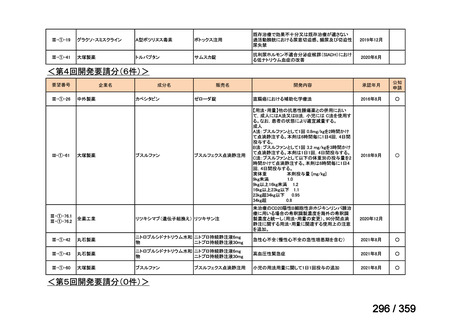
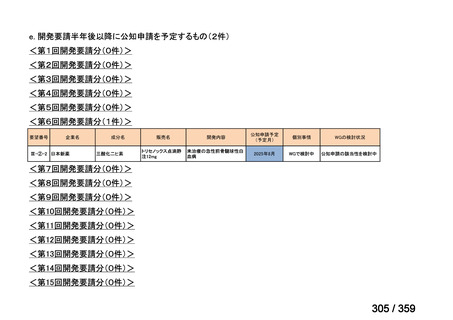
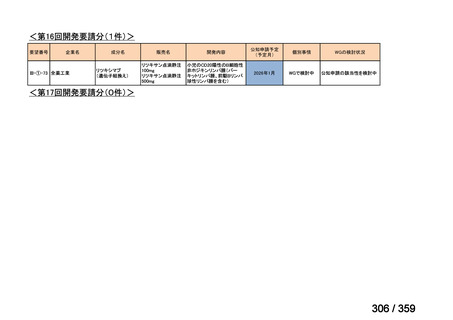
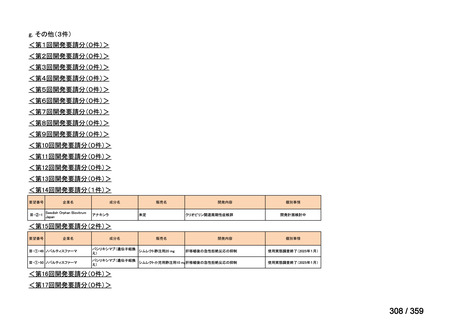
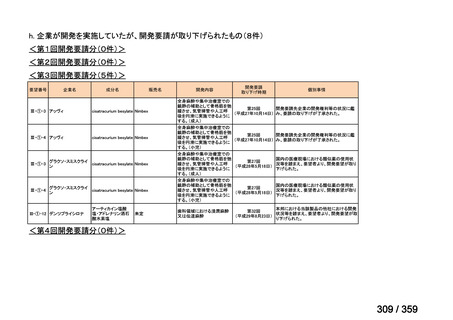
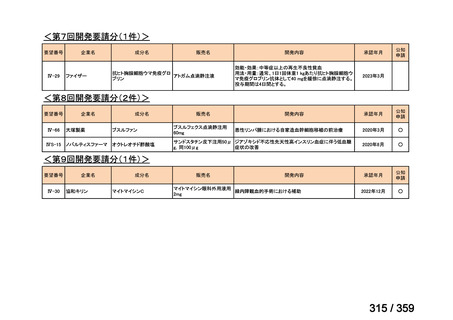
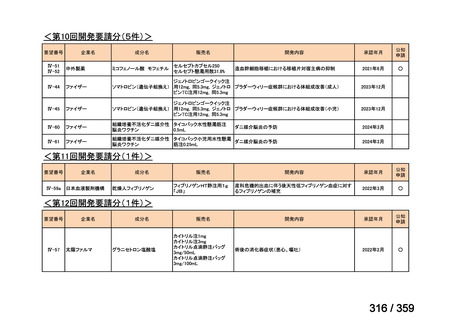
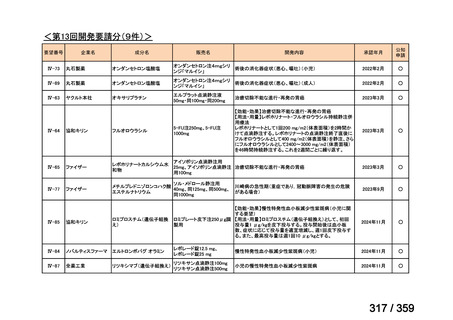
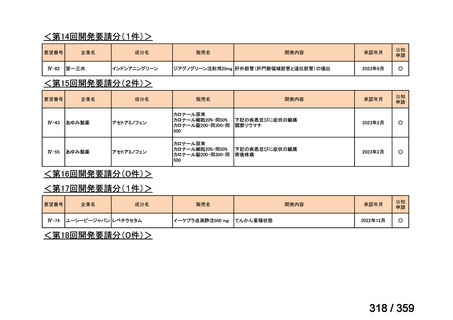
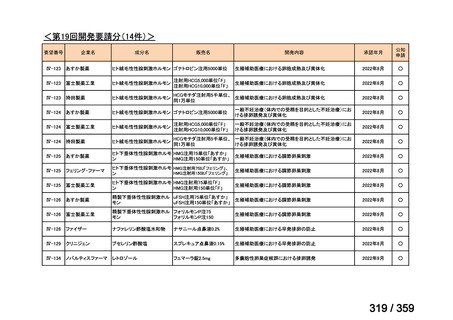
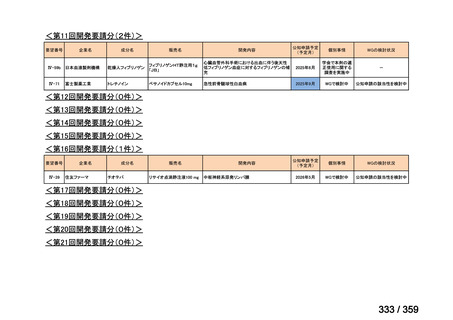
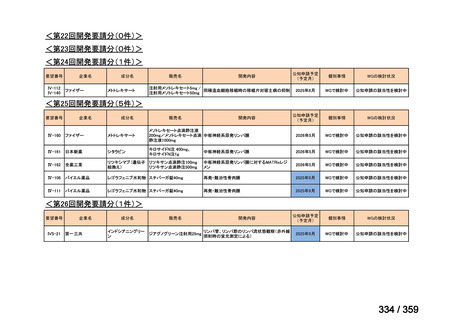
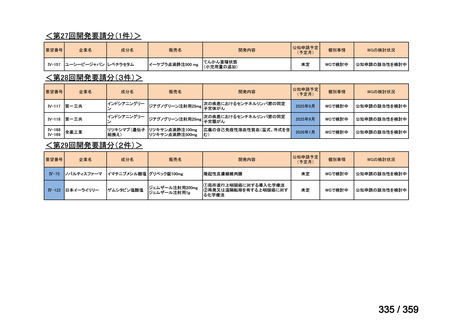
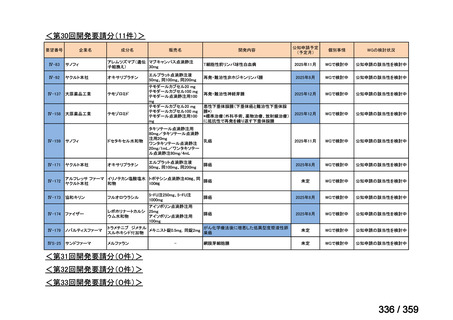
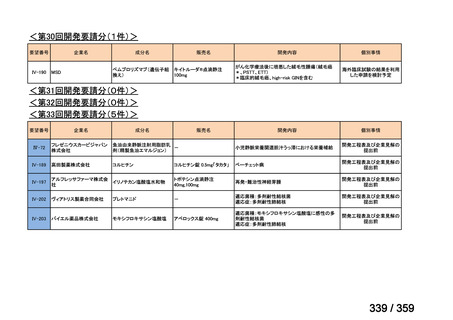
要望番号;IV-179
備考
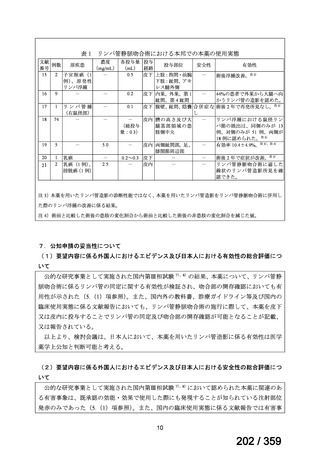
6)豪州
効能・効果
用法・用量
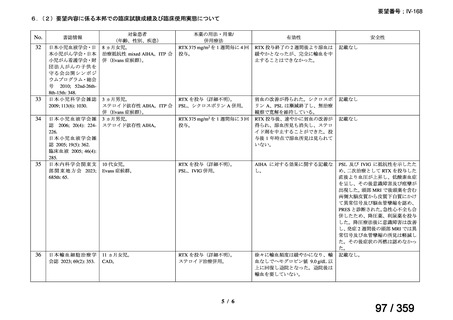
承認年月(または豪 開発しておらず,承認されていない。
州における開発の有
無)
備考
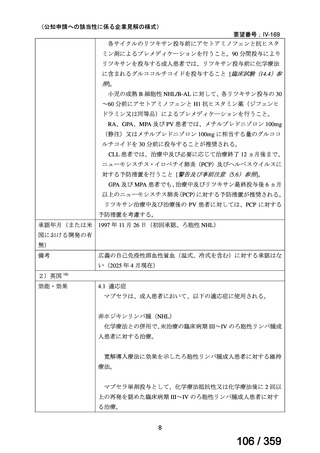
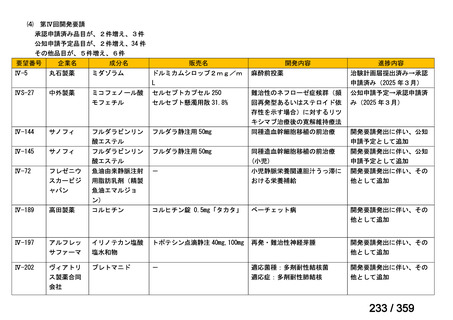
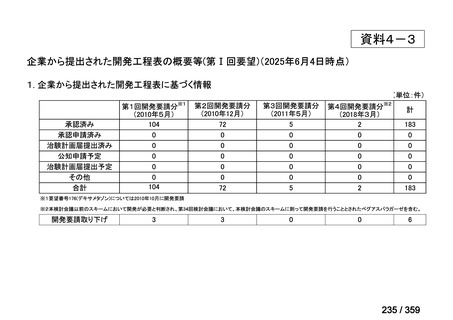
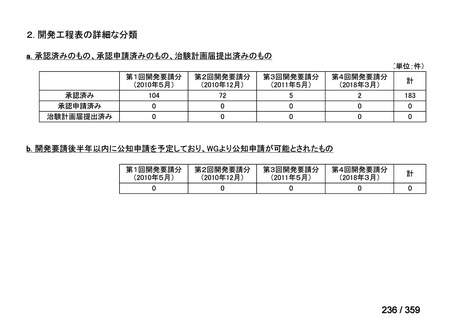
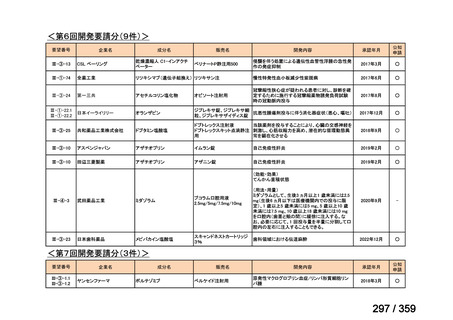
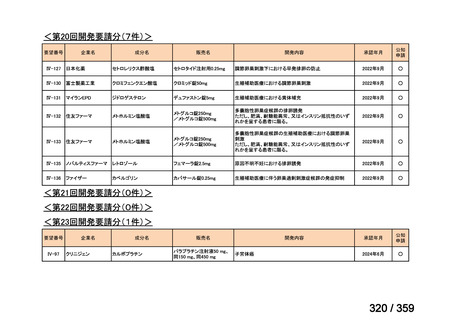
(2)
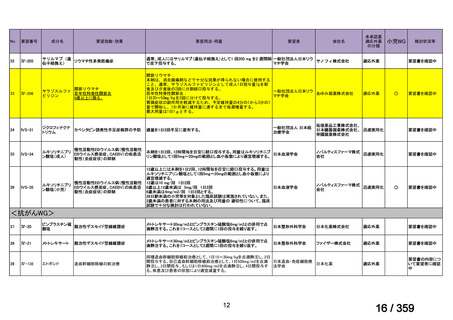
欧米等6カ国での標準的使用状況について
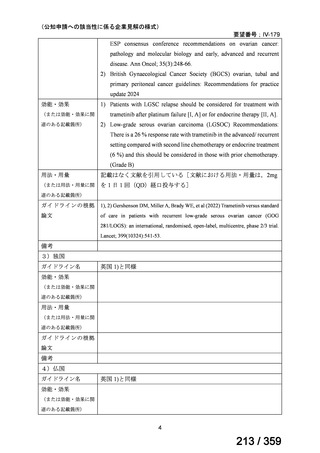
1)米国
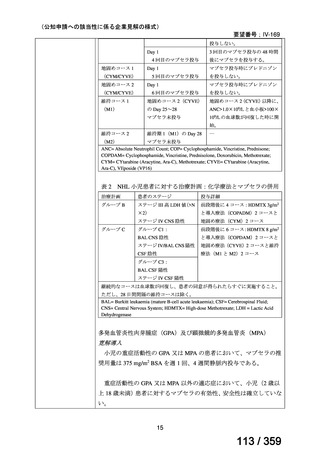
ガイドライン名
1) NCCN (National Comprehensive Cancer Network) Clinical Practice
Guidelines in Oncology for Ovarian Cancer Including Fallopian Tube
Cancer and Primary Peritoneal Cancer_Vesion 3.2024
2) Ovarian Epithelial, Fallopian Tube, and Primary Peritoneal Cancer
Treatment (PDQ®)–Health Professional Version [NCI]
効能・効果
再発低異型度漿液性癌(再発 LGSC)
(または効能・効果に関
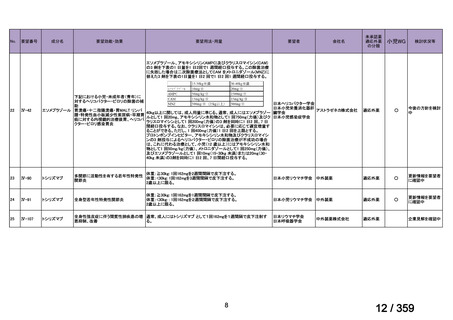
1) Due to the superior outcomes reported in this trial, the NCCN panel
連のある記載箇所)
recommends trametinib as a category 2A option for patients with
recurrent low-grade serous carcinoma.
2) As LGSC is relatively chemoresistant, attention has focused on targeted
therapies.
Evidence (targeted therapies):
Trametinib: Trametinib is a selective, reversible, allosteric inhibitor of
MEK1/MEK2. A recent international, randomized, multicenter, phase
II/III trial evaluated trametinib in patients with LGSC. [Level of
evidence B1]
用法・用量
1), 2) 記載はなく文献を引用している[文献における用法・用量は,
(または用法・用量に関
2mg を 1 日 1 回(QD)経口投与する]
連のある記載箇所)
ガイドラインの根拠
1), 2) Gershenson DM, Miller A, Brady WE, et al (2022) Trametinib versus standard
論文
of care in patients with recurrent low-grade serous ovarian cancer (GOG
281/LOGS): an international, randomised, open-label, multicentre, phase 2/3 trial.
Lancet; 399(10324):541-53.
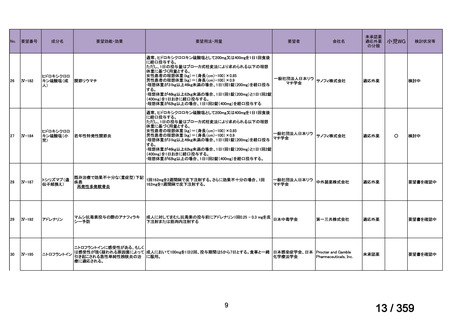
備考
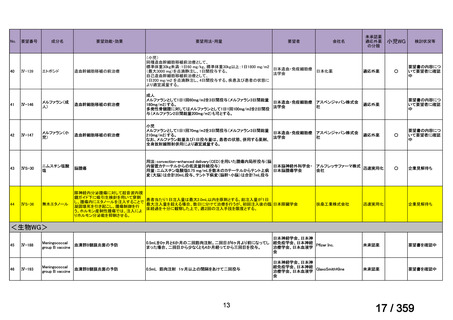
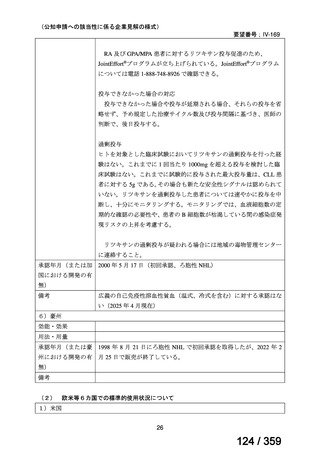
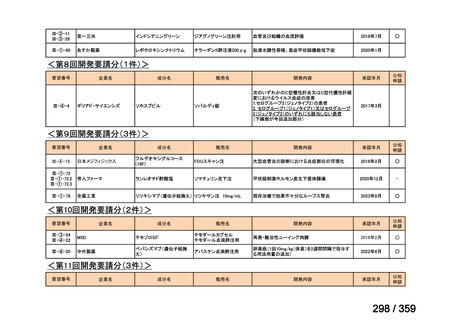
2)英国
ガイドライン名
1) Ledermann JA, Matias-Guiu X, Amant F, et al (2024) ESGO-ESMO3
212 / 359