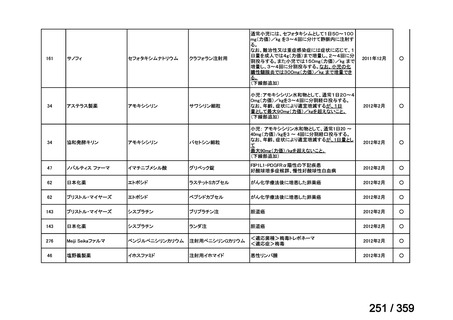
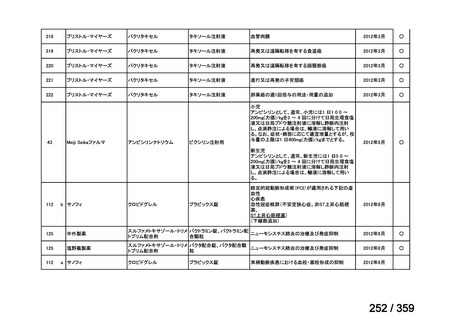
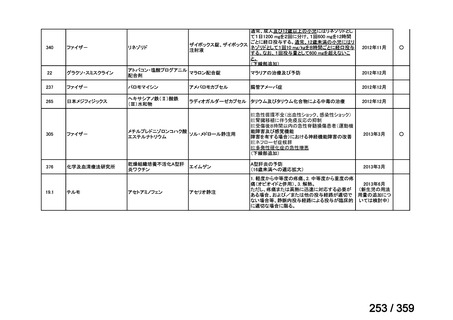
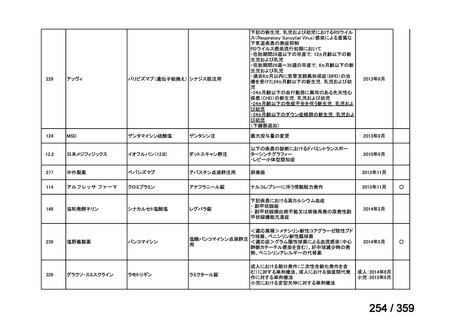
会議資料 (219 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
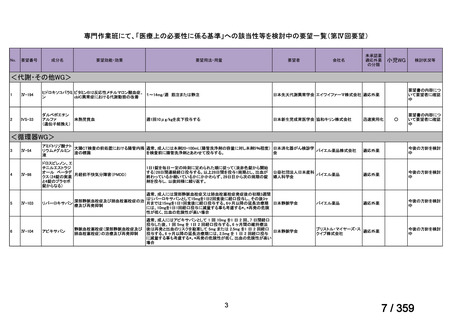
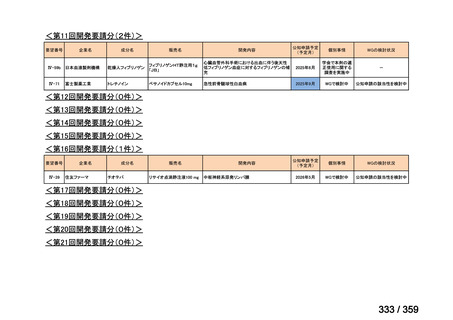
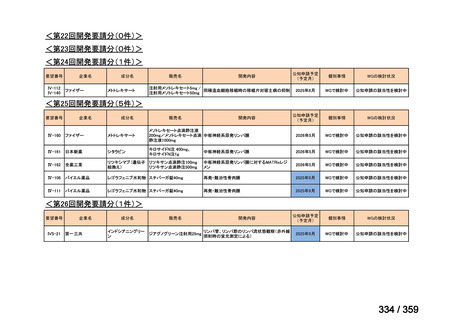
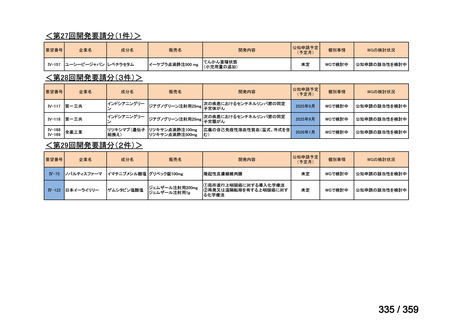
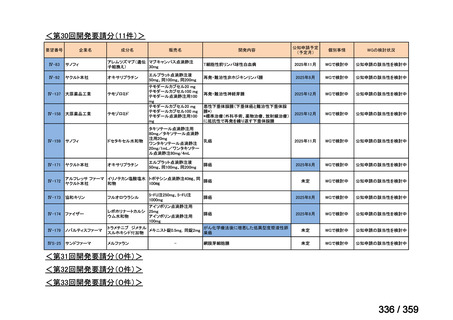
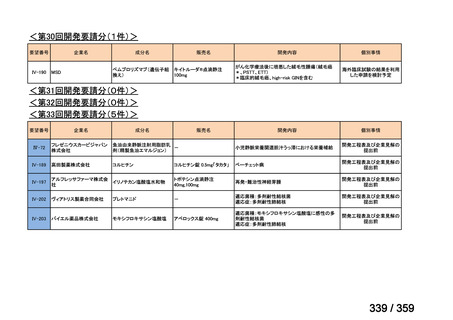
要望番号;IV-179
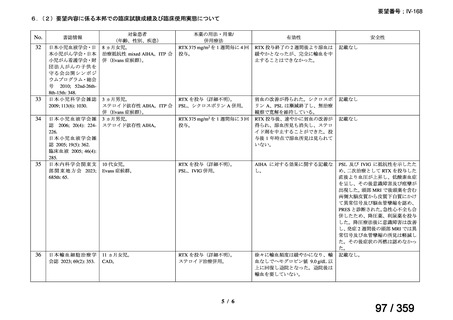
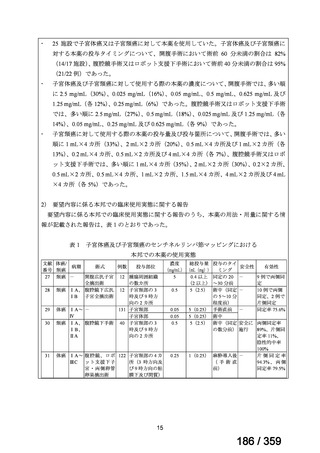
の要望書が提出された。しかしながら,本邦における再発 LGSOC 患者の年間患者数は約 750
人と推定され*,再発低異型度漿液性卵管癌(LGSFTC)及び再発 LGSPC 患者の推定年間
患者はそれぞれ約 30 人*,90 人*と推測される。臨床試験に適格な患者はここからさらに
絞られることから,国内臨床試験の実施は現実的でないと考えられ,本邦での開発は計画
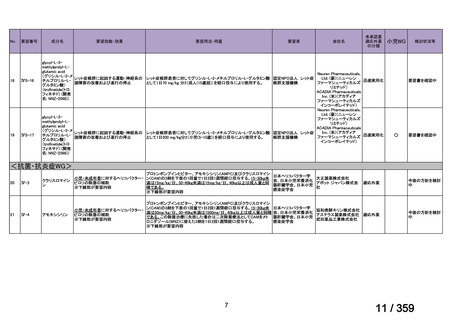
していない。
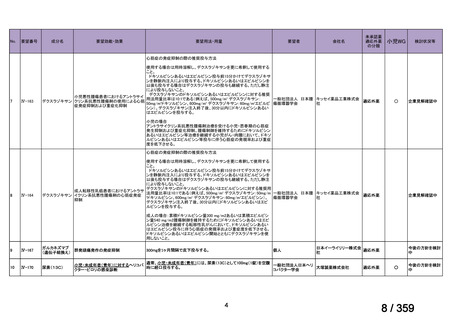
*対象患者数の算出方法は以下のとおりである:
卵巣癌,卵管癌及び腹膜癌の患者数は,厚労省患者調査 2023 から算出した。本邦におけ
る対象患者数は,卵巣の悪性新生物<腫瘍>として 48,000 人,その他及び部位不明の女性
生殖器の悪性新生物<腫瘍>卵管として 2,000 人,及び後腹膜及び腹膜の悪性新生物<腫
瘍>として 6,000 人である。卵巣癌の約 90%が上皮性卵巣癌であり,上皮性卵巣癌の約 5%
が LGSC と報告されていることを考慮すると(UpToDate 2024),LGSOC,LGSFTC,LGSPC
はそれぞれ 2,160 人,90 人,270 人と算出される。薬物療法の対象となる Stage II-IV に該
当する患者は,患者全体のうちの 49.4%であり(卵巣がん・卵管癌・腹膜癌治療ガイドラ
イン 2020 年版,がん情報サービス 2022 年集計),このうち再発患者数は,約 70%と報告さ
れていることから(Nakayama et al 2024),それぞれ 746 人,31 人,93 人と推定される。
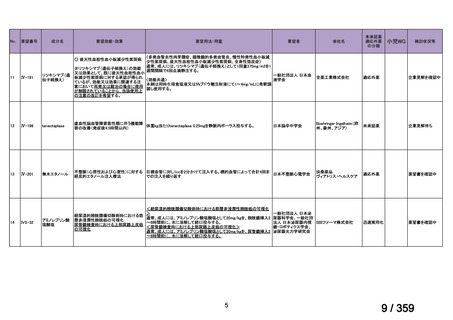
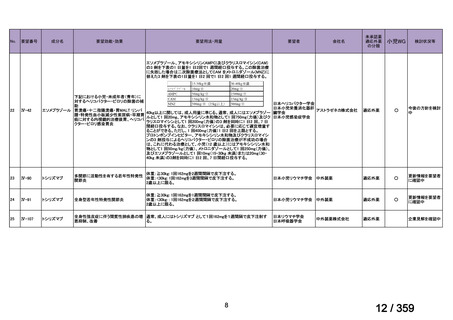
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
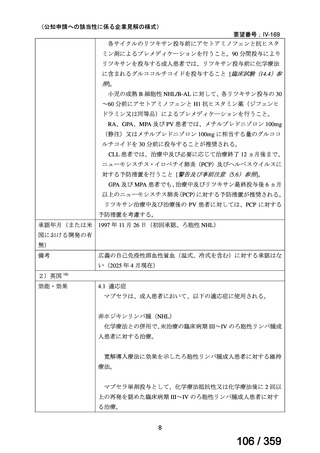
1)遺伝子パネル検査による遺伝子プロファイリングに基づく複数の分子標的治療に関す
る患者申出療養(NCCH1901)
本邦で保険適用済み,あるいは,評価療養として実施されている遺伝子パネル検査を受
け,actionable な遺伝子異常(エキスパートパネルにおいて,治療選択肢の結果返却が適当
と判断された遺伝子異常)を有することが判明した患者を対象に,それぞれの遺伝子異常
に対応する適応外薬を患者申出療養制度に基づいて投与し,治療経過についてのデータを
収集することを目的とした特定臨床研究が実施されており,トラメチニブ単剤投与群が設
定されている。当該投与群において,5 例の再発 LGSOC 患者が登録され,2 mg QD のトラ
メチニブの投与経験がある。
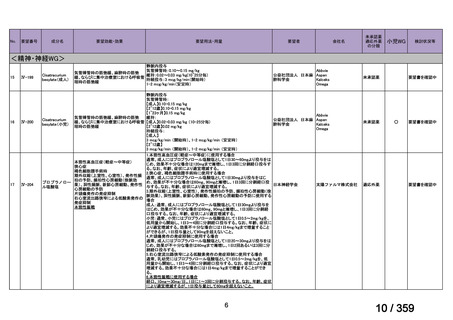
対象:治癒切除不能な進行性(転移性及び/又は局所進行)の病変を有し,有効な標準治
療が存在しない患者
主要評価項目:各医薬品コホートにおける,測定可能病変を有する患者の治療開始後 16 週
までの最良総合効果(BOR)に基づく奏効割合,主な副次的主要評価項目は,OS,PFS,
病勢制御割合(DCR),AE 発現割合とする。
方法:本邦における保険適用済み,あるいは評価療養として実施されている遺伝子パネル
検査を受け,actionable な遺伝子異常を有することが判明した場合,それぞれの遺伝子異常
に対応する適応外薬を患者申出療養制度に基づき,治療無効,毒性,又は同意撤回まで投
与を継続する。各医薬品における用法・用量は薬剤添付文書の最新版の記載に原則従う。
他の医薬品との併用が認められているものを単剤で使用する場合にも添付文書の用法・用
量で行う。
10
219 / 359