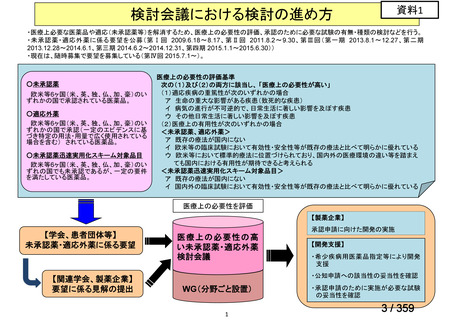
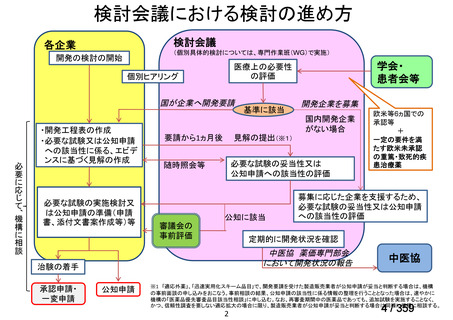
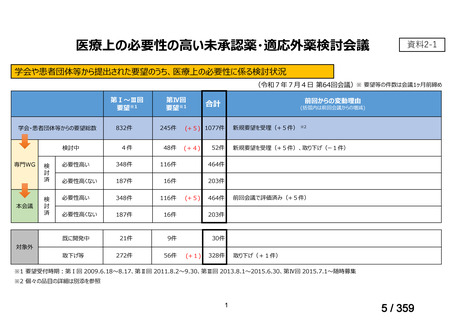
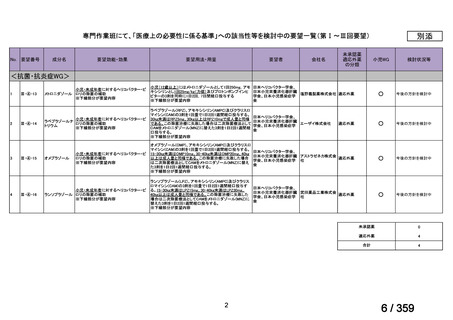
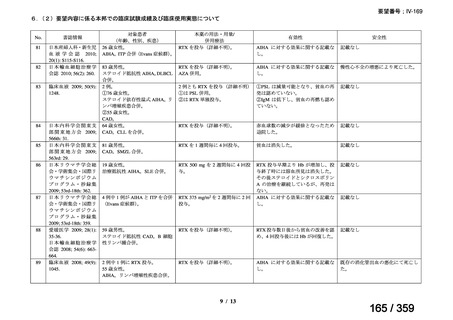
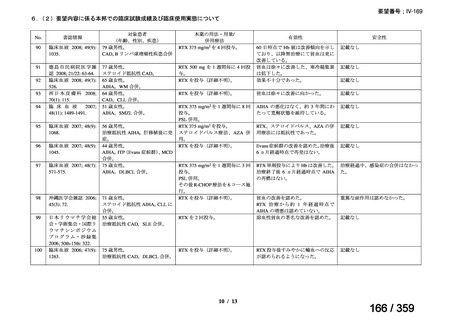
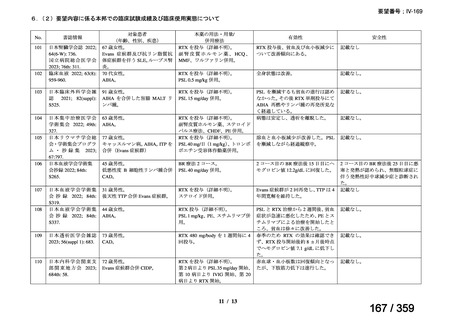
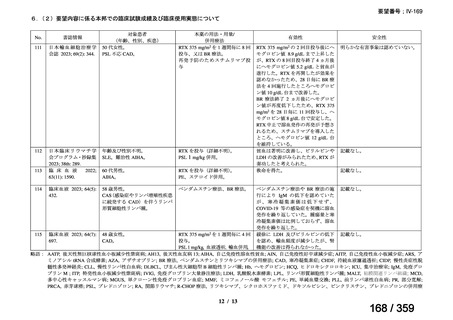
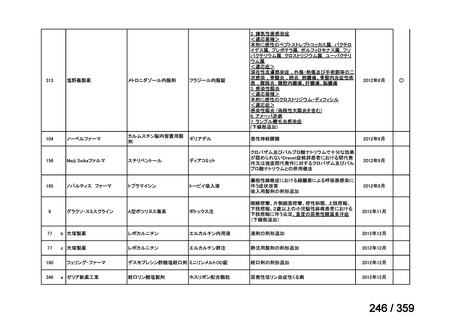
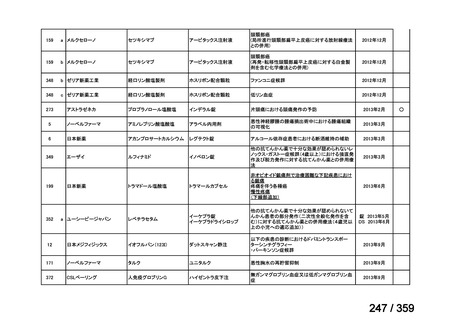
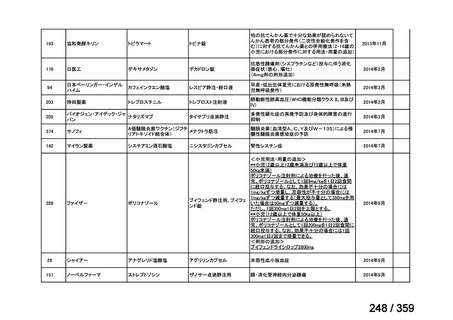
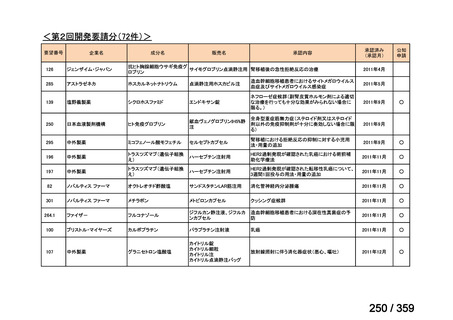
会議資料 (220 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
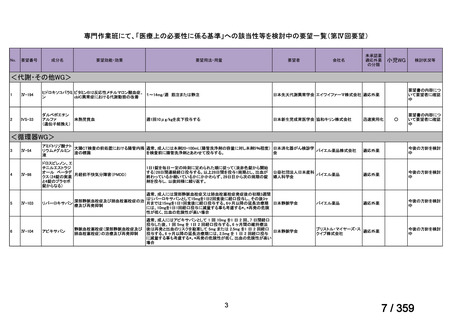
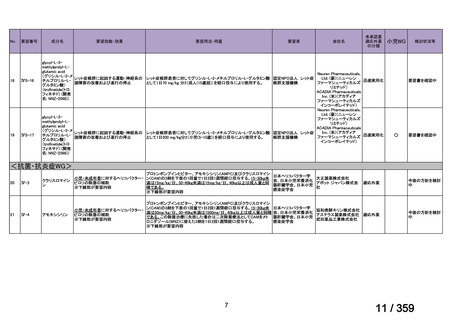
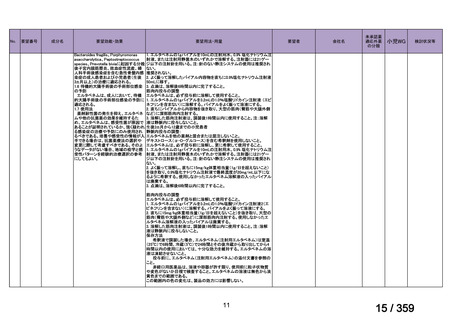
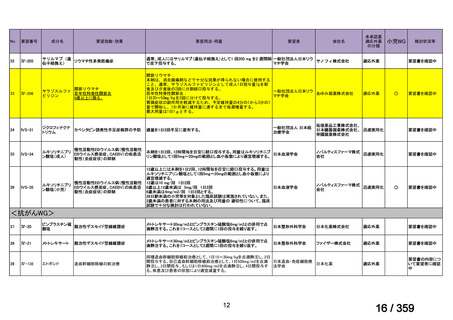
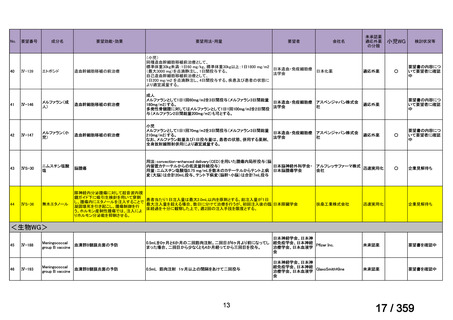
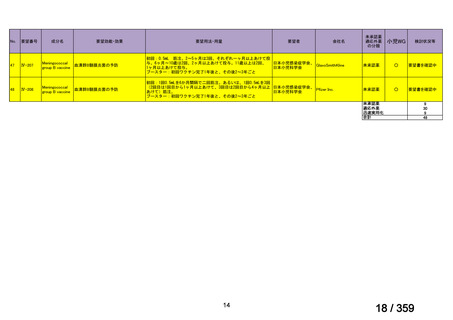
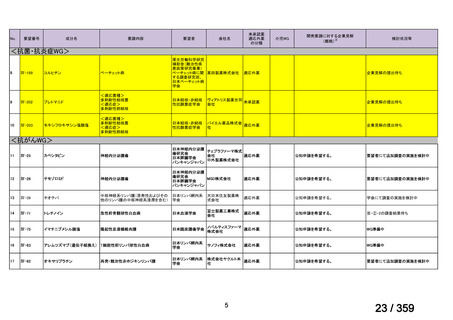
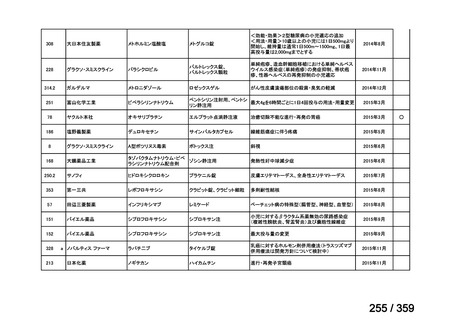
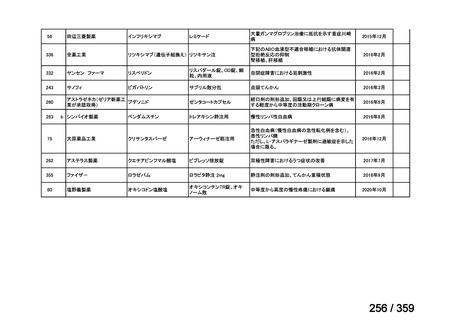
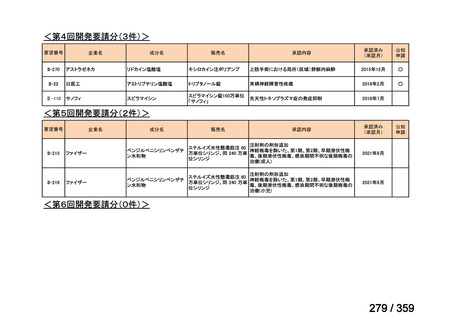
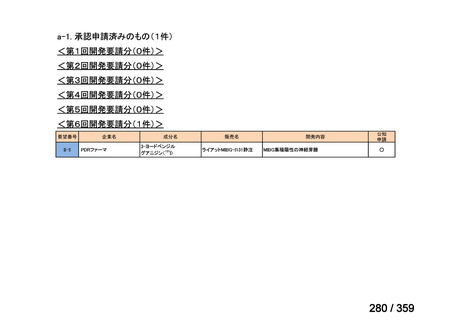
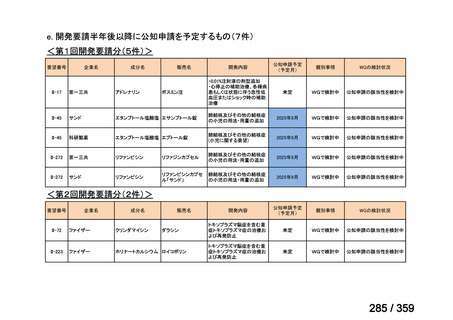
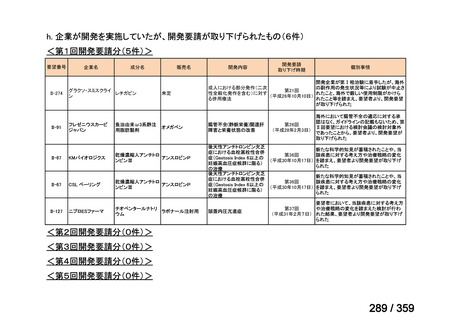
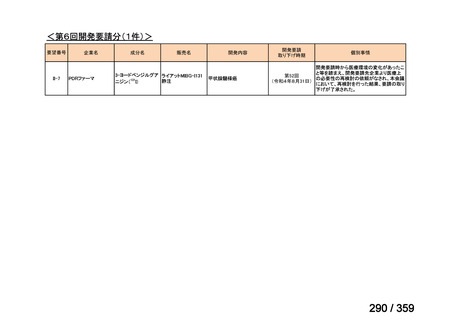
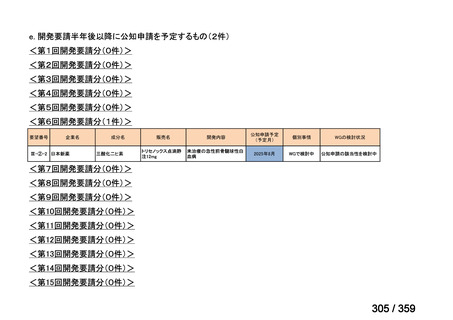
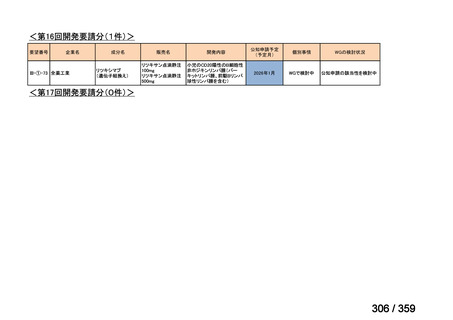
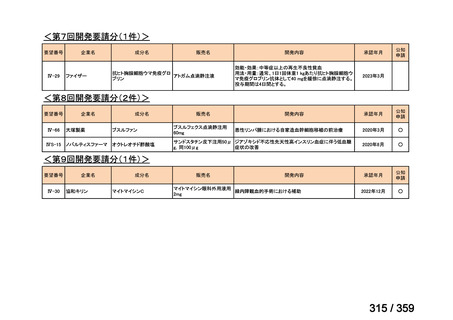
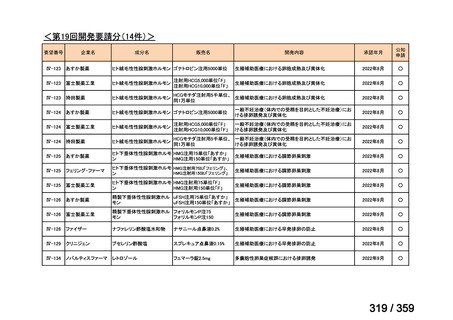
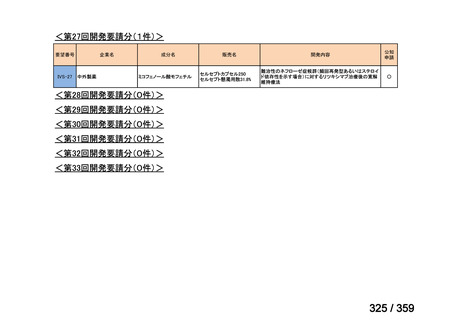
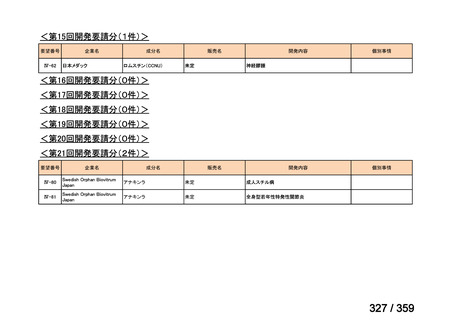
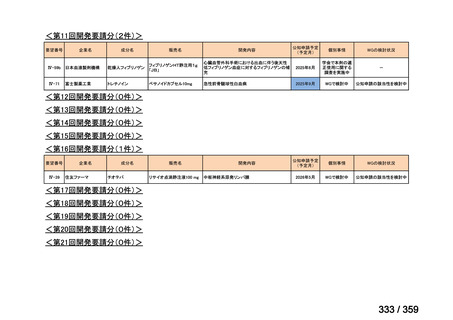
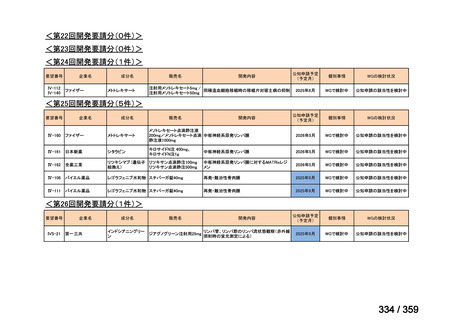
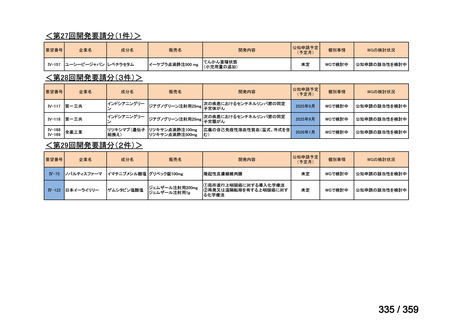
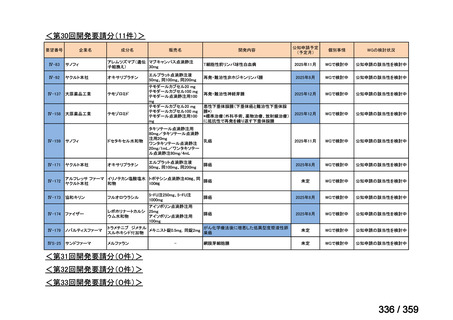
要望番号;IV-179
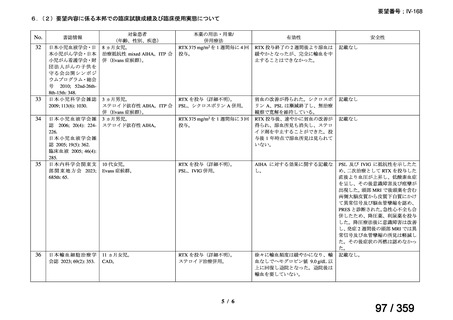
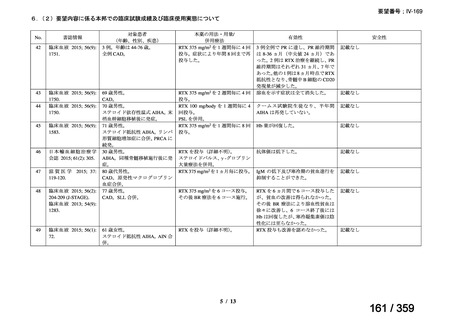
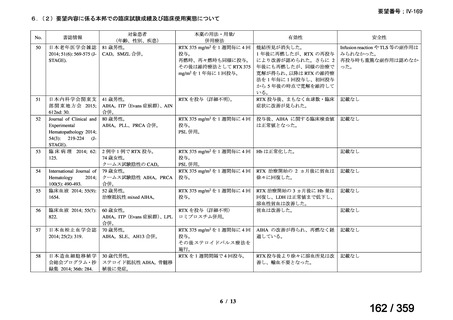
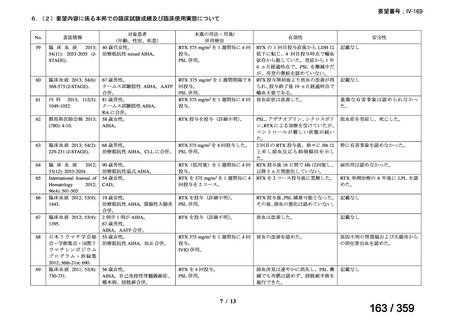
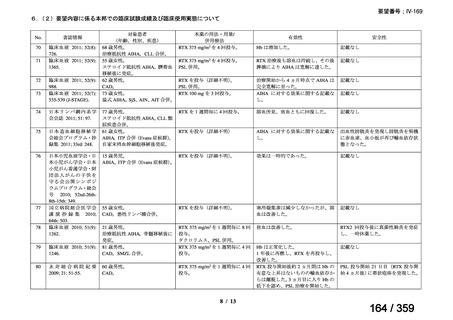
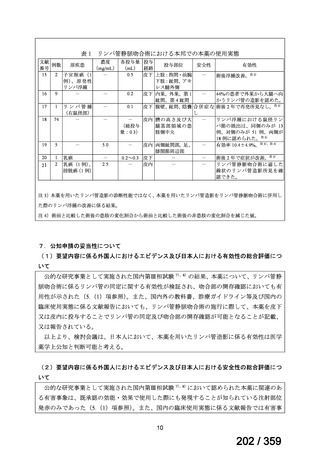
結果:国立がん研究センター中央病院よりトラメチニブ群に登録された患者の臨床データ
(データカットオフ:2024 年 11 月 1 日)の提供を受け,ノバルティスファーマ株式会社
が予備的に解析を行った結果を以下に示す。「低異型度」及び「再発」の患者の同定は,患
者申出療養制度の薬剤提供申請にあたり主治医が登録した社内システムのデータを用いて
行った。
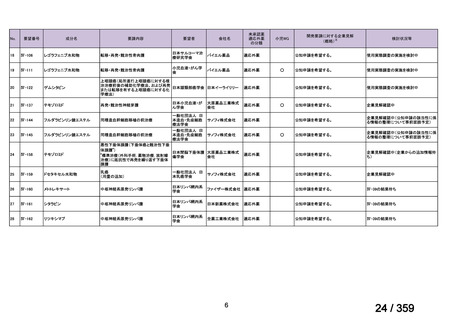
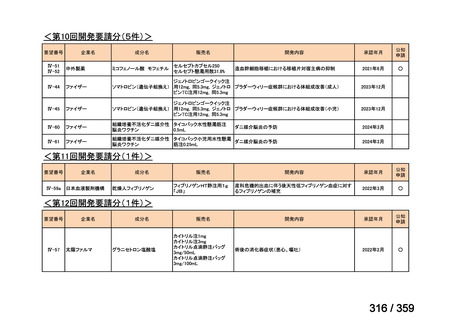
本研究のトラメチニブ群には,69 例の進行固形癌患者が登録され,このうち 59 例(年
齢中央値:57 歳)がトラメチニブの投与を受けた。再発 LGSOC 患者は 5 例(年齢中央値:
55
歳)であった。いずれの患者も再発例であり,薬物治療歴を有していた。
有効性評価:
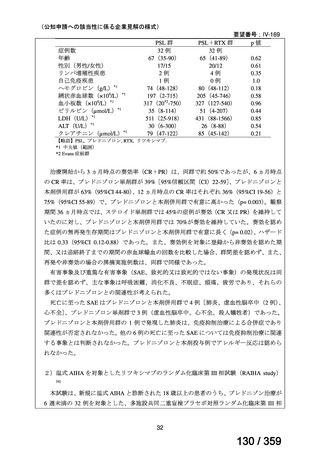
再発 LGSOC 患者 5 例中 2 例の患者で奏効(PR)が認められ,ORR は 40.0%であった。2
例とも KRAS 変異を有していた。他の 3 例の BOR は安定(SD)であり,それぞれ KRAS,
BRAF,NRAF 変異を有していた。
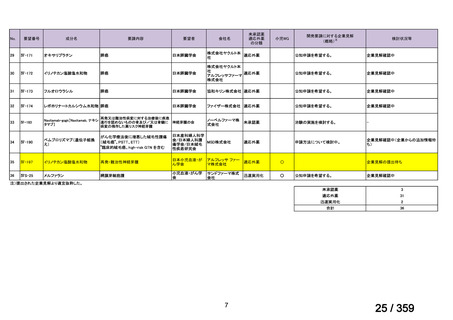
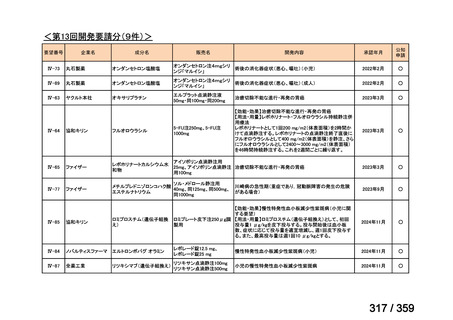
安全性評価:
トラメチニブ群に登録された患者 59 例中 50 例(84.7%)に AE が発現し,高頻度の AE
(10%以上)は,血中クレアチンホスホキナーゼ(CPK)増加(14 例,23.7%),ざ瘡様皮
膚炎(13 例,22.0%),口内炎(10 例,16.9%),アスパラギン酸アミノトランスフェラーゼ
(AST)増加(8 例,13.6%),アラニンアミノトランスフェラーゼ(
ALT)増加(
7 例,11.9%)
であった。35 例(59.3%)の患者に Grade 3 以上の AE が認められ,高頻度の Grade 3 以上
の AE(5%以上)は,血中 CPK 増加(8 例,13.6%), AST 増加(6 例,10.2%),ALT 増加
(5 例,8.5%),貧血(3 例,5.1%)であった。治療関連の死亡はなかった。トラメチニブ
群全体の安全性プロファイルは,国内外の臨床試験の結果と大きな違いはなく,忍容性は
良好であると考えられる。
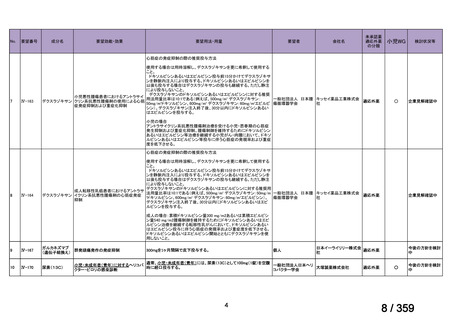
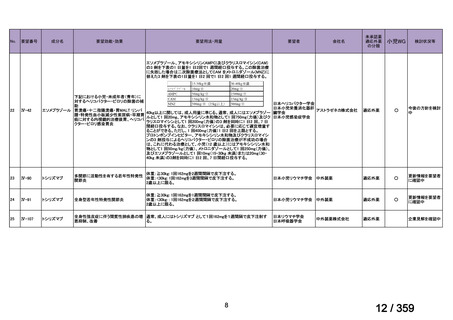
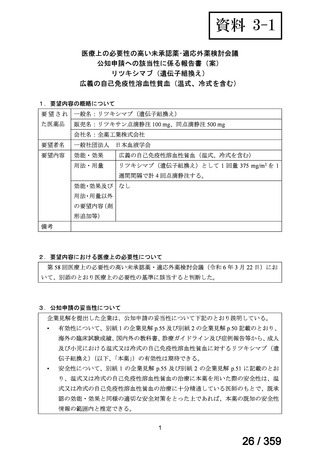
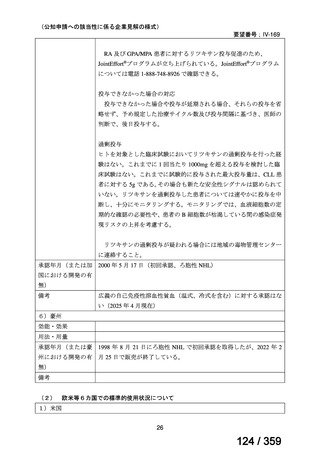
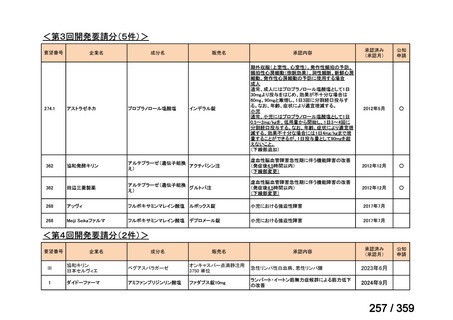
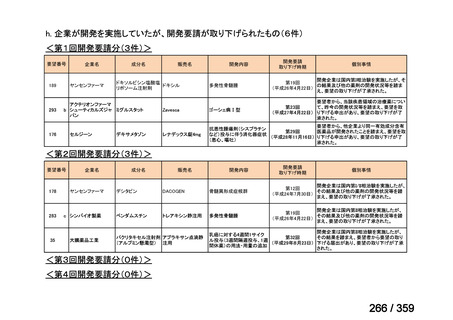
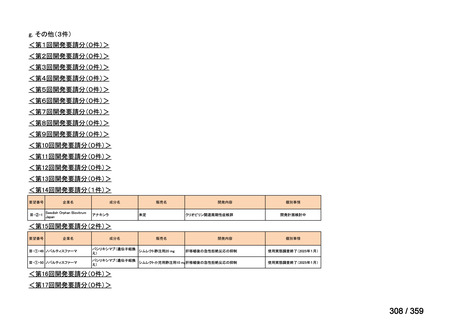
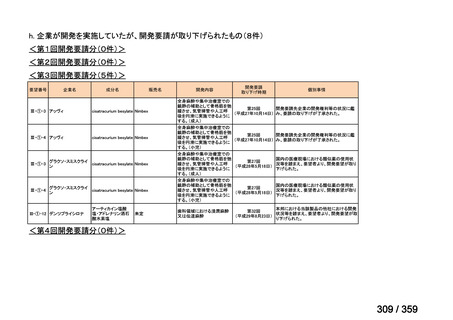
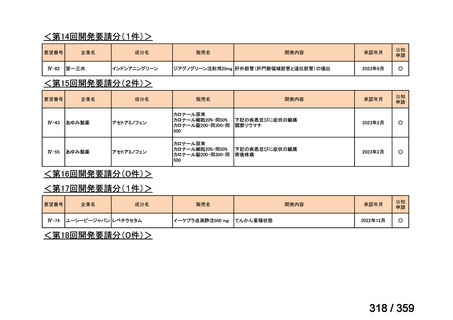
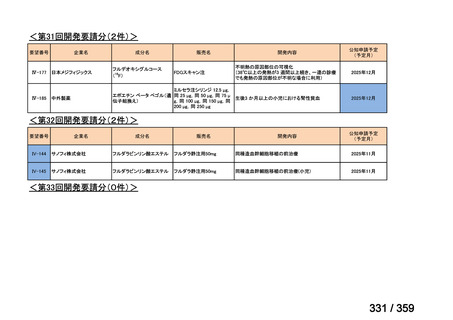
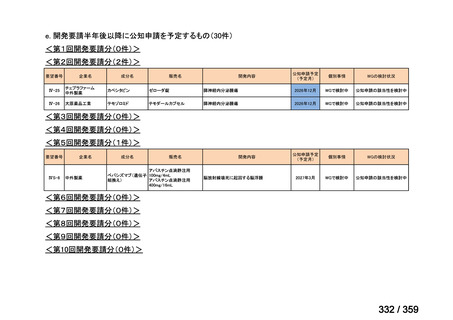
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
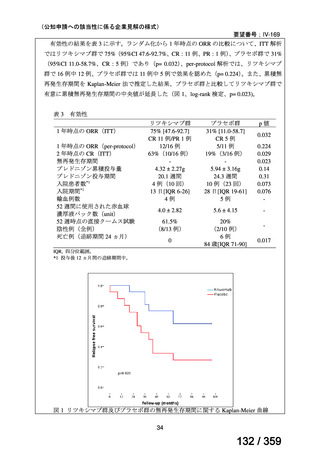
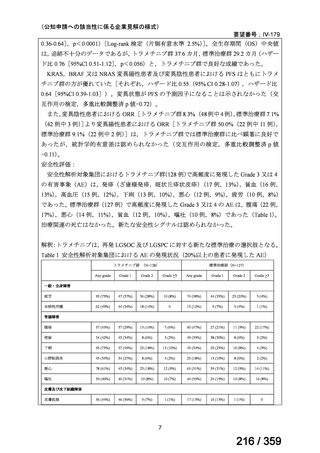
再発 LGSOC 又は LGSPC におけるトラメチニブと標準治療とを比較した国際共同ラン
ダム化非盲検多施設共同第 2/3 相試験(GOG 281/LOGS 試験)において,遺伝子変異の
有無によらない全体集団でトラメチニブ群(N=130)の PFS 中央値は 13.0 カ月(95%CI
9.9-15.0)であったのに対し,標準治療群(N=130)では 7.2 カ月(95%CI 5.6-9.9)であっ
た(ハザード比 0.48[95%CI 0.36-0.64],p<0.0001)。全生存期間中央値は,追跡不十分の
データであるが,トラメチニブ群 37.6 カ月,標準治療群 29.2 カ月(ハザード比 0.76
[95%CI 0.51-1.12],p<0.056)と,トラメチニブ群に良好な成績が得られている。本試験
の結果を基に,欧米の卵巣癌(腹膜癌,卵管癌を含む)のガイドラインでは再発 LGSC 患
者に対する治療としてトラメチニブが推奨されている。なお,再発 LGSFTC については
GOG 281/LOGS 試験の対象に含まれていない。上皮性卵巣癌,卵管癌,及び腹膜癌は,組
11
220 / 359