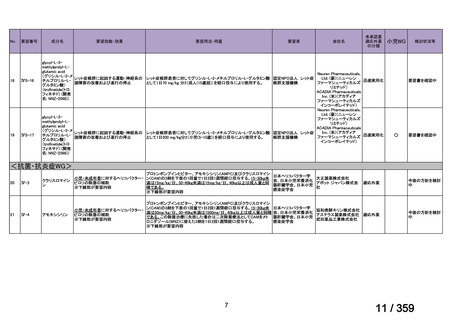
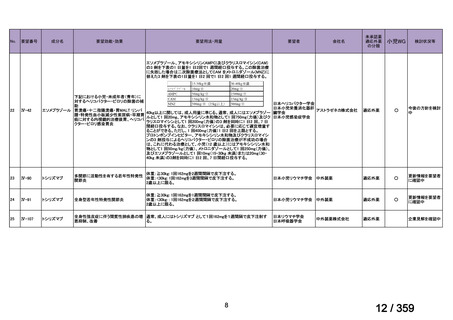
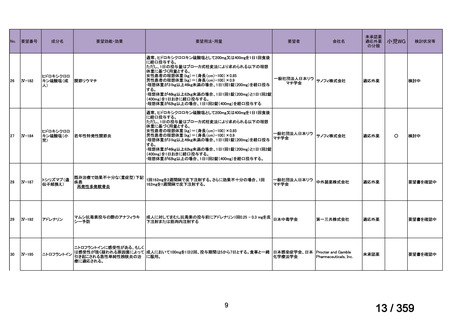
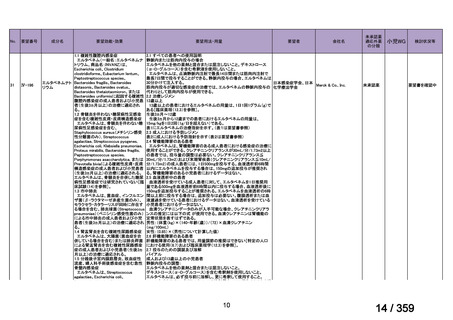
会議資料 (149 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第64回 7/4)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
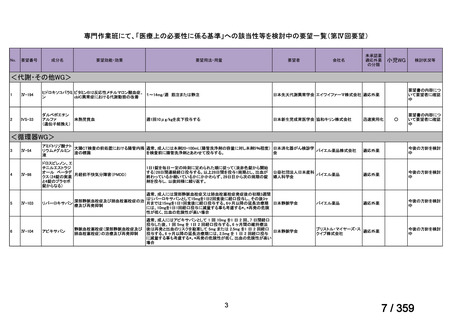
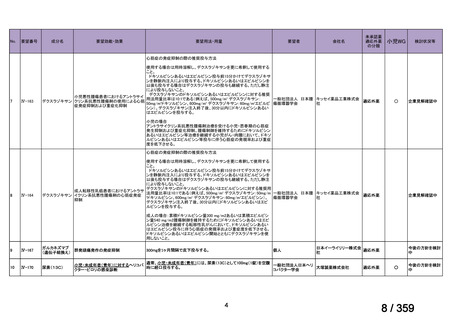
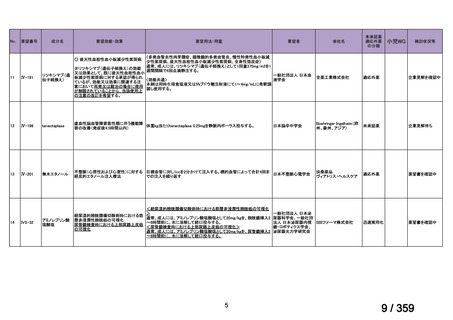
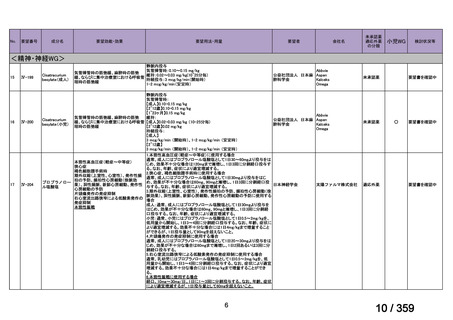
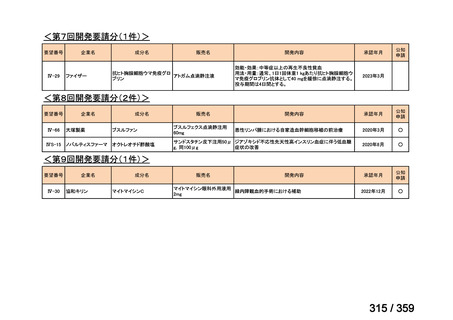
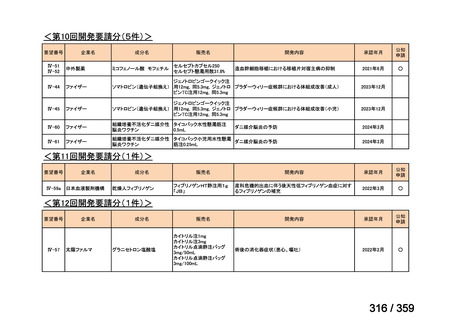
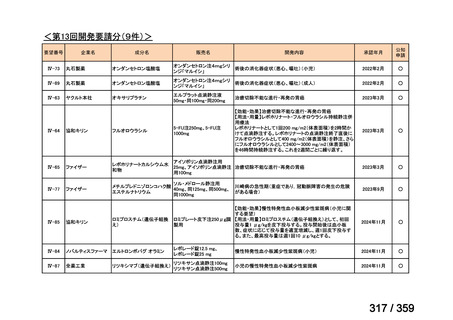
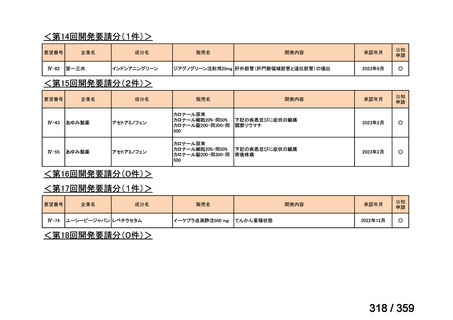
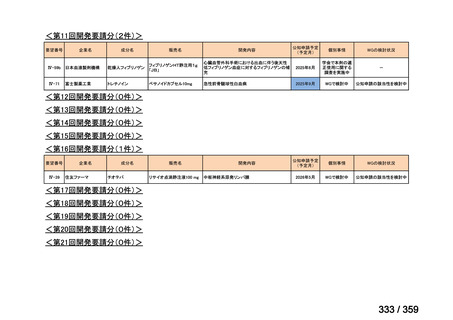
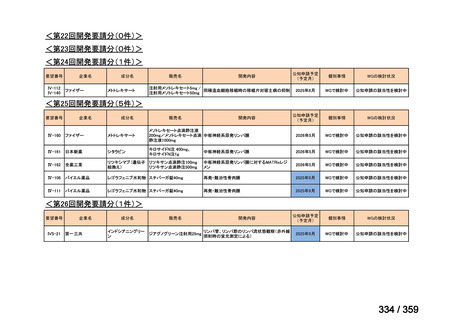
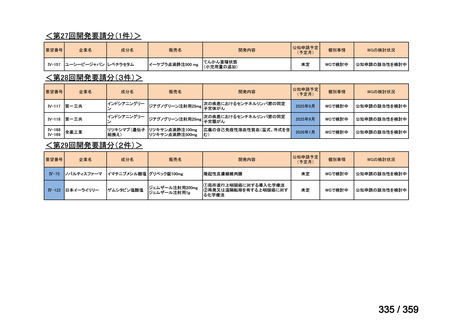
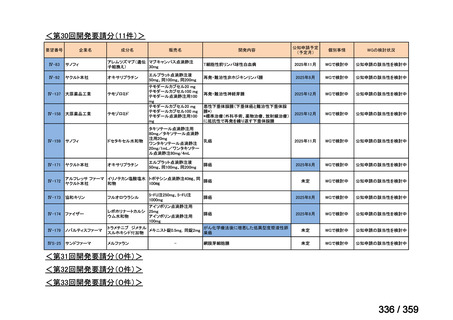
要望番号;IV-169
本剤は、B 細胞表面の CD20 抗原に対するモノクローナル抗体であり、作用発現に人種差
はないことから、上記の海外で実施された臨床試験等の結果、メタ・アナリシス/システマ
ティックレビュー、総説、国内外の診療ガイドライン及び教科書の記述、並びに国内の使用
実態の状況を踏まえ、本剤の AIHA 患者に対する有効性が期待できると考える。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
「5.要望内容に係る国内外の公表文献・成書等について」及び「6.本邦での開発状況
(経緯)及び使用実態について」に示したとおり、成人の AIHA 患者に対して本剤を投与し
た場合に確認された安全性情報は、これまでに蓄積された本剤の安全性情報と同様であると
考えられることから、本剤の特徴的な副作用である infusion reaction や感染症に十分注意し、
予防処置を実施することで、本邦においても成人の AIHA 患者に対して本剤の投与は可能で
あると考える。
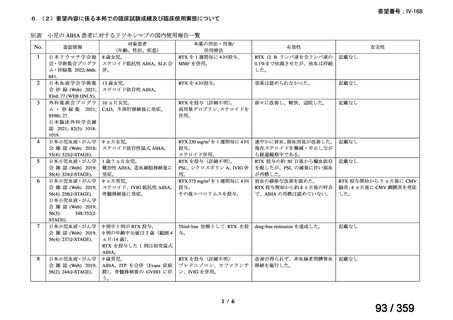
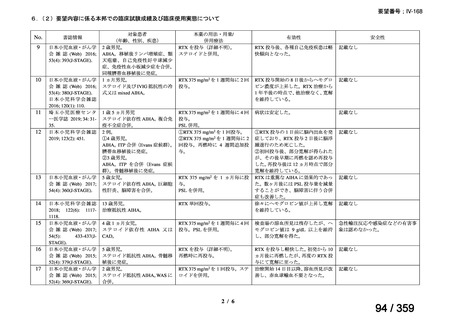
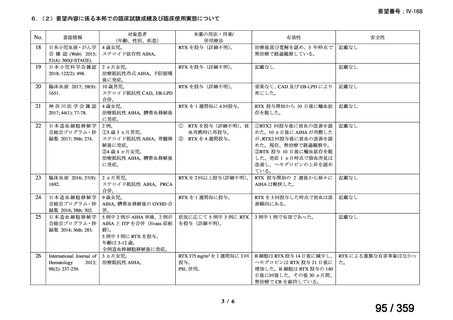
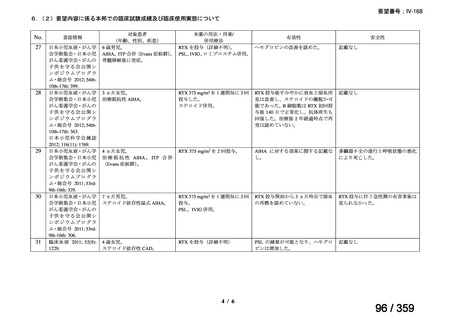
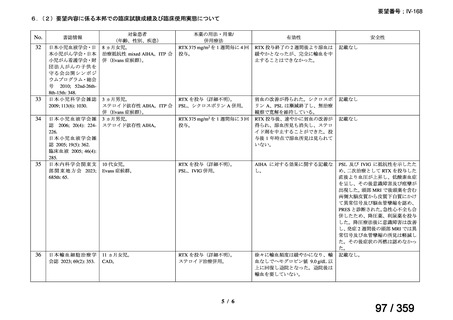
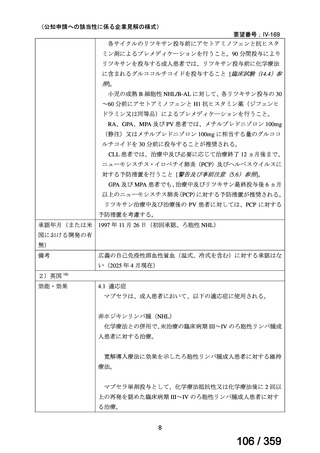
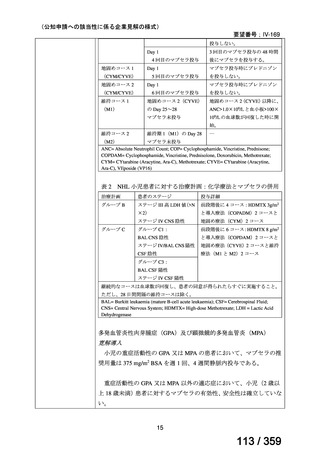
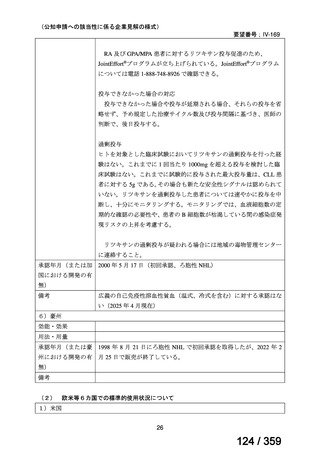
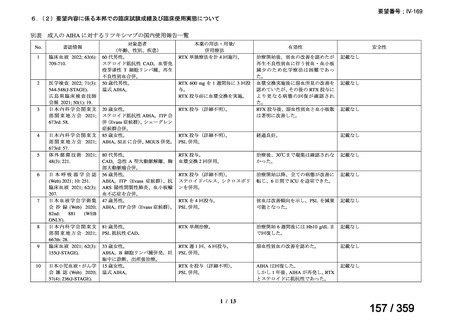
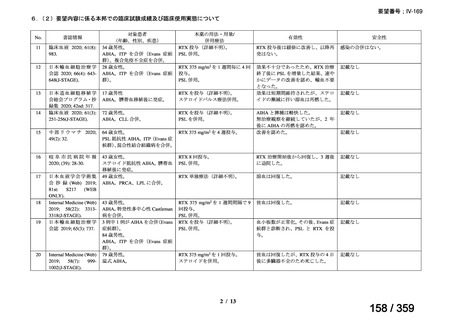
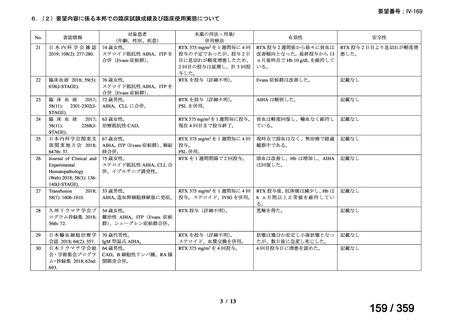
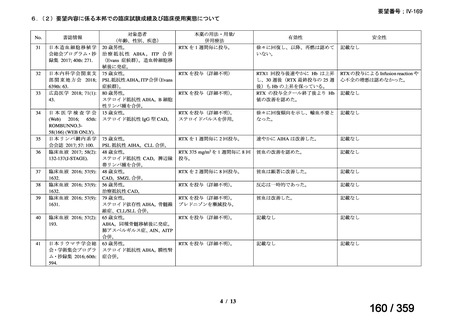
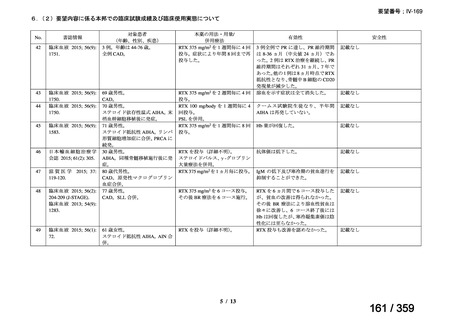
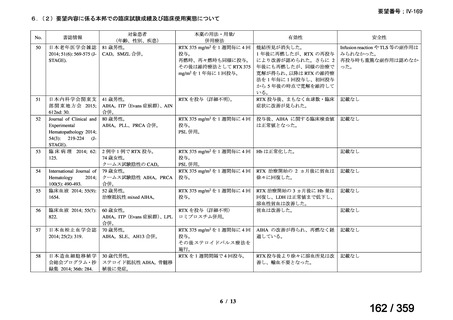
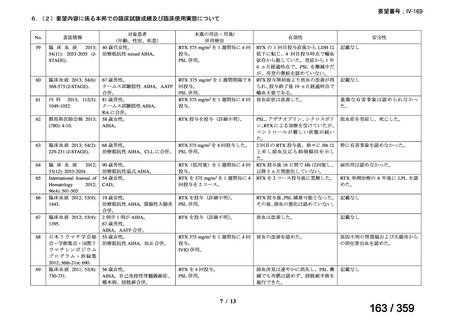
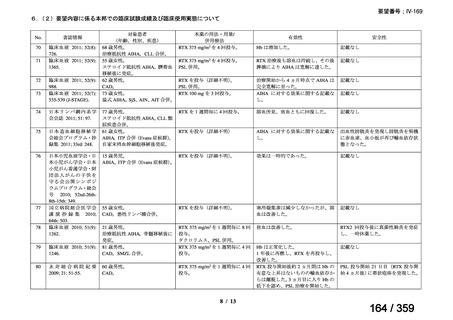
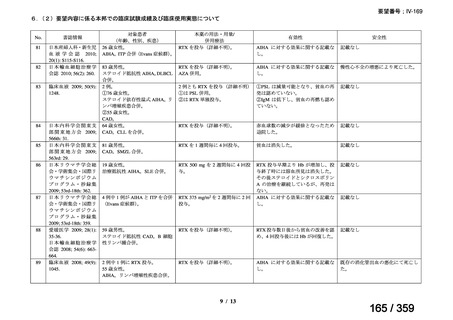
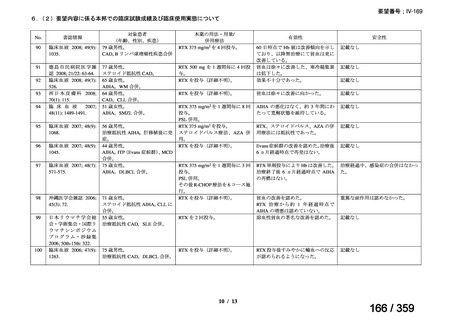
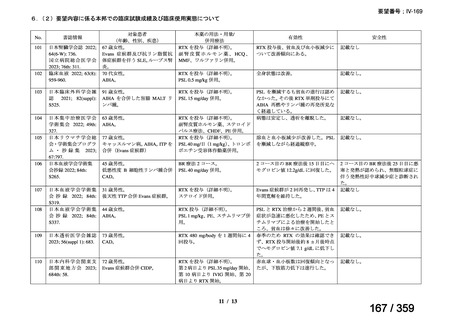
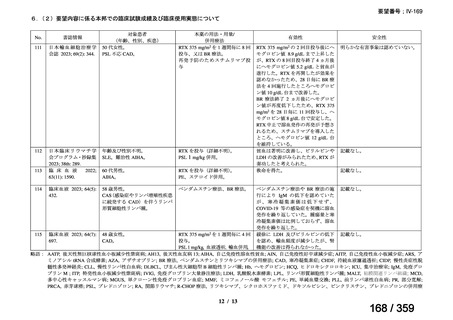
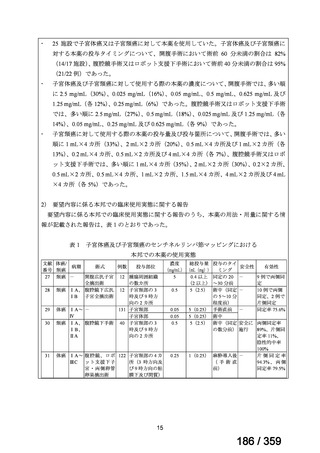
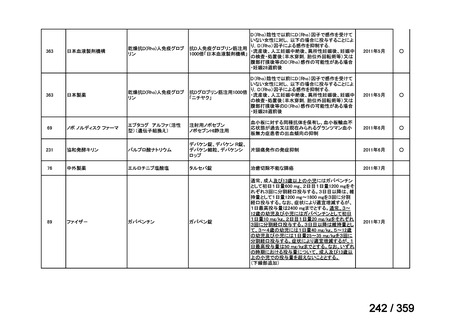
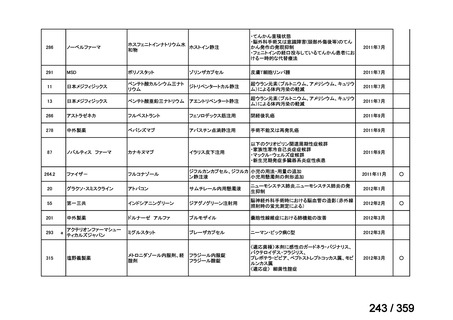
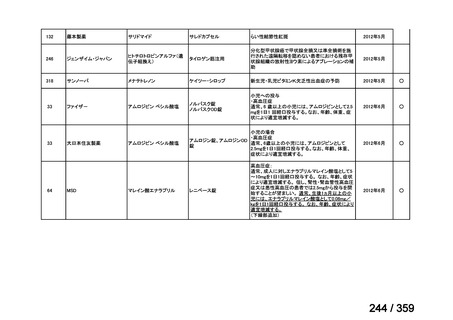
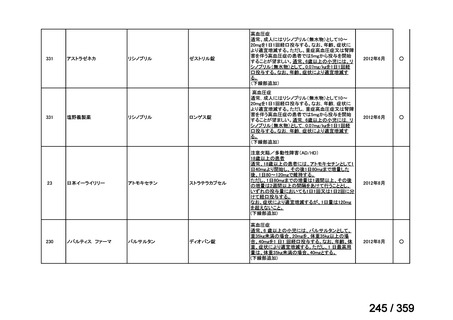
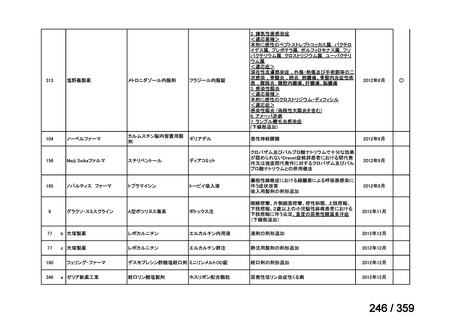
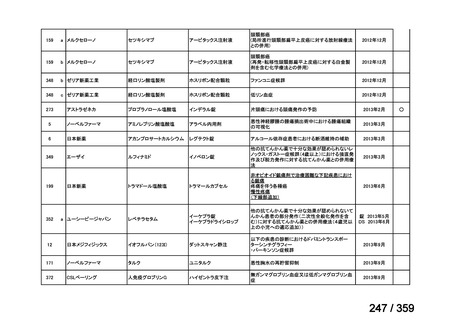
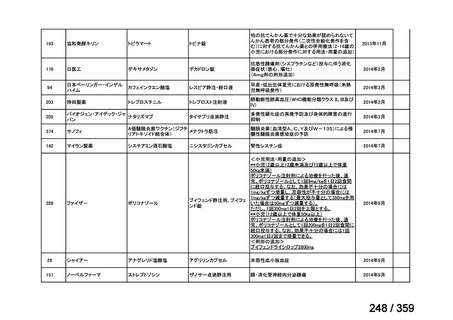
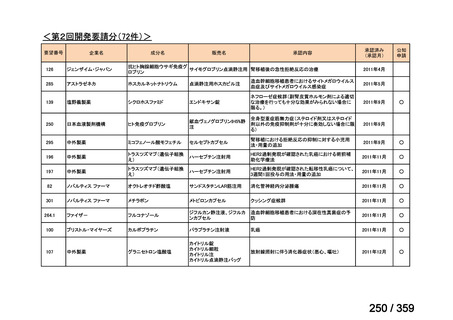
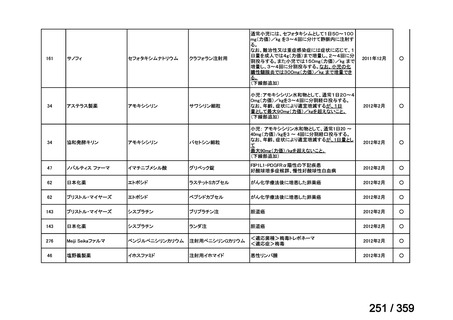
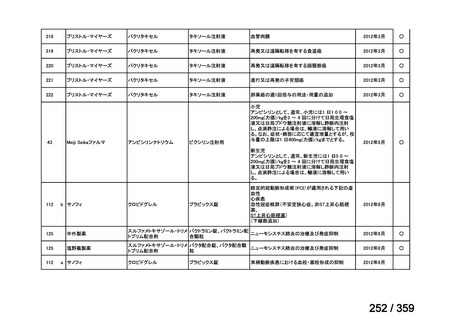
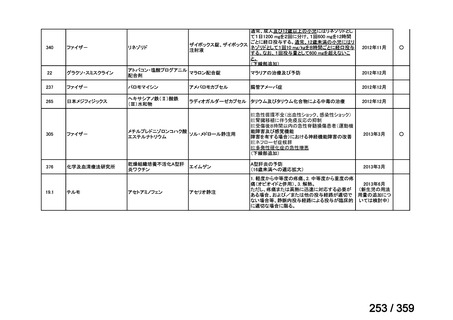
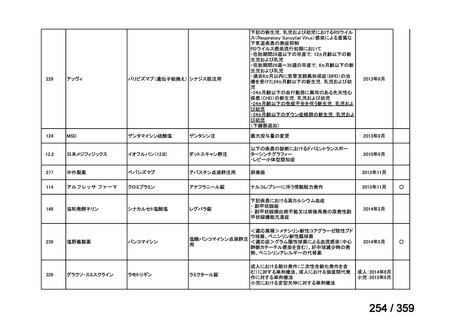
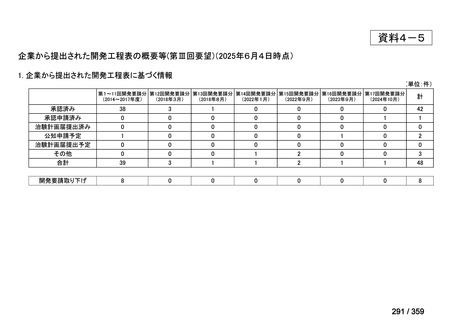
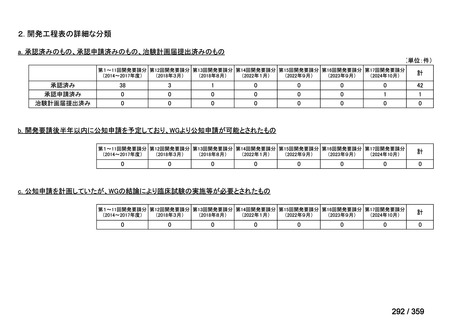
その他、国内における臨床使用実態が 115 件確認されているが(別表参照)
、本剤投与によ
る新たな有害事象の発現や、成人の AIHA 患者で特有な有害事象等は認められていない。
成人の AIHA 患者に対する本剤の投与によって報告された有害事象の多くは軽症から中等
症の事象であり、また、本剤でこれまでに確認されている infusion reaction、アレルギー反応
や感染症が主な事象であった。これら報告された有害事象については、本剤に特徴的な有害
事象として既に添付文書で注意喚起されている。
なお、死亡例に関する報告があるが、その原因は治療とは関連がない場合がほとんどであ
り、治療と関連がありと判断された症例 24)では、免疫抑制状態が起因すると考えられたこと
から、本剤と副腎皮質ステロイド薬の併用や、副腎皮質ステロイド薬又は免疫抑制作用を有
する薬剤の治療歴を有する患者においては、免疫抑制状態や感染症に十分な注意が必要と考
えられる。
以上より、本剤を成人の AIHA 患者に対して投与する際の安全性については、AIHA の治
療に十分精通している医師のもとで、本剤の既承認の効能又は効果と同様の適切な安全対策
をとった上であれば、本剤の既知の安全性情報の範囲内であると推定できる。
(3)要望内容に係る公知申請の妥当性について
「7.公知申請の妥当性について」の「
(1)要望内容に係る外国人におけるエビデンス及
び日本人における有効性の総合評価について」及び「(2)要望内容に係る外国人におけるエ
ビデンス及び日本人における安全性の総合評価について」に示したとおり、本剤は、海外の
臨床試験の結果、メタ・アナリシス/システマティックレビュー、国内外の教科書及びガイ
ドラインで示された内容から有効性が期待でき、本剤を成人の AIHA 患者に対して投与する
ことにより安全性上の懸念が生じる恐れはないと考える。
国内の臨床使用実態については、
「6.本邦での開発状況(経緯)及び使用実態について(2)
要望内容に係る本邦での臨床試験成績及び臨床使用実態について」に示したとおり、115 件
51
149 / 359