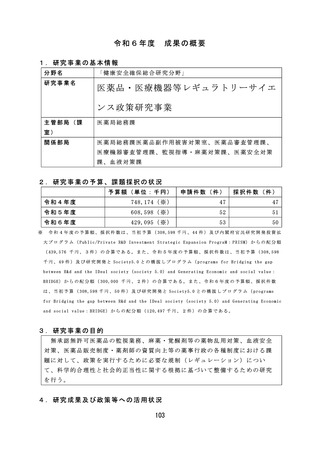
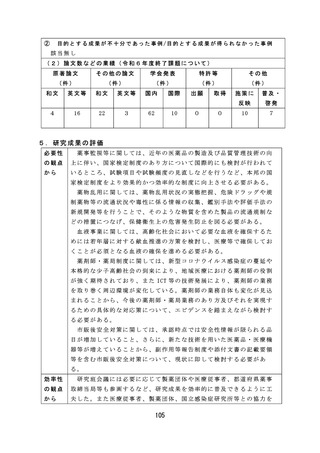
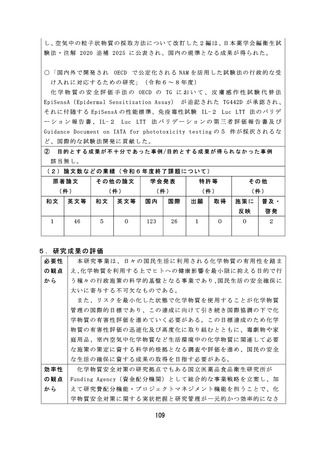
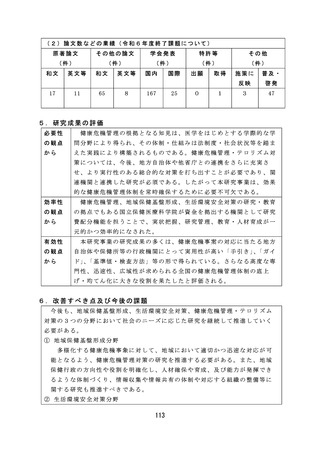
【資料2-2】厚生労働科学研究の成果のまとめ(令和6年度) (106 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59644.html |
| 出典情報 | 厚生科学審議会 科学技術部会(第145回 7/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
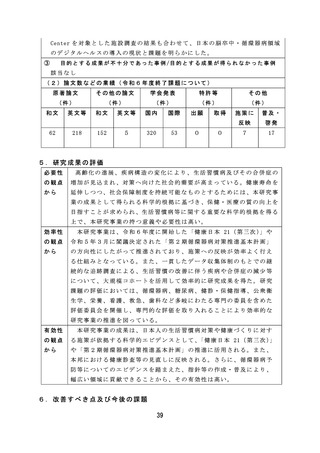
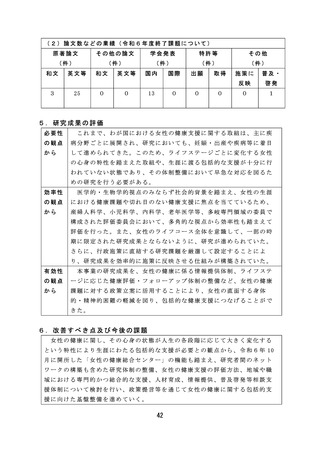
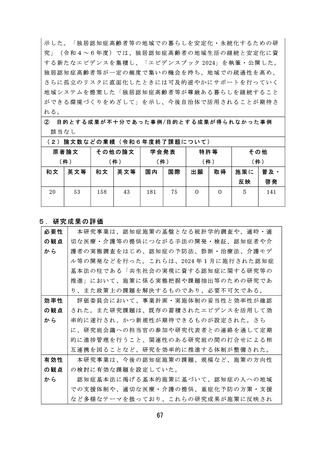
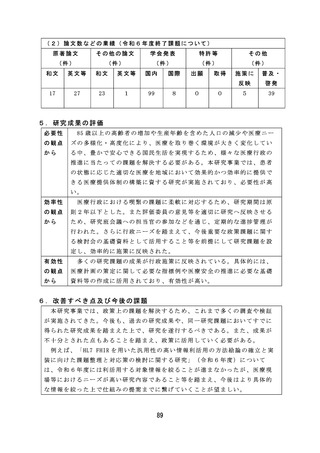
安全性を確保するため病原体に対する迅速かつ簡便な検出系を構築す
るなど、適切な体制で効率的に検討を行った。
有効性
薬事監視等に関しては、研究成果が国家検定における感染研(現
の観点
JIHS) か ら PMDA へ の 業 務 移 管 に 係 る 品 目 選 定 に 活 用 さ れ る な ど 、 薬 事
から
監視業務における効率的、効果的な制度の運用を可能とする有効な研
究成果が産出された。
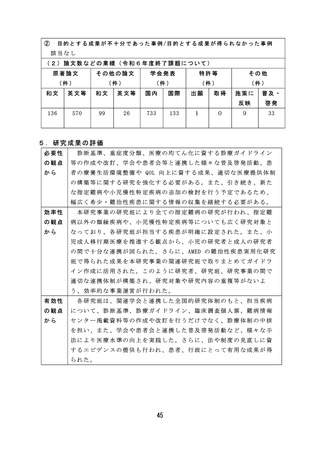
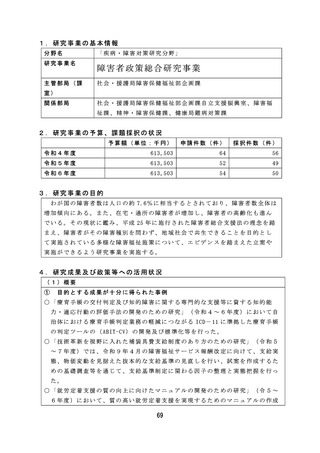
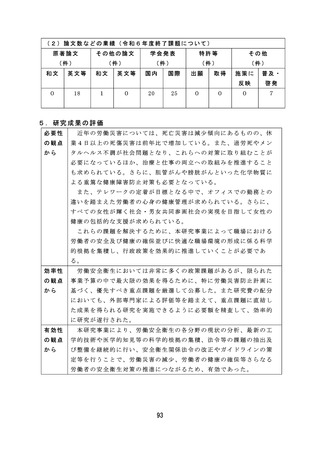
薬物乱用に関しては、薬物乱用状況の実態把握による薬物関連施策
の立案・評価の基礎データのほか、指定薬物等の指定等の基礎資料と
しての活用や、関係機関への提供による現場での迅速な取締りへの活
用が可能となる有効な研究成果が得られた。
血液事業に関しては、若年層に対する献血推進の方策とその効果に
関する研究では、献血教育において参加型実習による効果を検討した
ところ参加型実習では初回献血者が増加する結果が得られた。この結
果より献血教育で参加型実習が組み込まれることが期待され、今後に
活用できる成果が得られた。
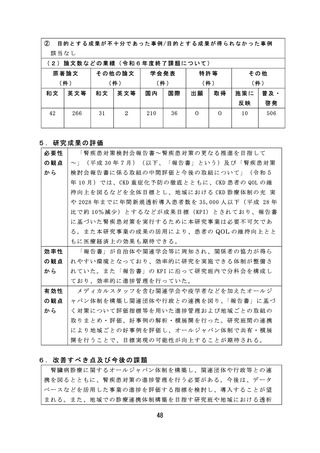
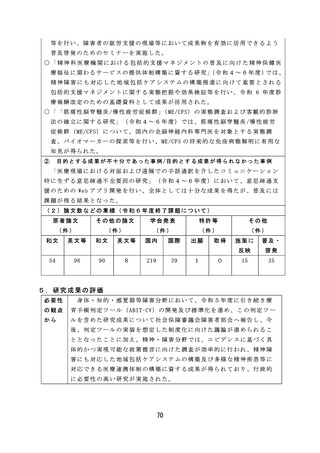
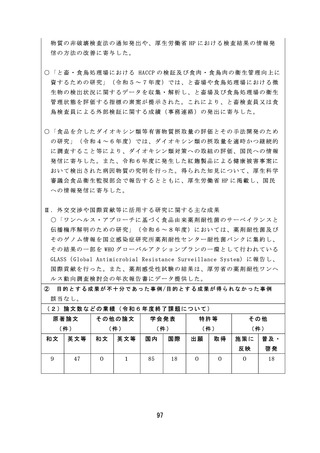
薬剤師・薬局制度に関しては、質の高い対人業務を評価し、薬局薬
剤師の業務の質を担保するため、対人業務の質を評価するための指標
( QI) の 候 補 を 開 発 す る な ど 有 効 な 研 究 成 果 が 得 ら れ た 。
市販後安全対策に関しては、体外診断用医薬品の副作用報告制度及
び添付文書の記載要領のあり方について検討し、制度改正や記載要領
通知改訂につながる成果が得られた。
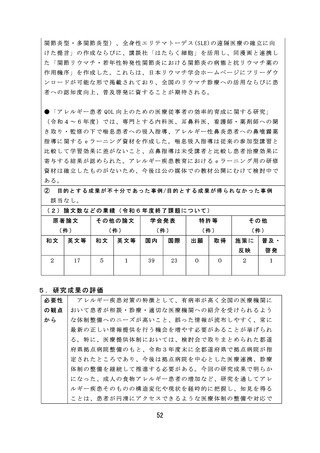
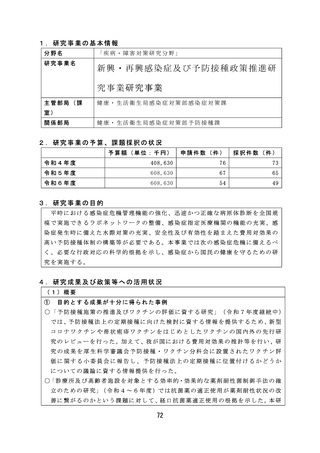
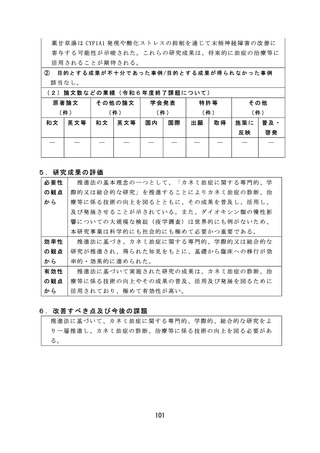
6.改善すべき点及び今後の課題
薬 事 監 視 等 に 関 し て は 、 感 染 研 ( 現 JIHS) か ら PMDA へ の 検 定 業 務 の 移 管 が 令
和 7 年 度 か ら 5 年 程 度 要 す る 見 込 み で あ り 、 SLP 審 査 の み で ロ ッ ト リ リ ー ス が 可
能な品目の検討を継続して実施する必要がある。
薬 物 乱 用 に 関 し て は 、 海 外 で は 、 NPS( 新 規 精 神 作 用 物 質 ) に よ る 健 康 被 害 が
報告されており、インターネット販売等を通じて国内に流入する可能性がある
ため、今後も海外の情報を収集するとともに、これらの物質に関する分析法・
鑑別法の構築が求められる。
血液事業に関しては、新規血液の開発動向の調査の結果、各種の新規血液製
剤の製造・開発の点で課題が多く、薬事承認が見通せる段階には達していない
ことがわかった。今後は国内での開発・承認申請を促進するべく、海外での有
効性、安全性等のエビデンスを調査していく必要がある。
薬剤師・薬局制度に関しては、地域住民の予防・健康づくり等に必要な情報
提供・相談対応等の健康サポート機能の取組が薬局には求められており、薬局
106