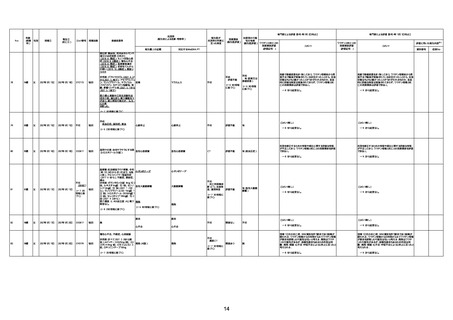
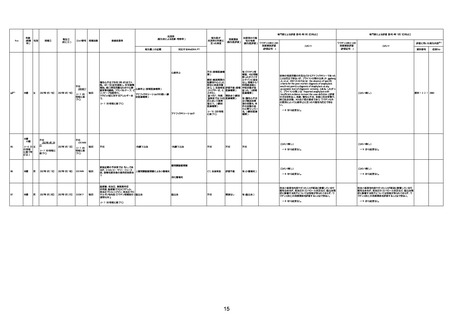
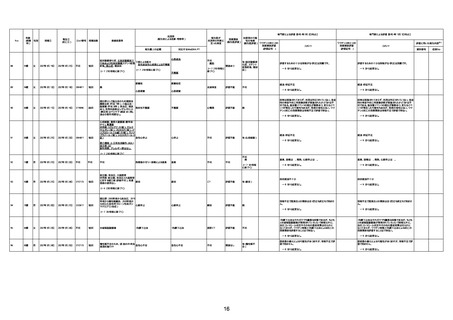
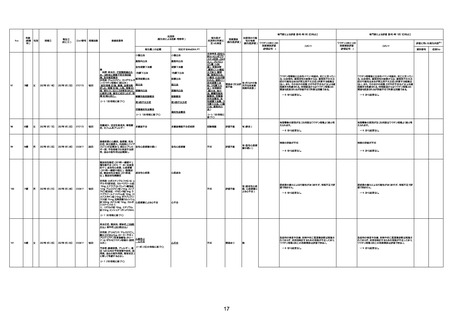
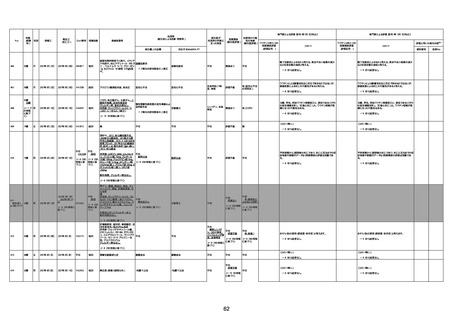
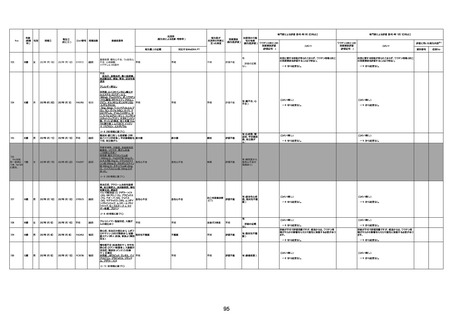
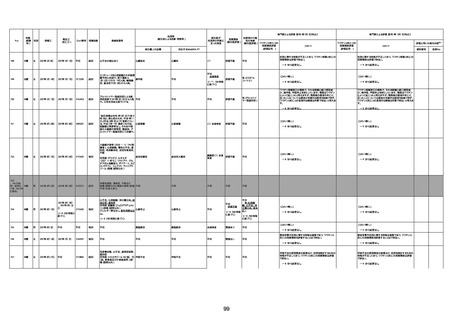
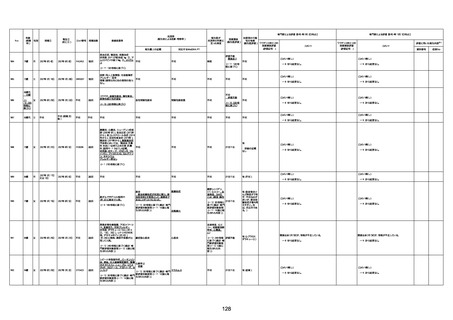
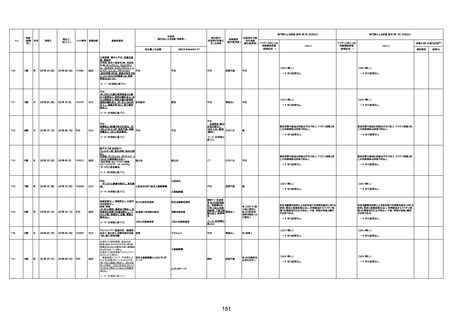
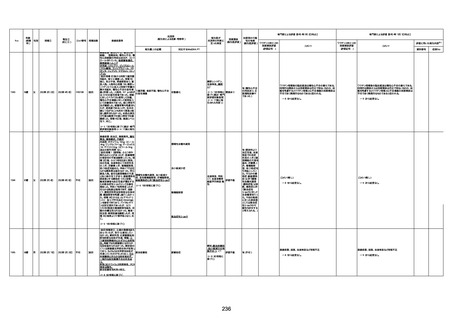
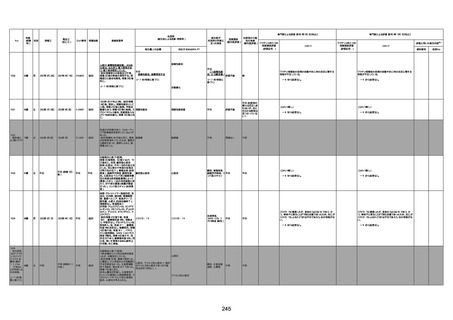
資料1-3-1 新型コロナワクチン接種後の死亡として報告された事例の概要(コミナティ筋注) (270 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html |
| 出典情報 | 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第14回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(10/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
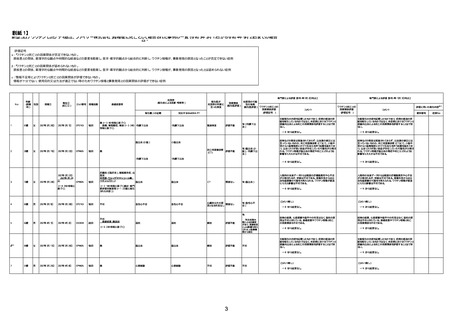
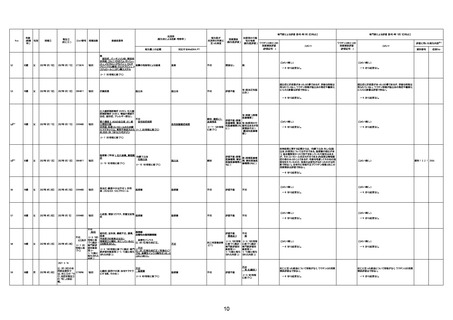
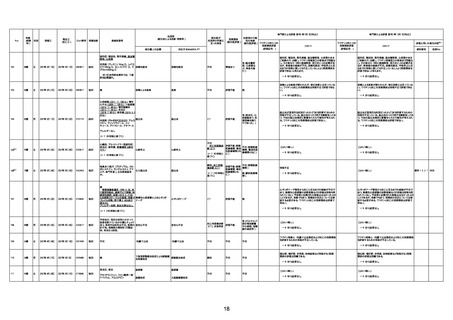
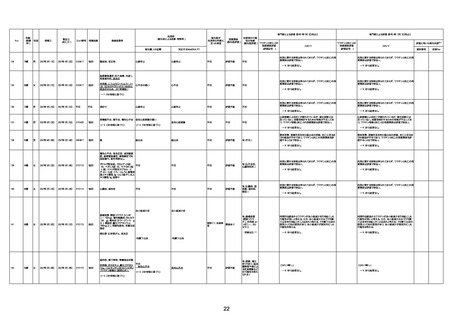
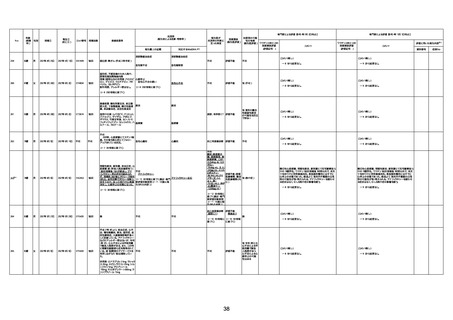
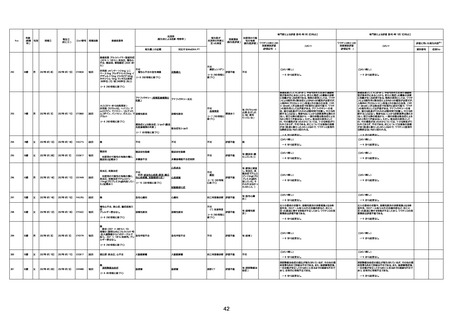
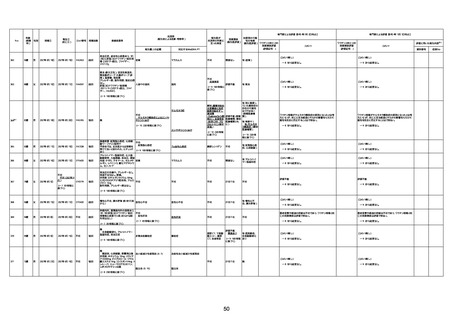
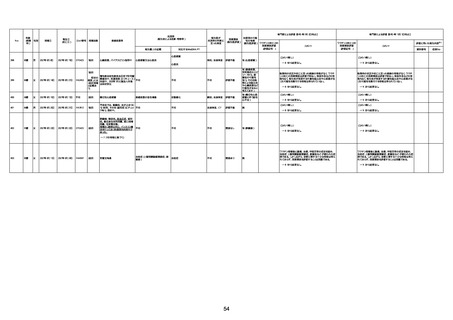
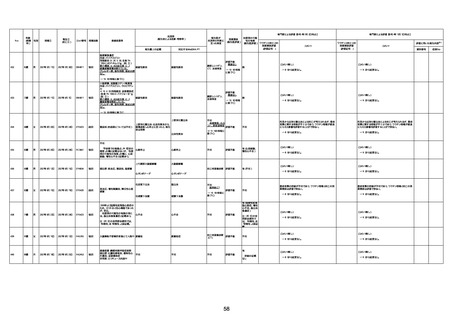
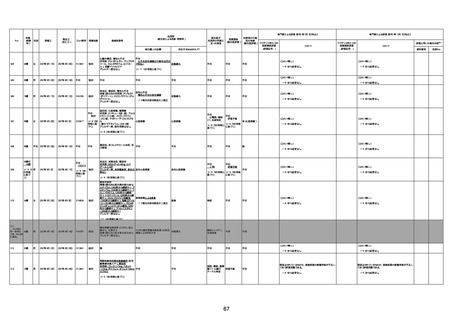
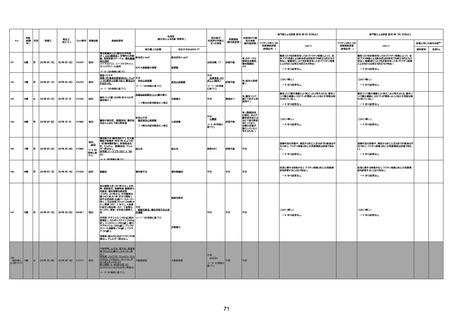
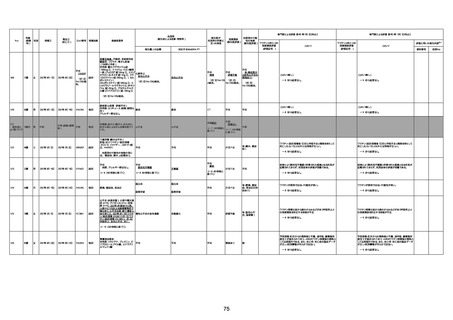
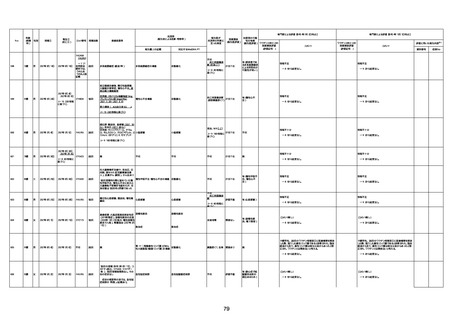
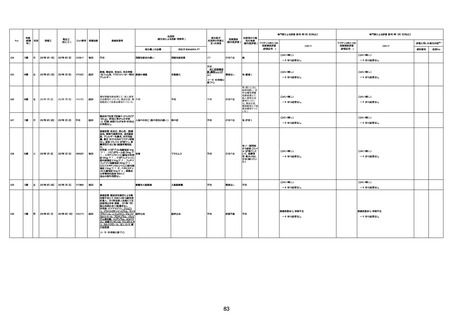
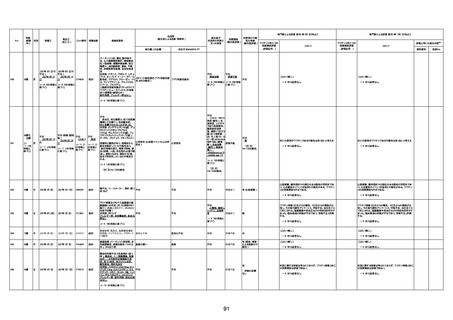
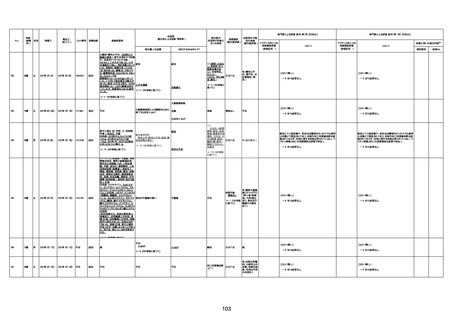
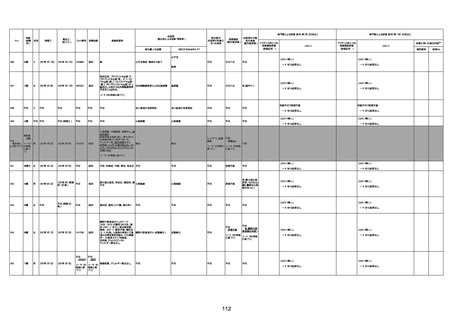
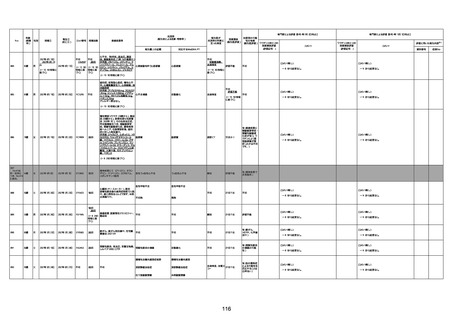
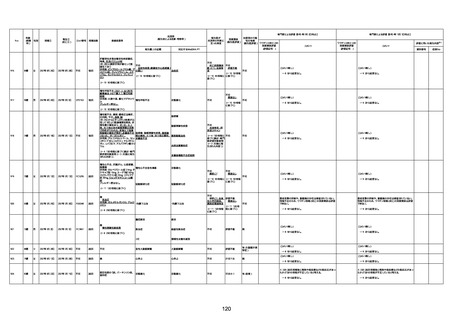
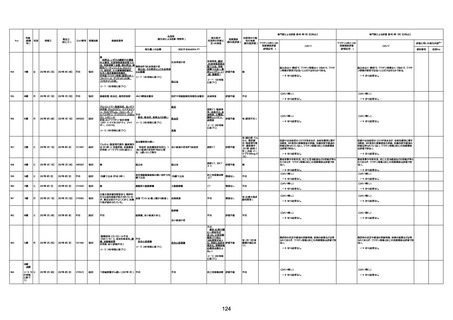
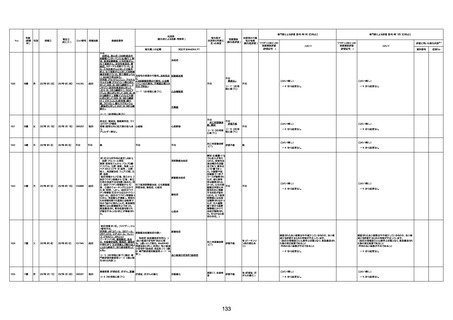
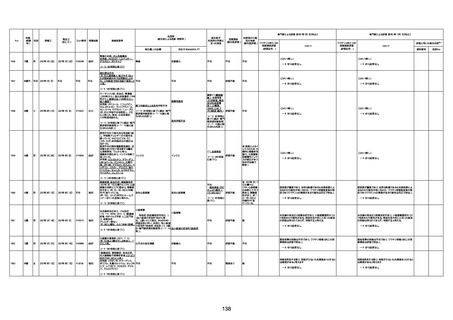
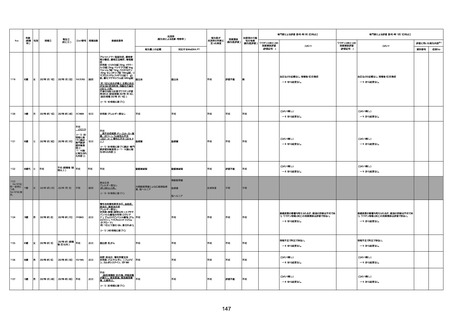
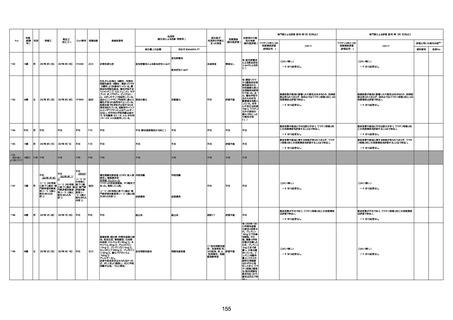
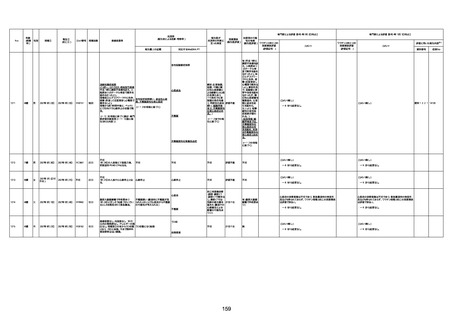
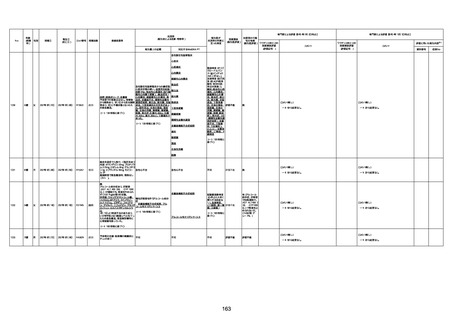
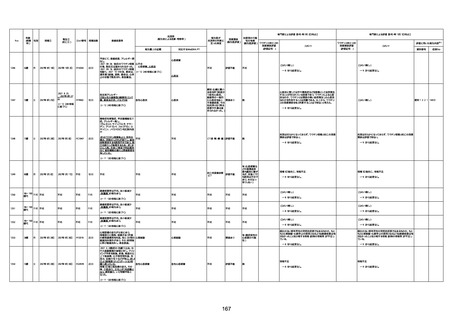
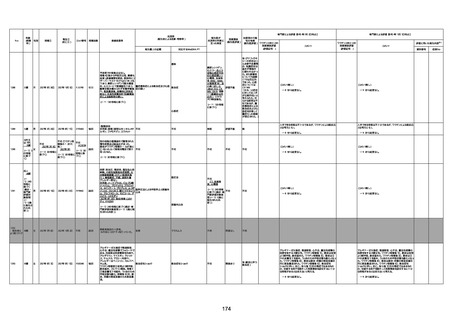
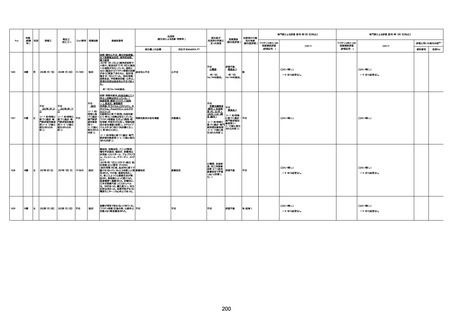
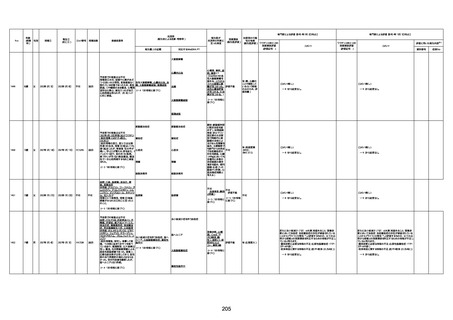
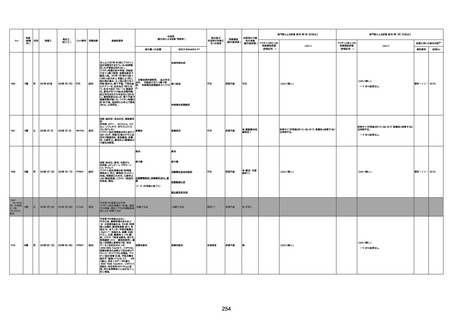
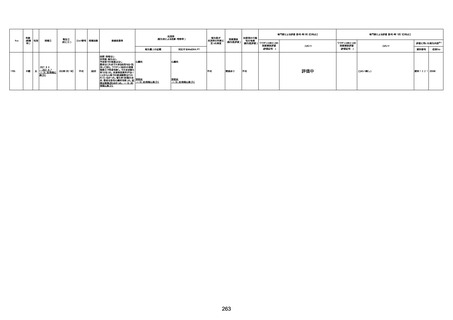
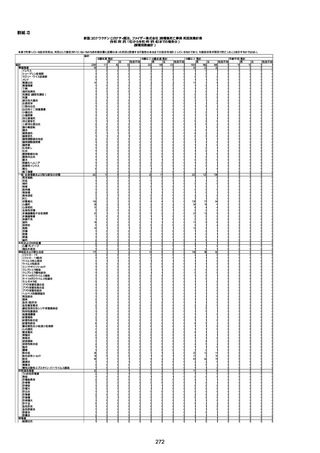
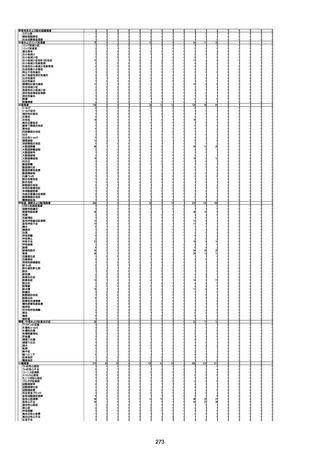
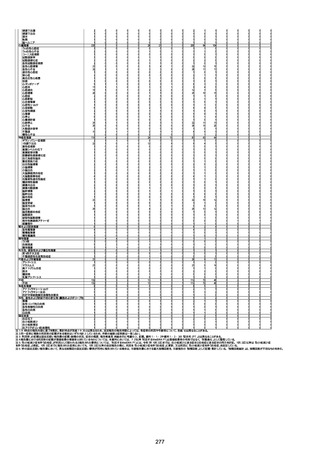
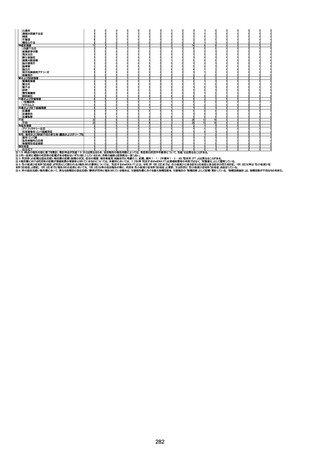
年齢
(接種
時)
性別
接種日
発生日
(死亡日)
ロット番号
接種回数
死因等
(報告者による見解・考察等)
基礎疾患等
報告書上の記載
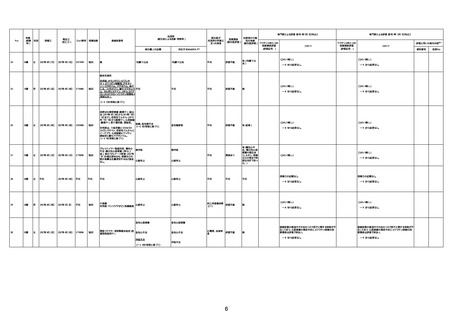
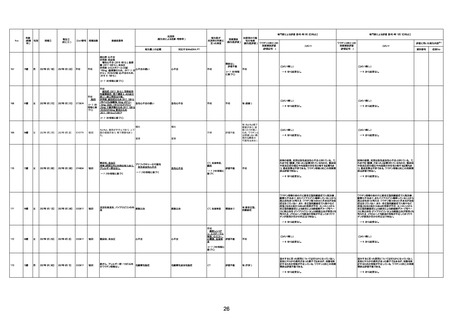
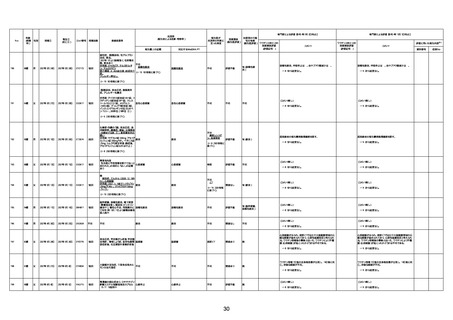
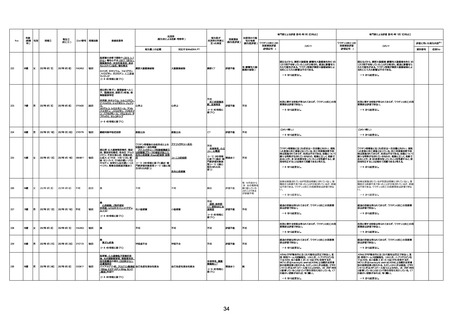
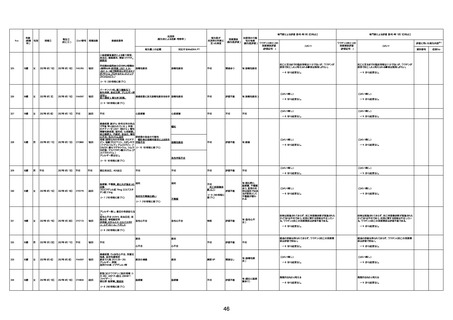
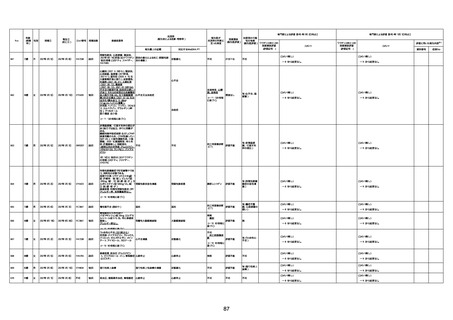
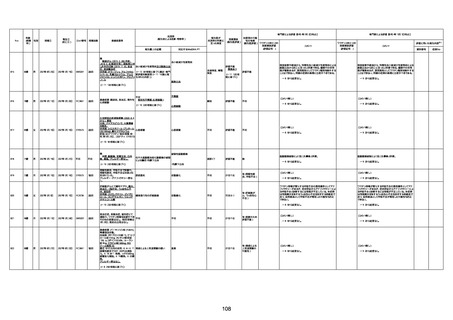
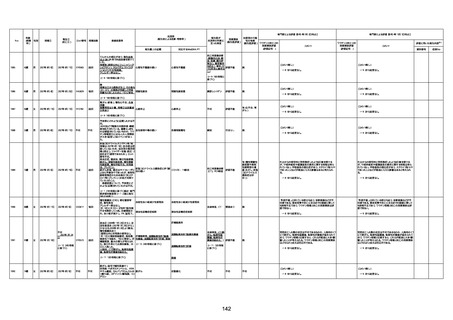
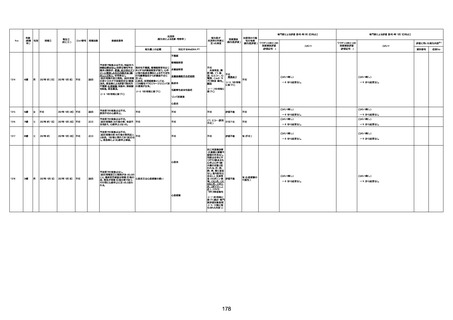
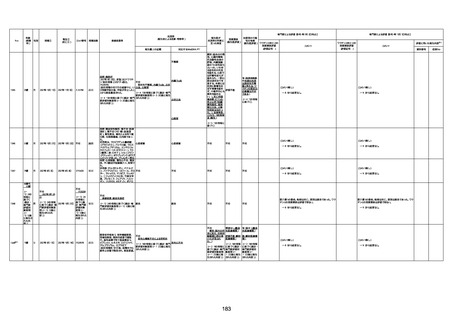
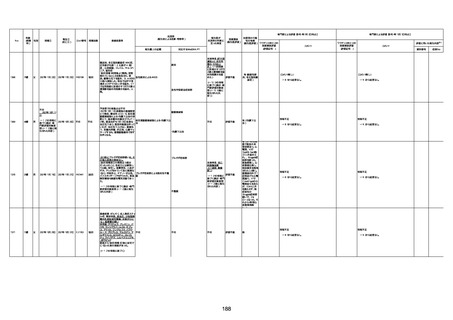
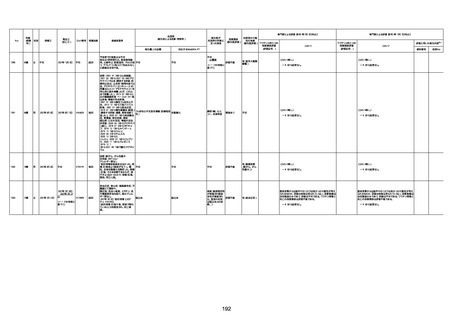
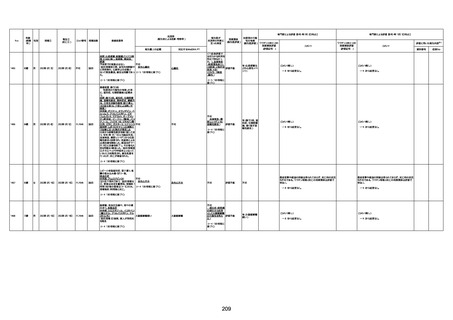
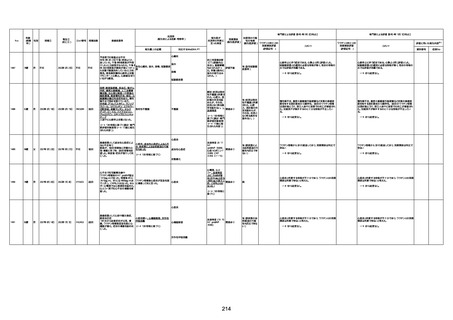
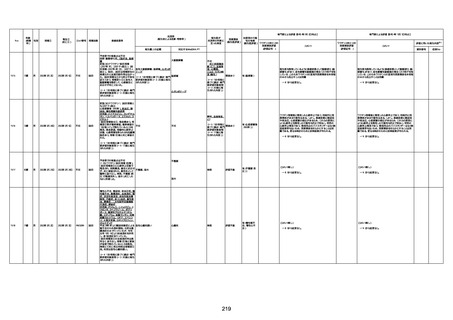
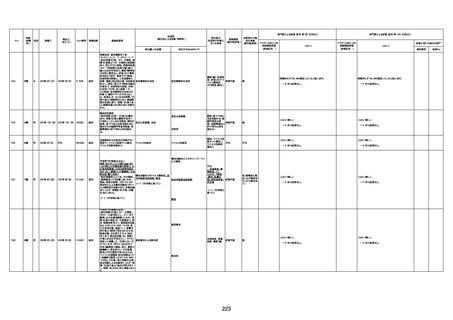
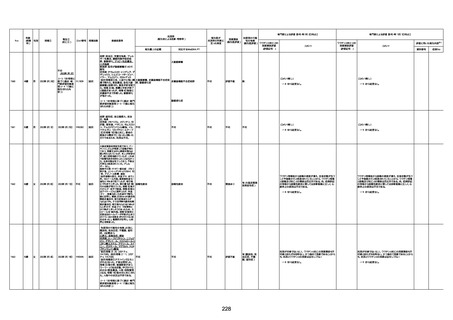
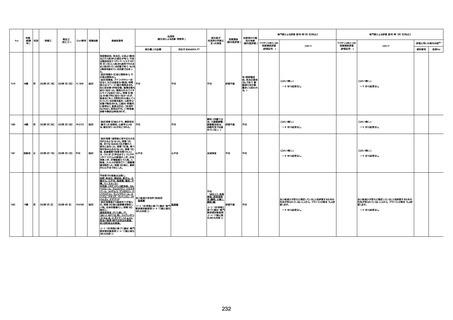
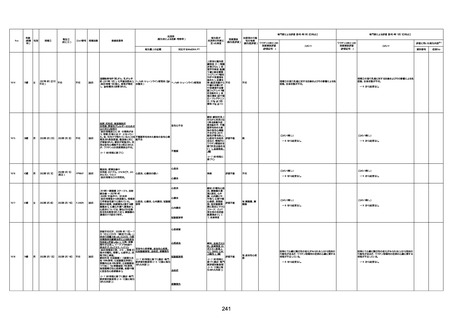
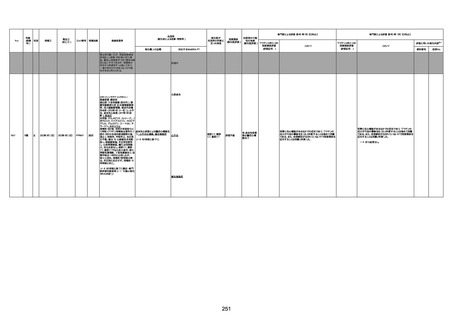
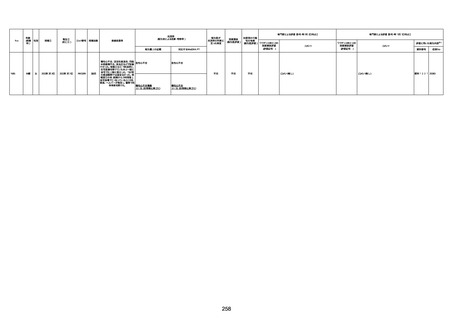
1730
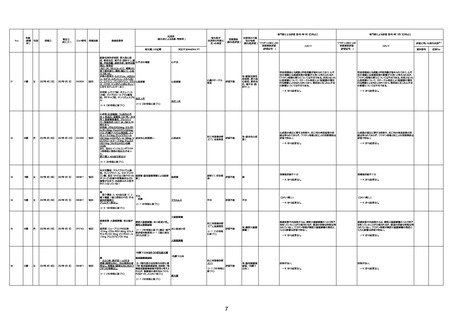
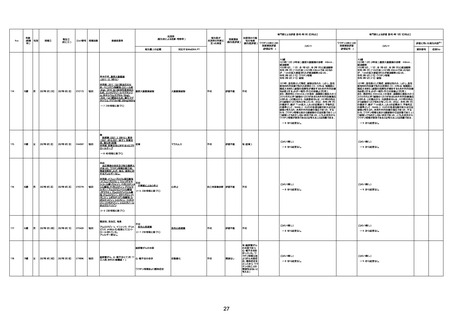
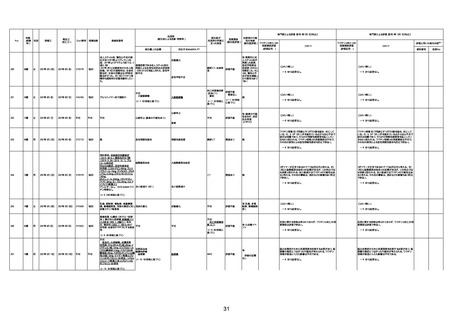
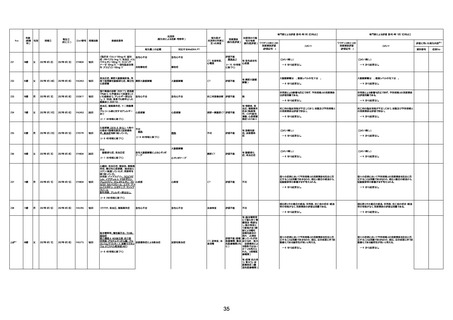
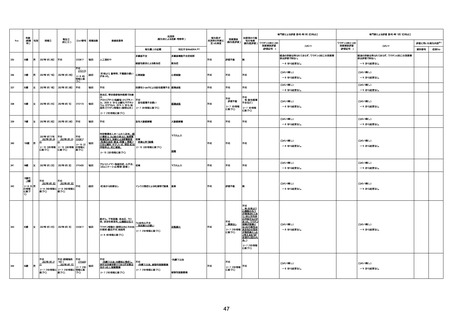
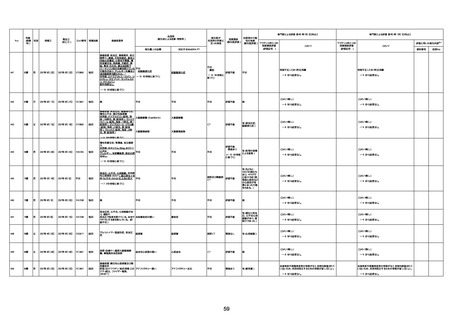
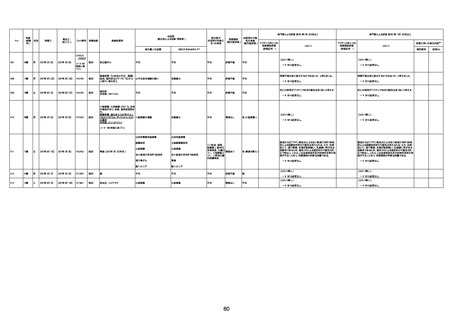
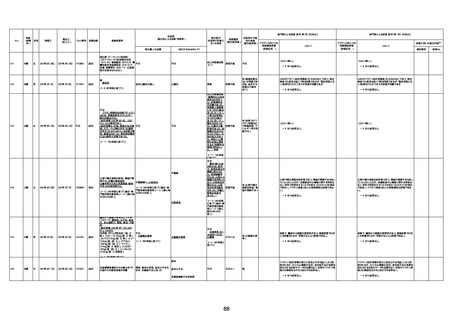
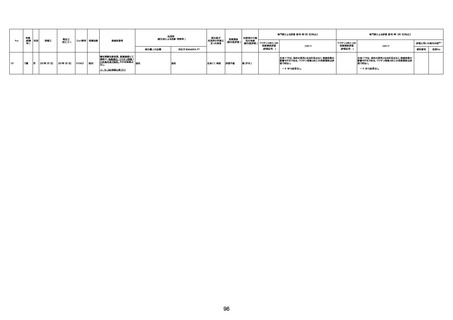
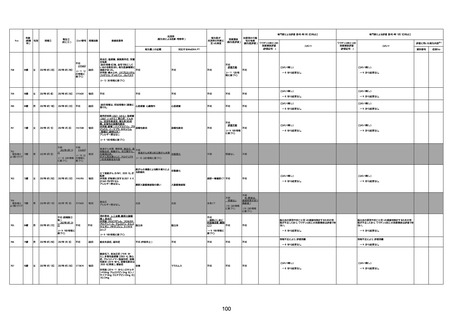
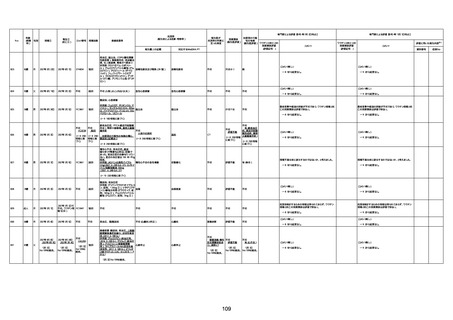
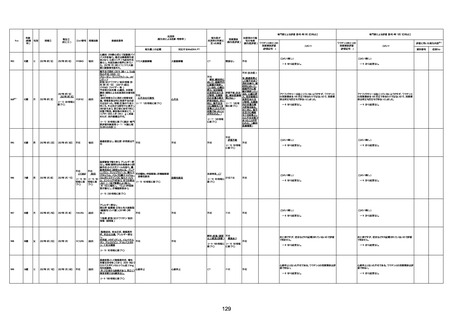
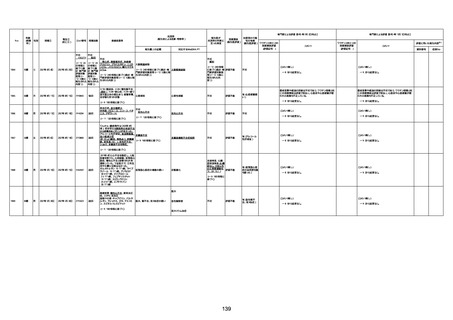
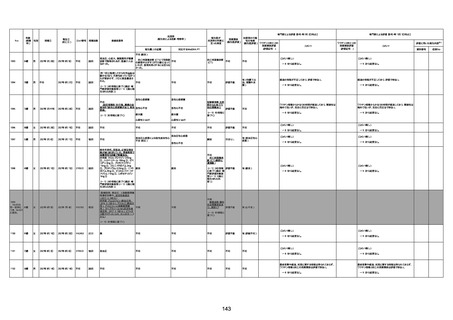
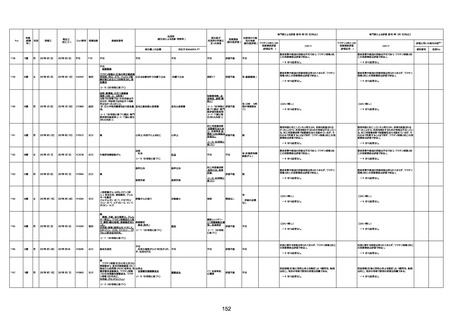
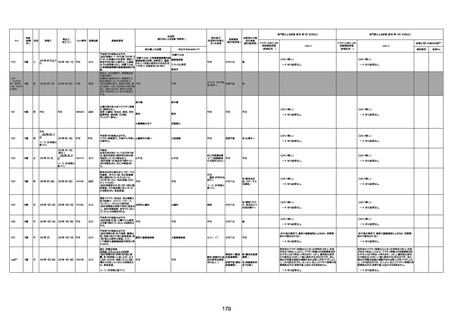
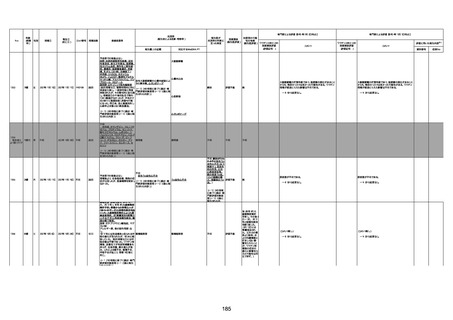
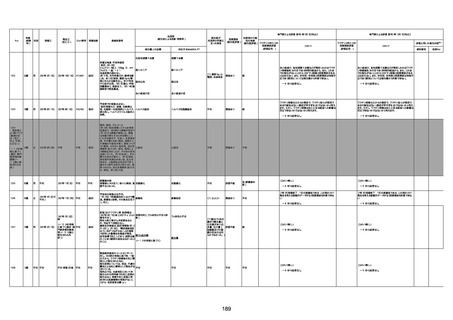
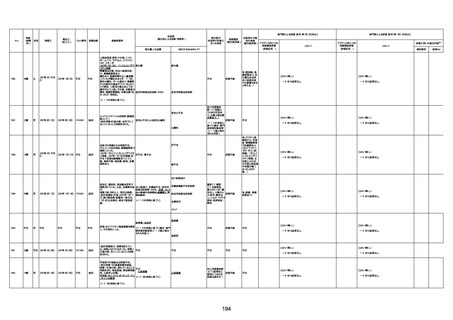
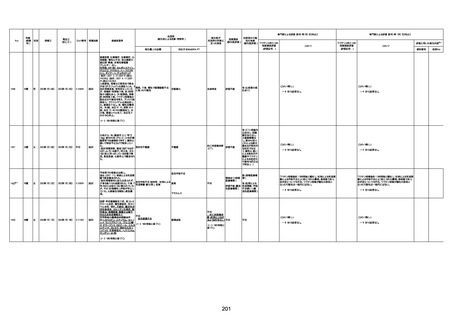
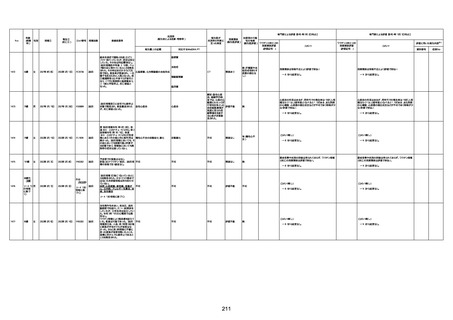
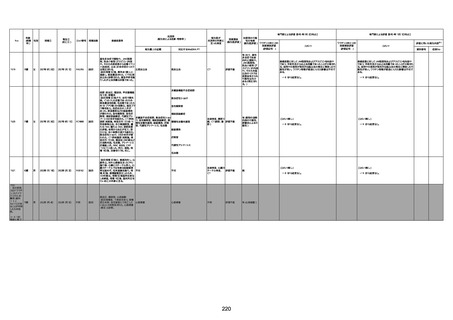
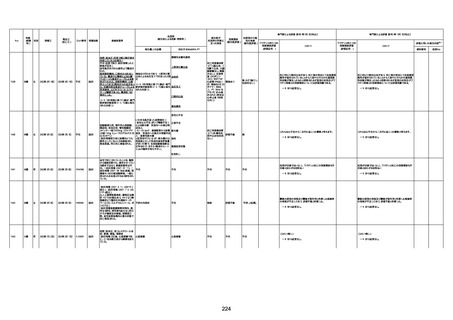
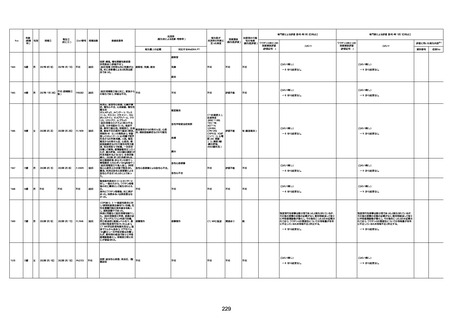
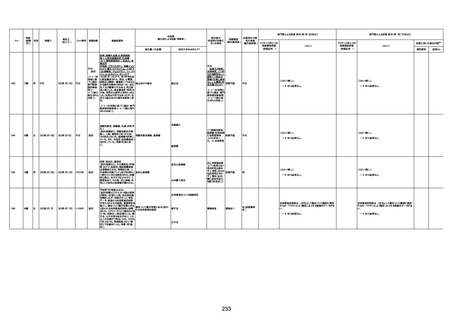
1731
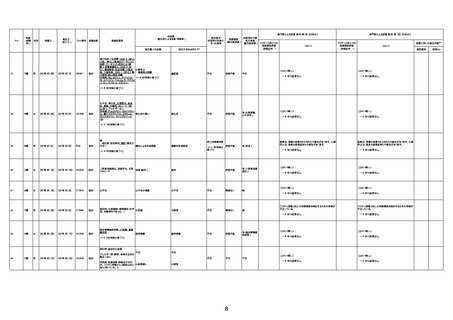
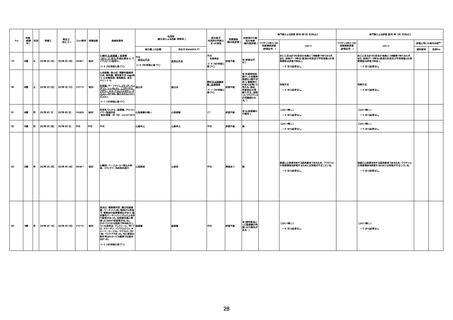
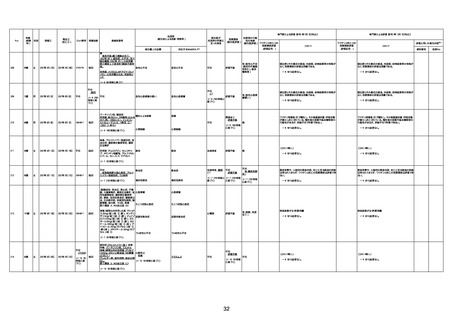
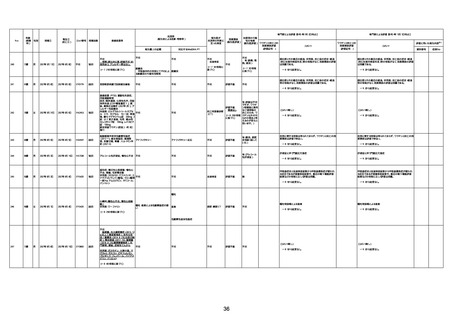
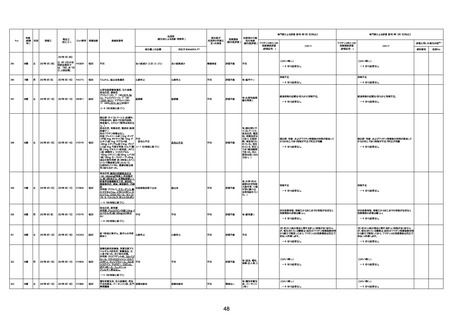
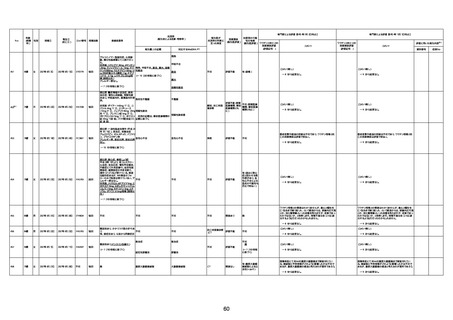
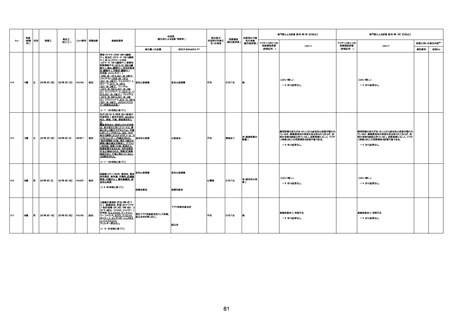
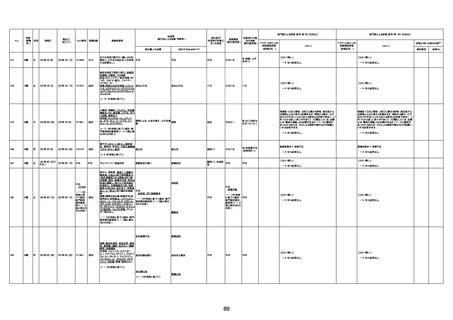
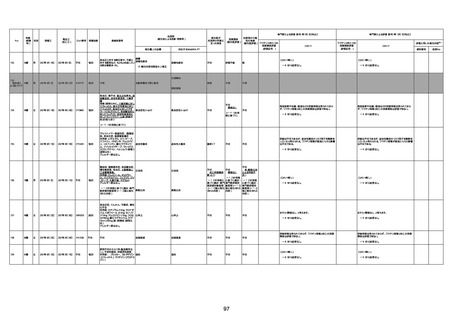
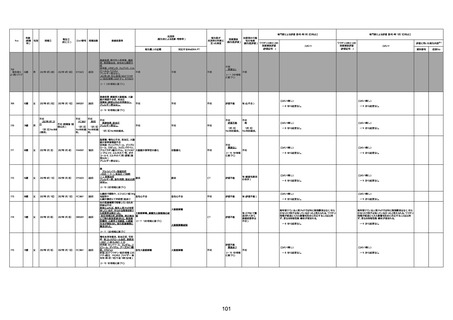
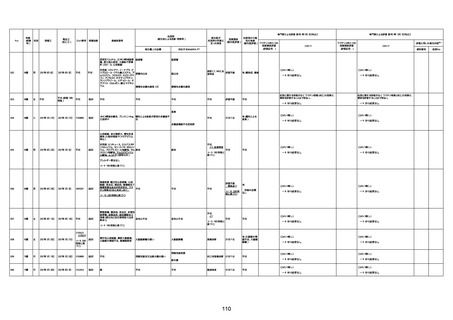
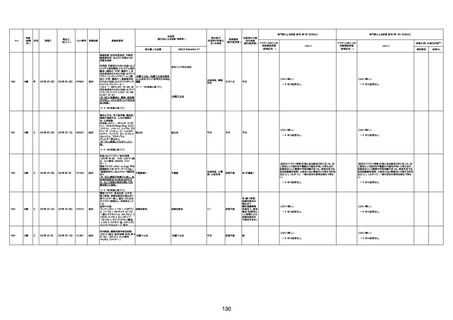
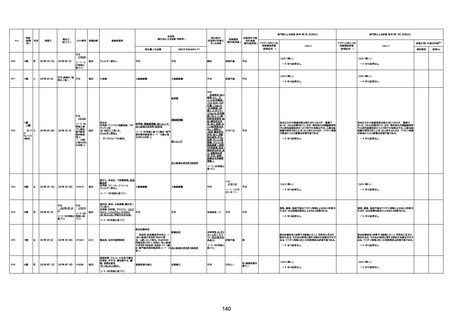
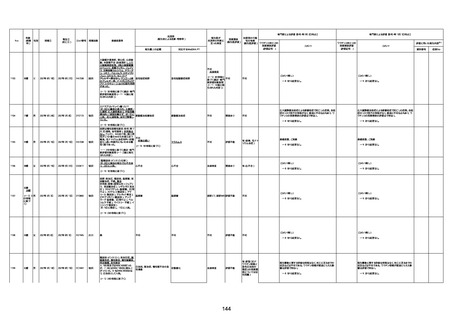
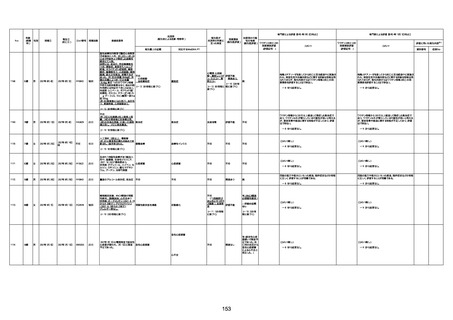
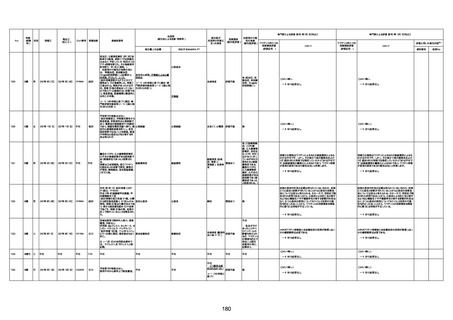
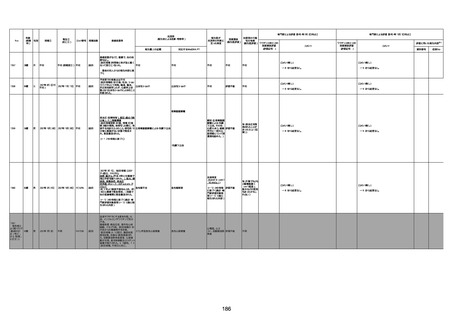
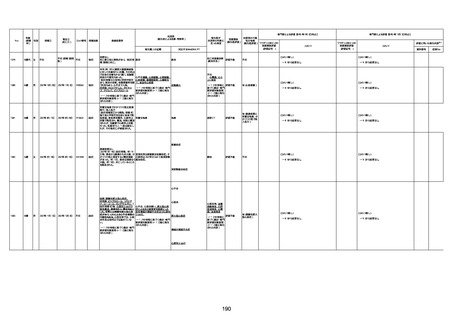
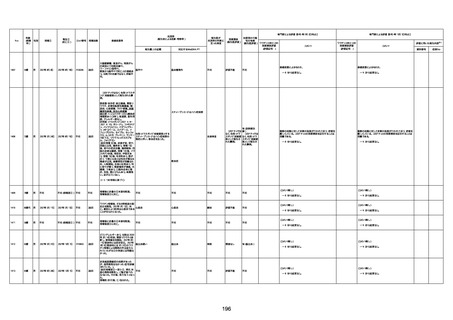
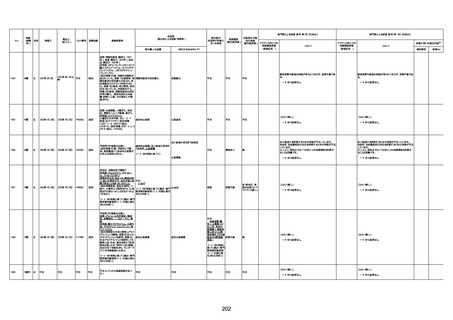
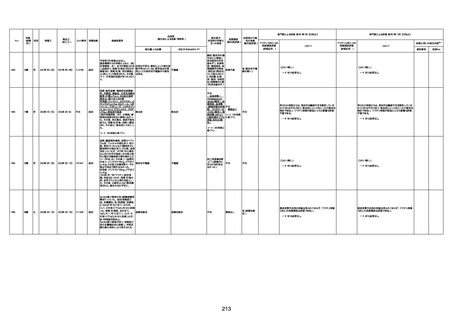
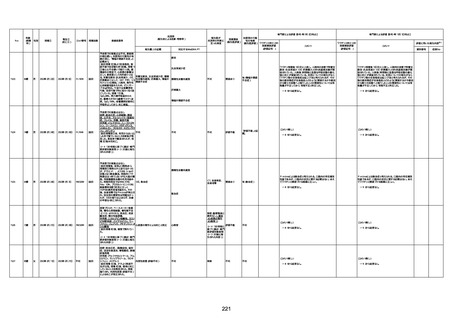
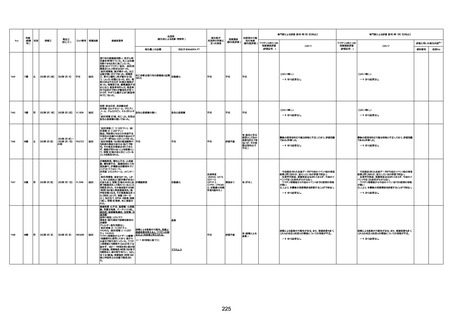
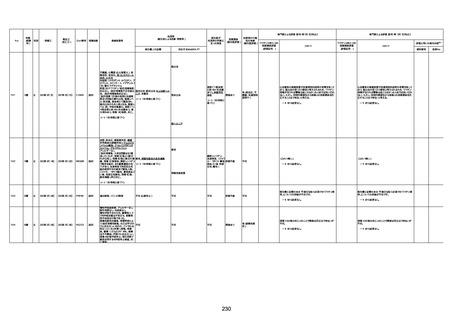
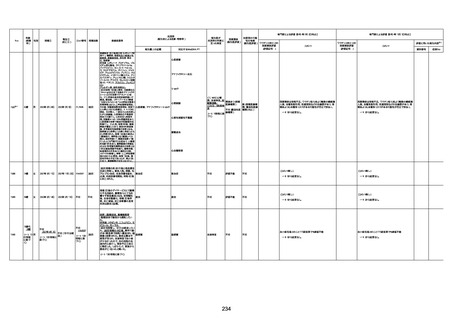
1732
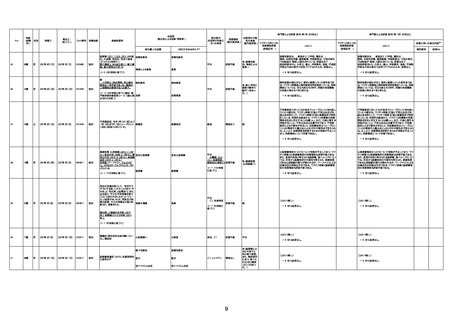
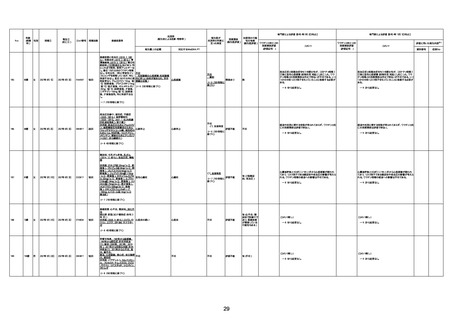
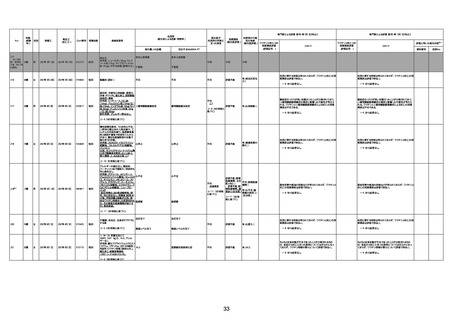
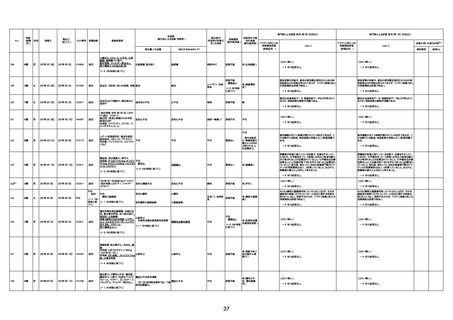
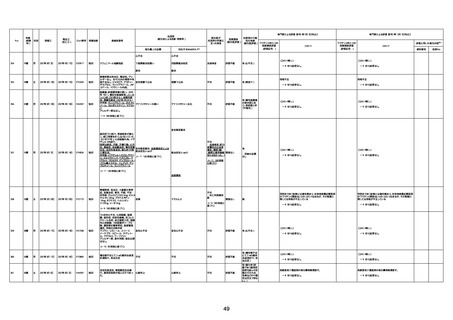
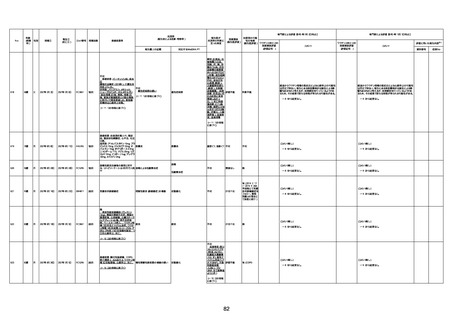
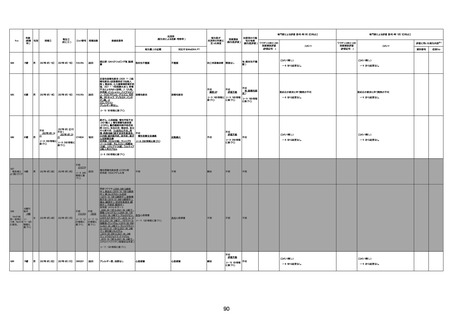
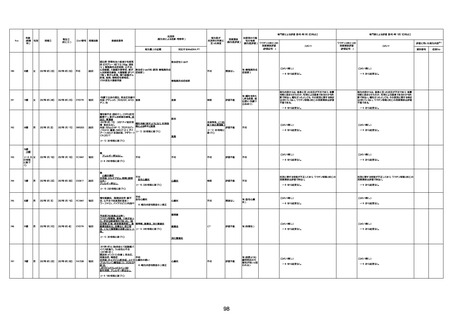
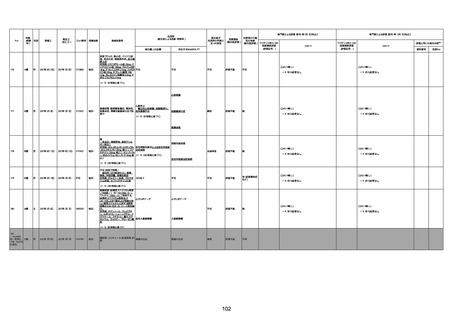
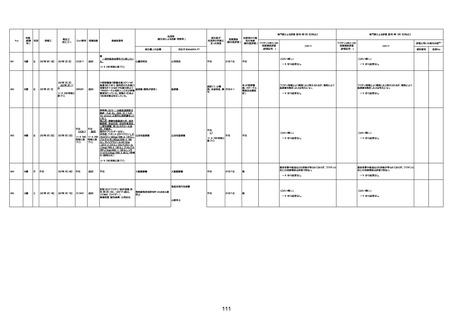
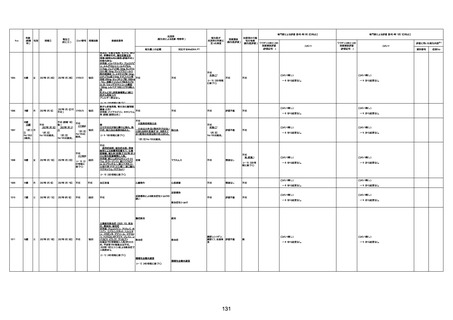
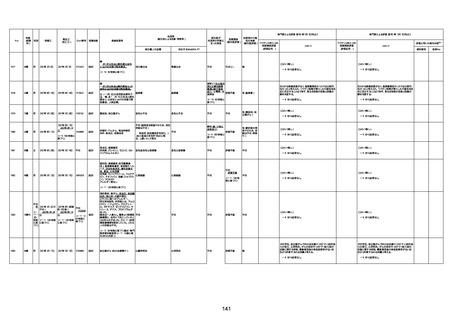
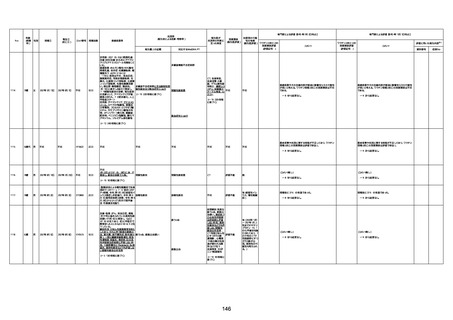
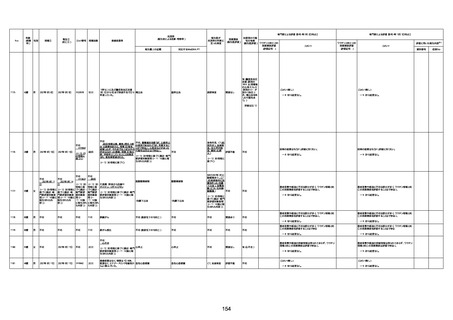
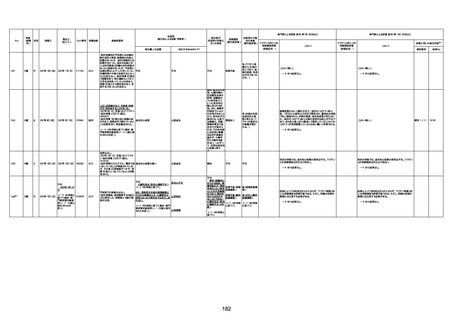
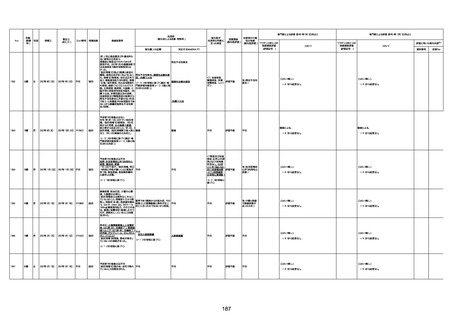
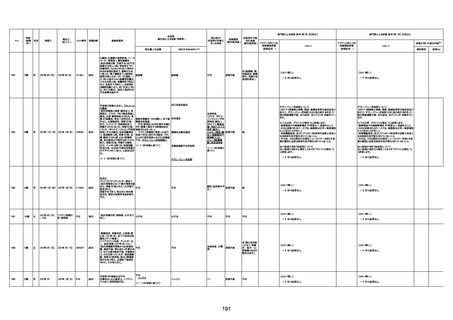
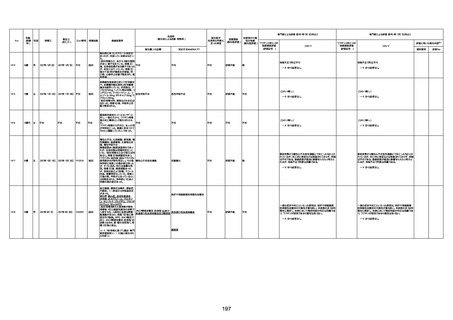
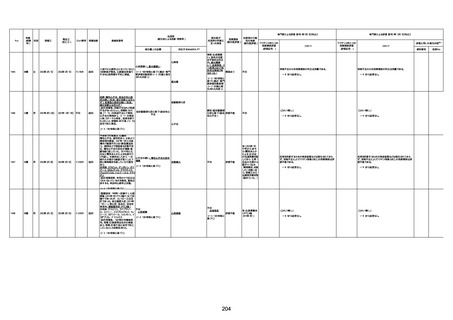
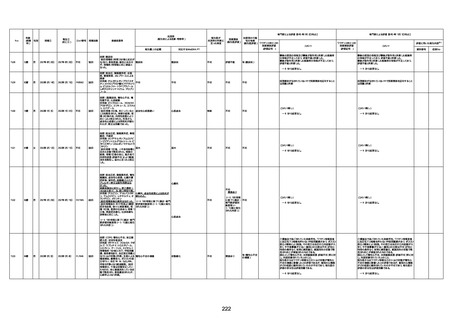
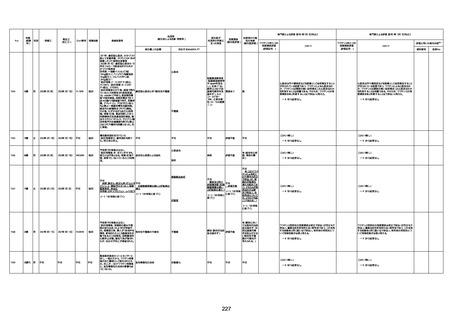
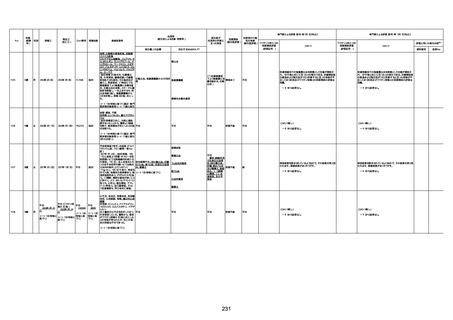
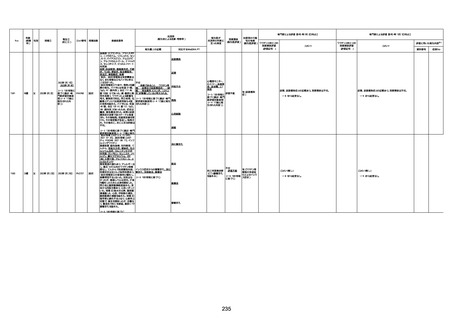
1733
82歳
94歳
89歳
73歳
男
女
女
男
2022年9月14日
2022年7月12日
2022年8月31日
2022年9月9日
2022年9月15日
2022年7月12日
2022年9月11日
2022年9月14日
FW 0547
FM7534
FP8544
FW0547
専門家による評価【令和4年9月2日時点】
報告医が
死因等の判断に
至った検査
因果関係
(報告医評価)
他要因の可能
性の有無
(報告医評価)
対応するMedDRA PT
ワクチンと死亡との
因果関係評価
★
(評価記号 )
コメント
専門家による評価【令和4年10月7日時点】
ワクチンと死亡との
因果関係評価
★
(評価記号 )
コメント
評価に用いた報告内容
資料番号
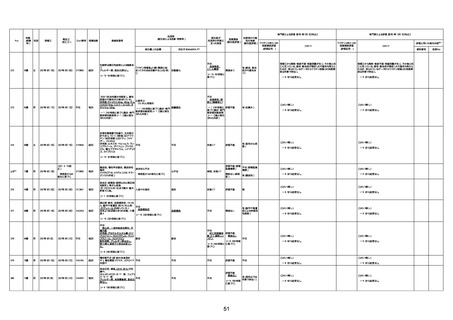
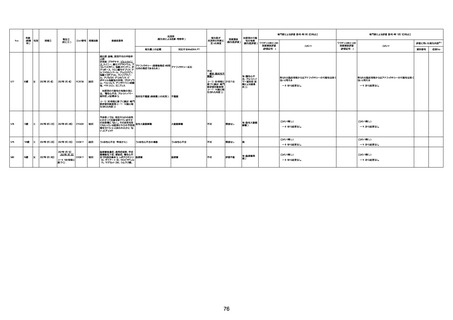
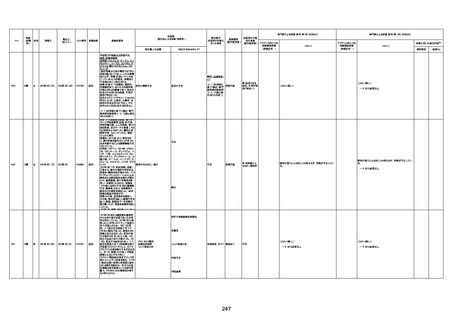
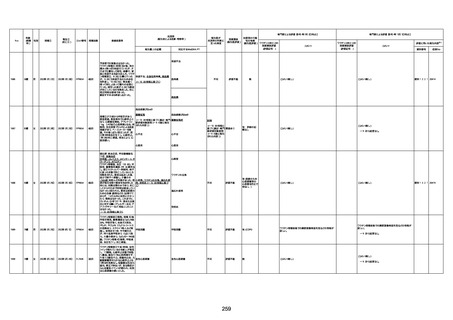
4回目
予診票:高血圧で通院中。
接種日の予約時間に独歩、杖あり
で来院。体温36.1度。問診では体調
は普段通りとのことであった。前回
まで3回の接種でも問題なかったと 不明
のこと。接種後の観察を終え、独歩
で帰宅。接種の翌日に自宅で死亡
したとの連絡が接種翌々日に警察
から受けた。
不明
不明
評価不能
不明
-
-
-
評価中
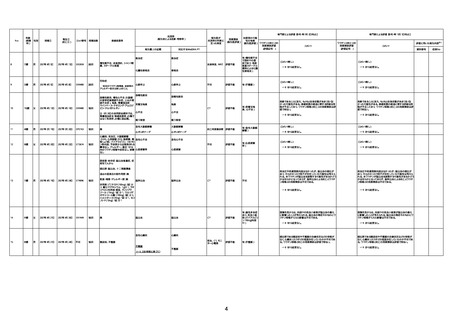
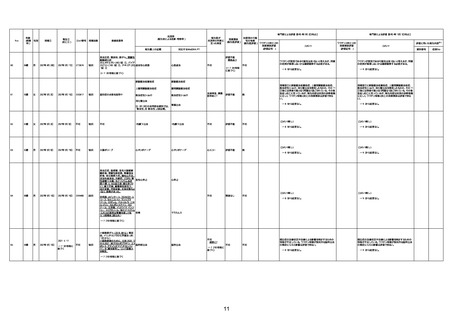
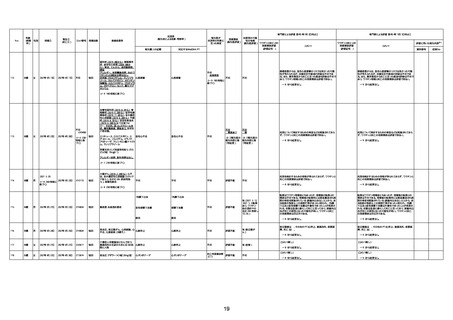
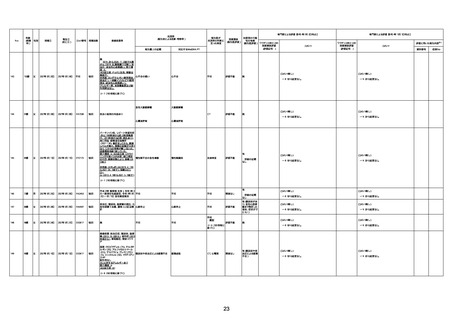
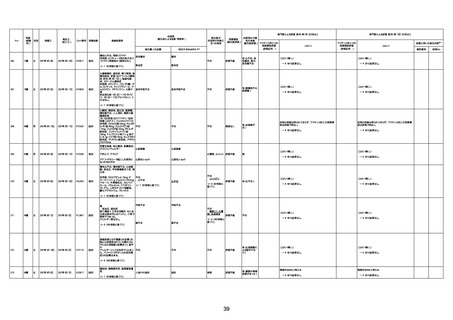
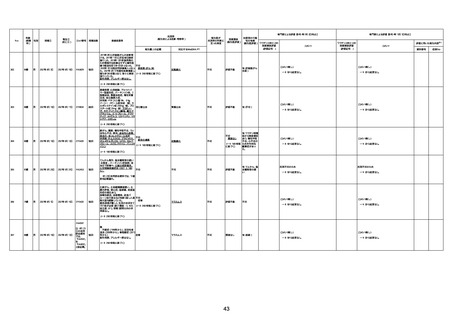
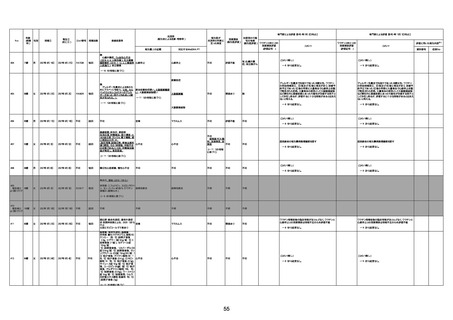
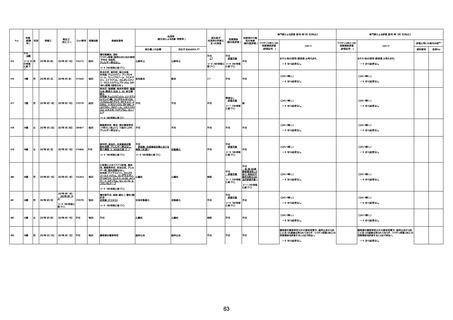
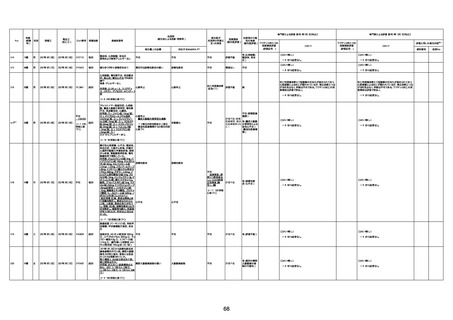
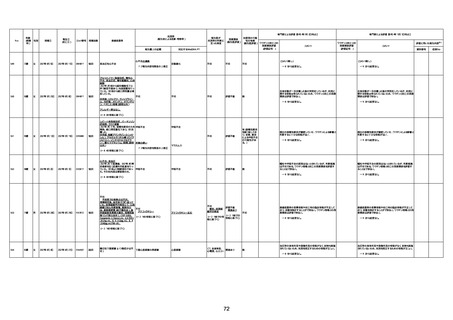
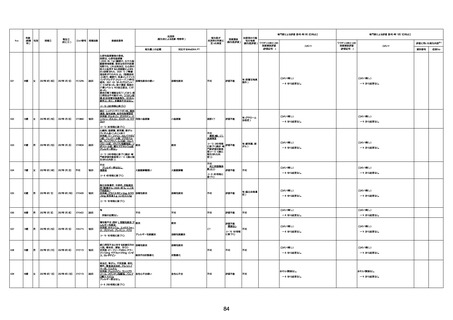
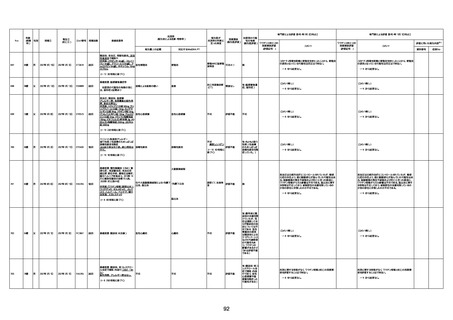
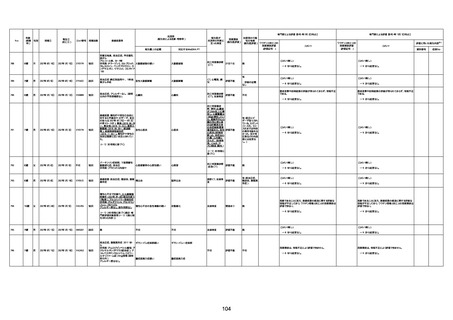
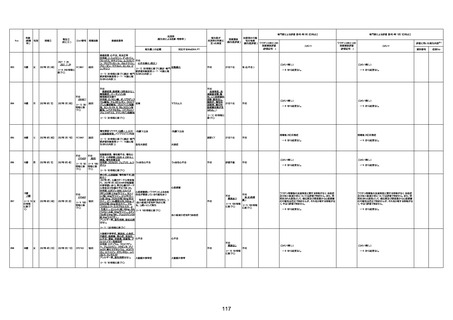
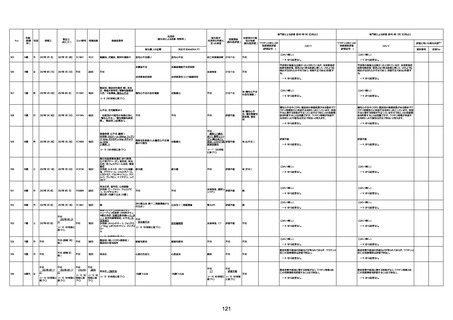
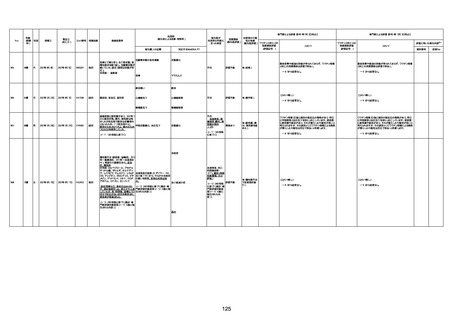
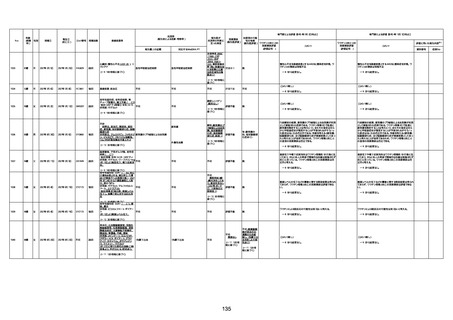
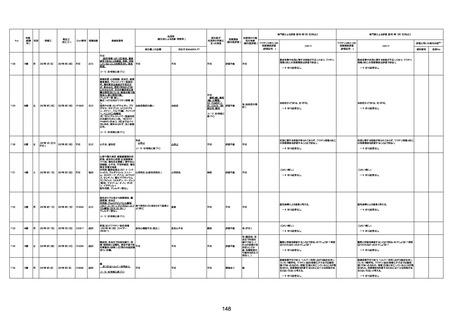
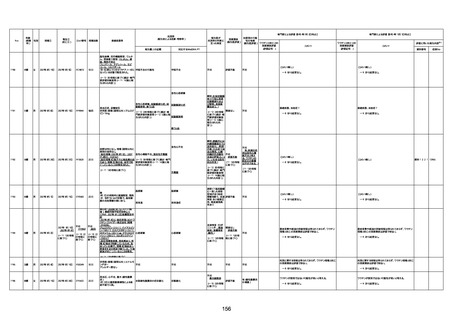
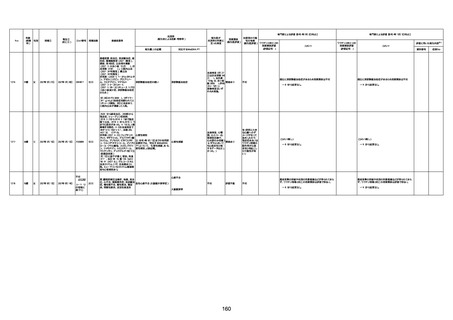
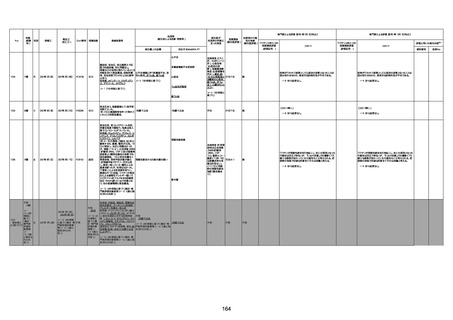
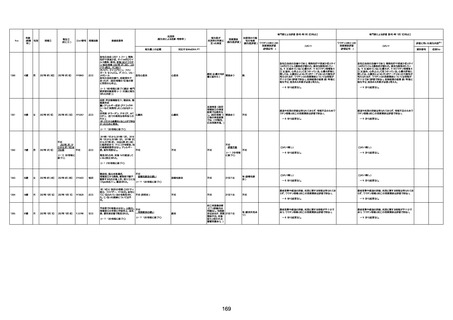
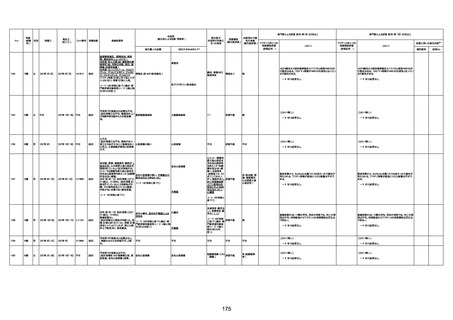
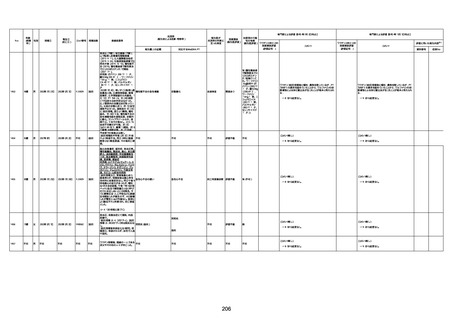
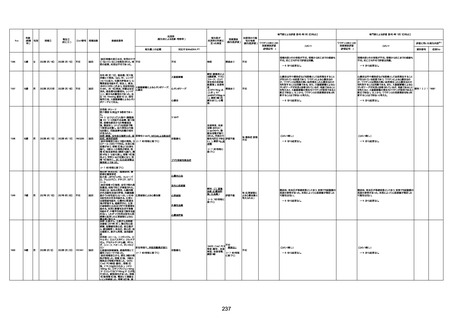
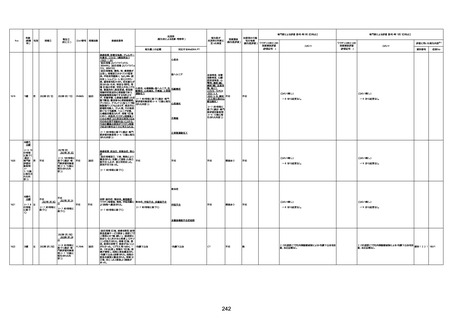
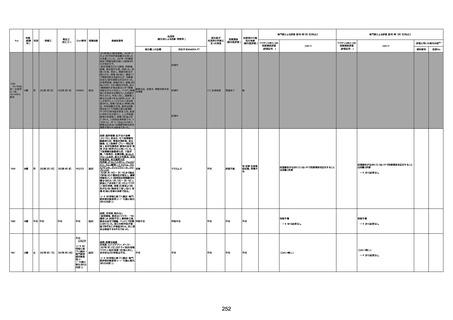
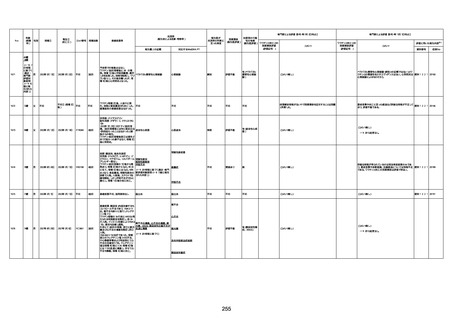
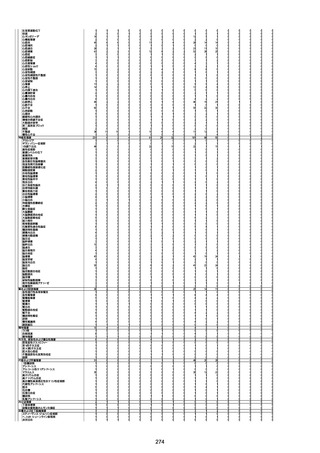
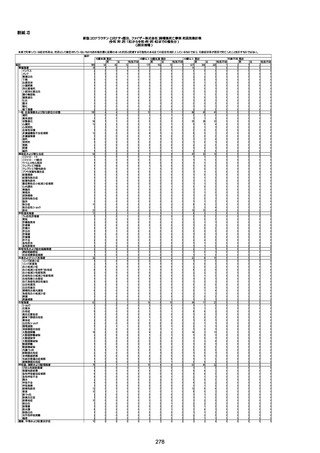
4回目
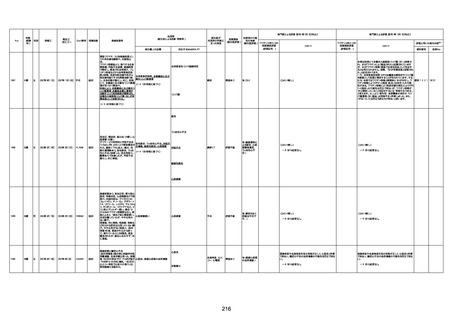
基礎疾患:高血圧、骨粗鬆症、腹部
大動脈瘤・両側総腸骨・内腸骨動脈
瘤手術後、甲状腺機能低下症、うつ
病
処方薬:カンデサルタン(8)、アムロ
ジピン(2.5)、フロセミド(20)、バイアス
ピリン(100)、ワンアルファ(0.5)、ラペ
プラゾール(10)、モーラステープ
(20)、サインバルタ(20)、エビリファイ
(6)、入糖、ミルタザピン(15)、ラコー
ルNF200ml。メチコパール注(500µg)
1回/5週。
経過:午前10時ワクチンを予約接
種。午後4時ころから38度の発熱、
頭痛出現。家族に連れられ来院。
血圧140/82、SpO2 99%、脈拍110/
急性心筋梗塞
分。胸部XPは肺炎像なし。解熱目
的でロキソプロフェイン8回分(1回
(60))を処方し帰宅。帰宅中の車内
で吐き気があり、車外へ降りられ
ず、20〜30分ほど車内に留まり休
憩。その後、車外へ出たが歩行でき
ず30分ほど椅子に座っていた。2〜
3歩歩き、嘔吐。さらに数歩歩いて
再度嘔吐し倒れる。救急車を要請。
救急車内で心停止し、心臓マッサー
ジ。除細動等蘇生術を受けながら病
院到着。病院で数回心室細動にな
り除細動等蘇生術を繰り返すも回
復せず死亡。同病院で死後のCT所
見及び発症後の経過から、急性心
筋梗塞による死亡と診断された。
急性心筋梗塞
CT
評価不能
有(急性心筋梗
塞)
-
-
-
評価中
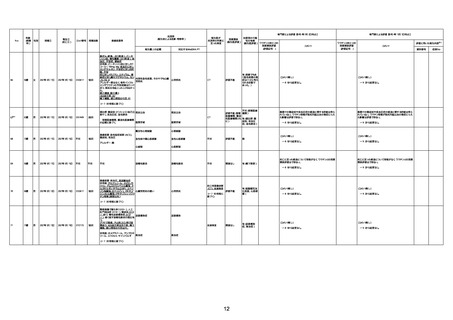
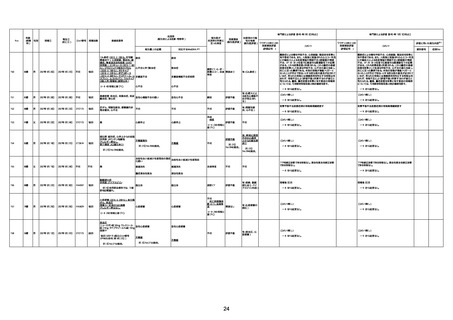
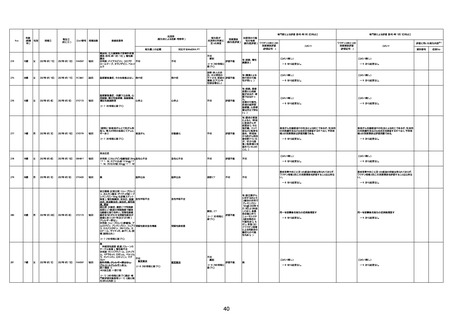
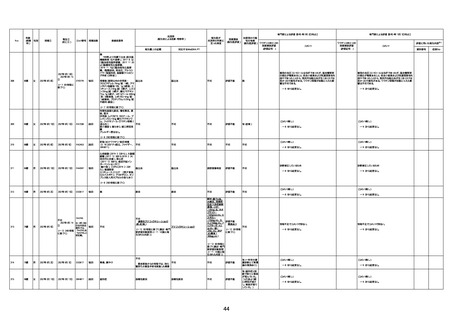
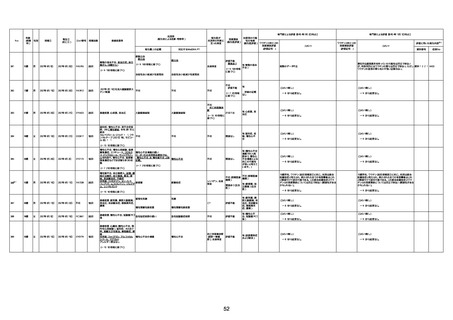
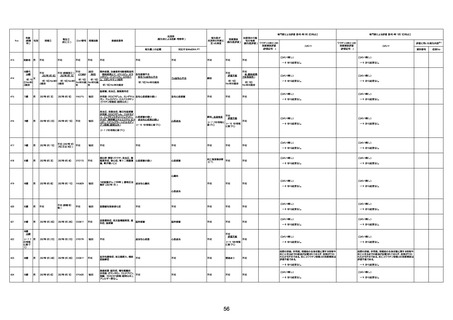
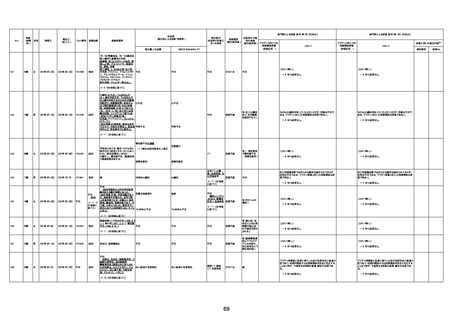
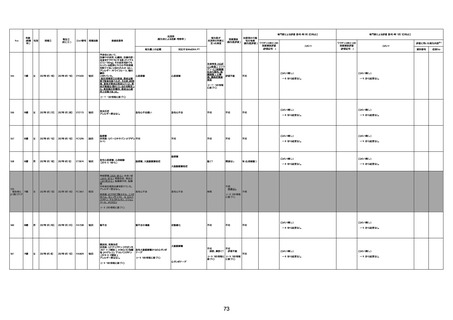
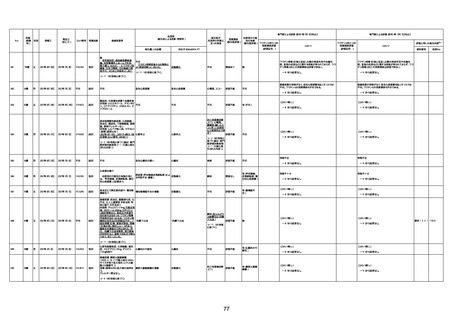
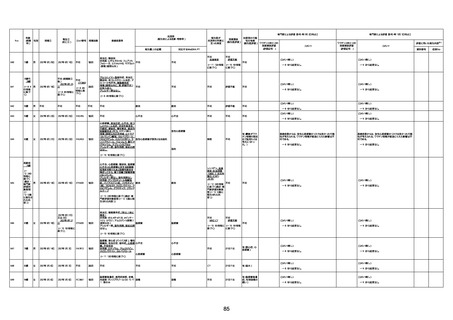
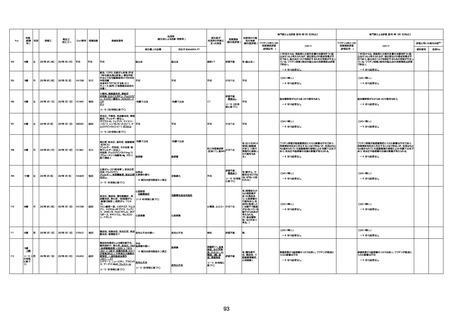
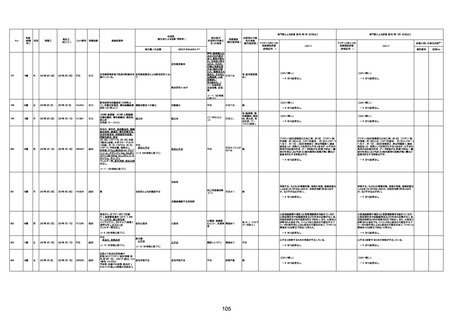
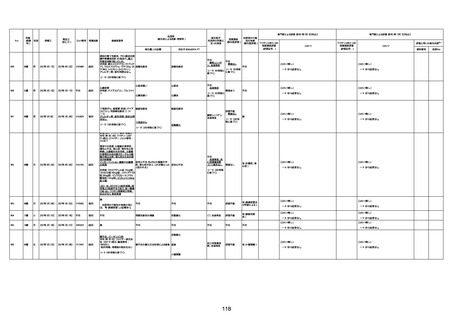
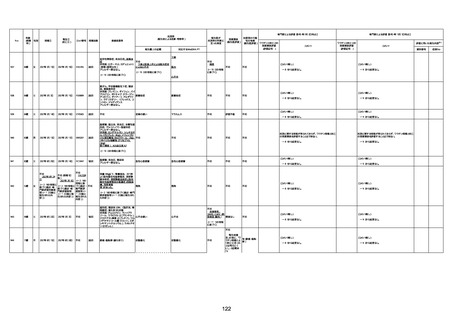
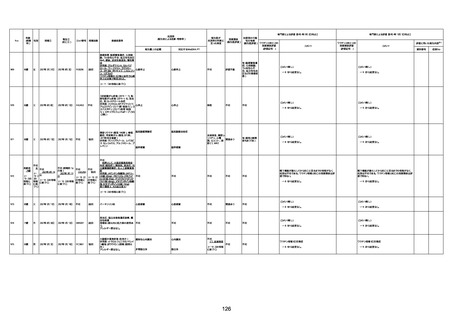
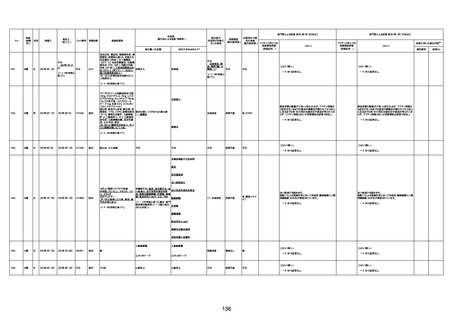
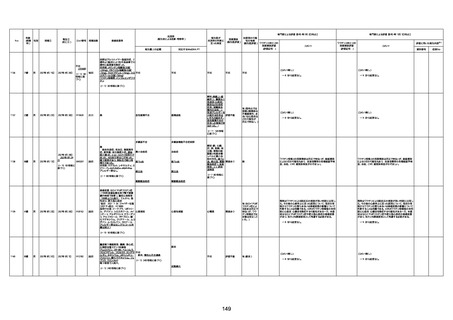
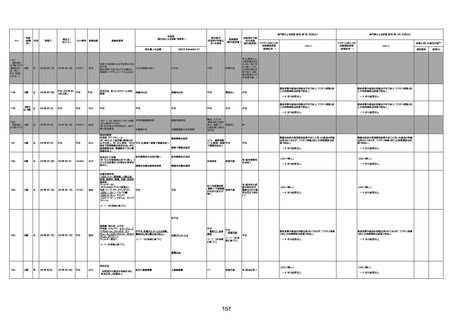
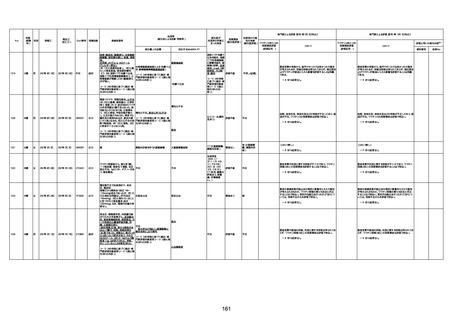
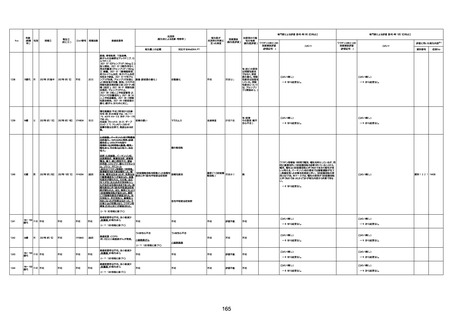
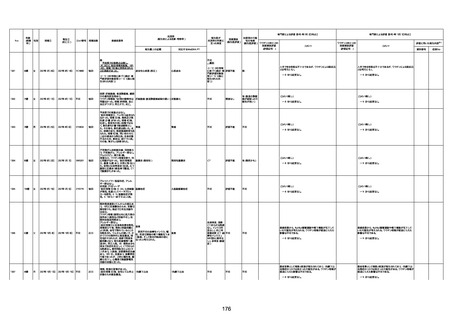
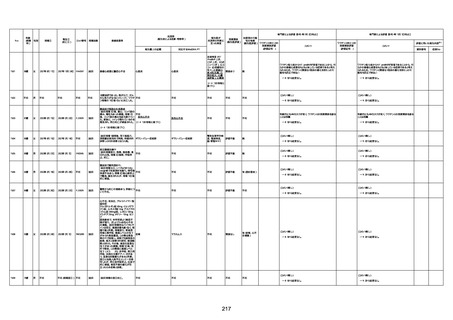
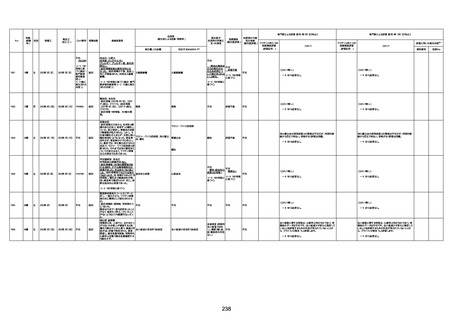
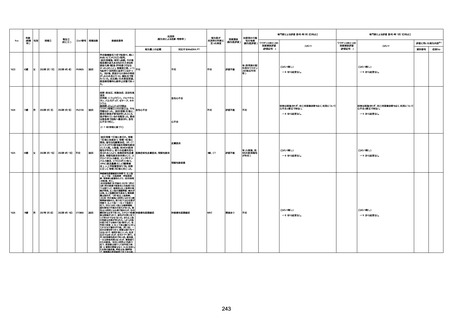
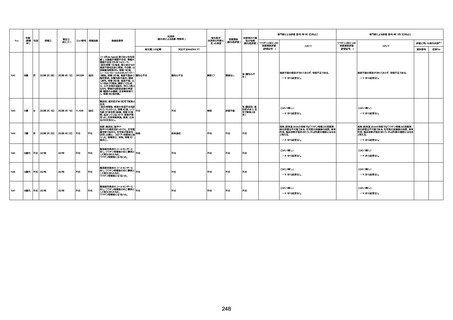
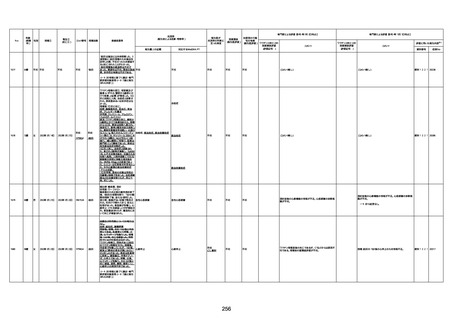
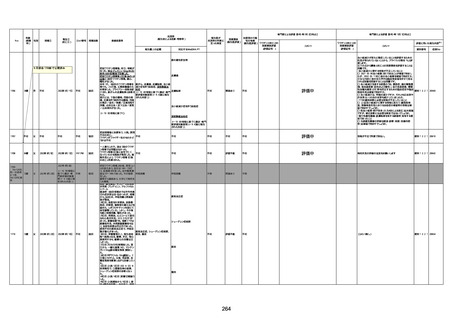
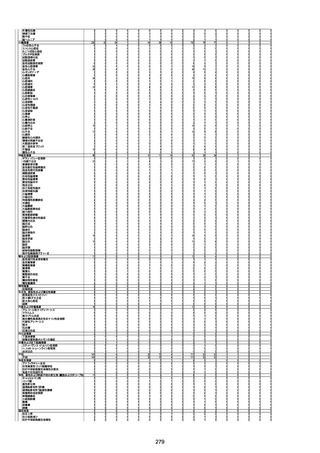
間質性肺疾患
CT
評価不能
有(薬剤性間質
性肺炎)
-
-
-
評価中
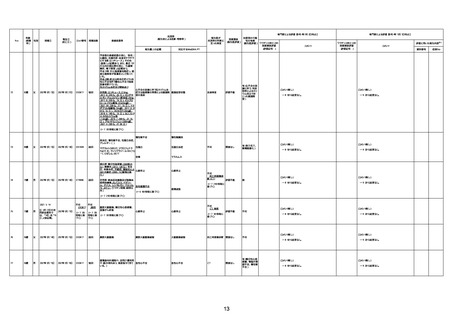
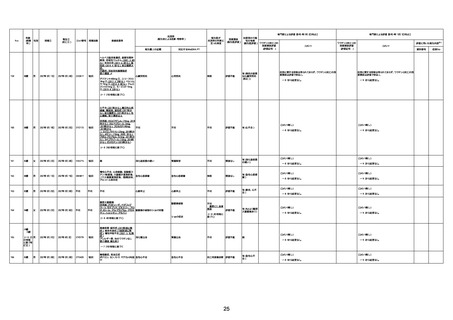
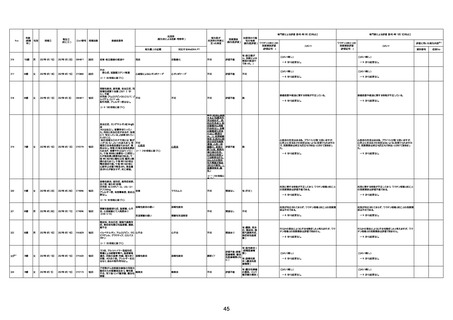
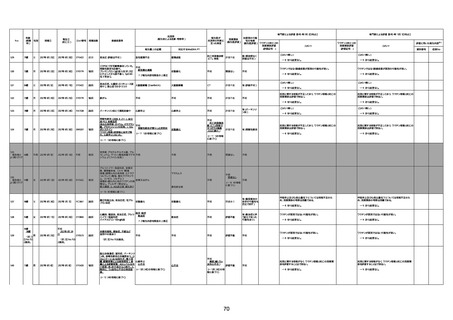
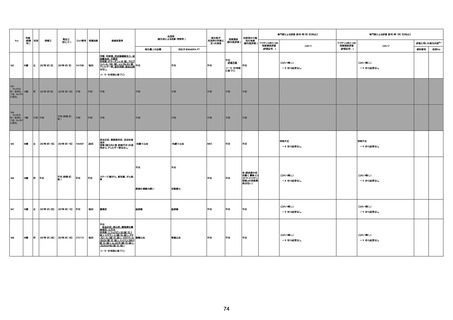
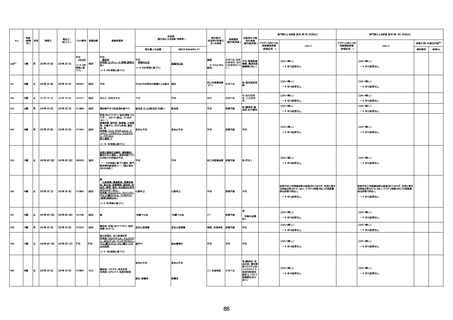
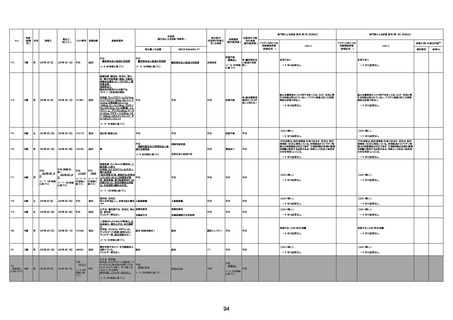
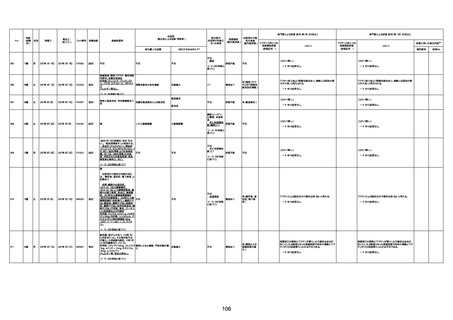
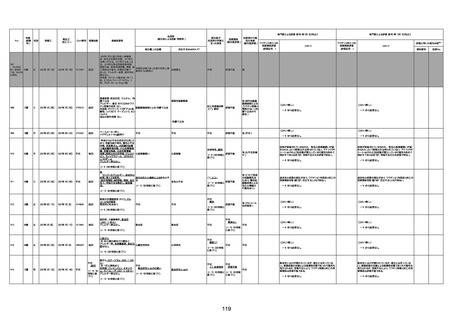
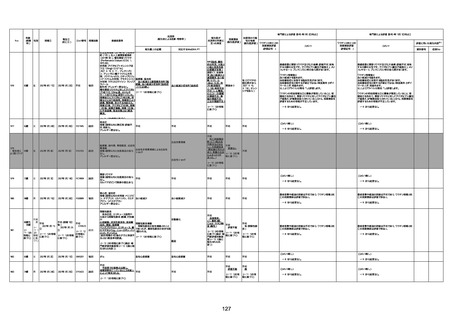
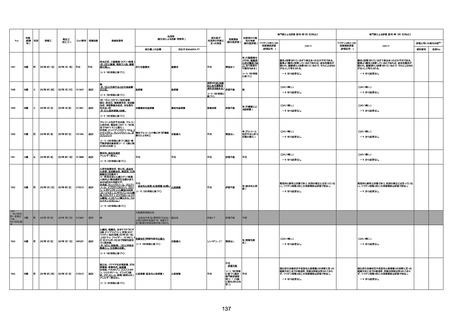
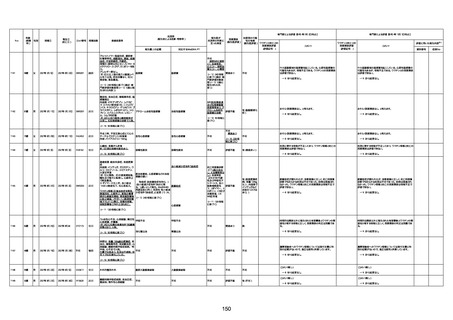
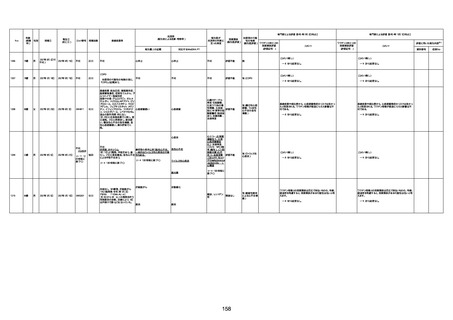
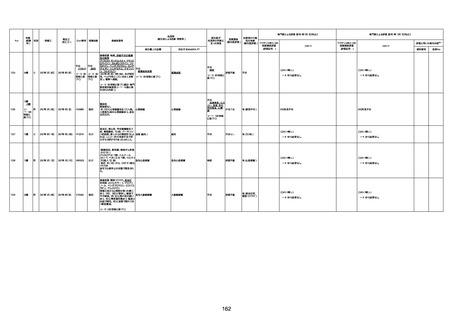
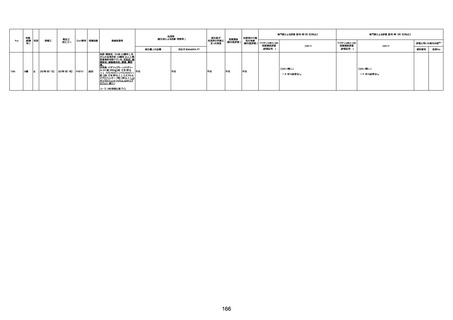
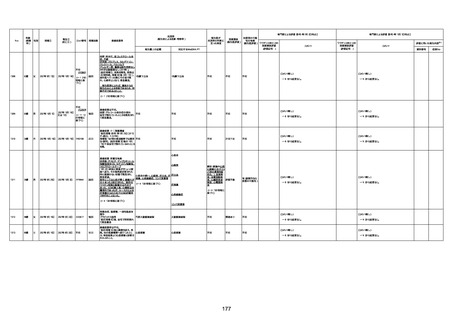
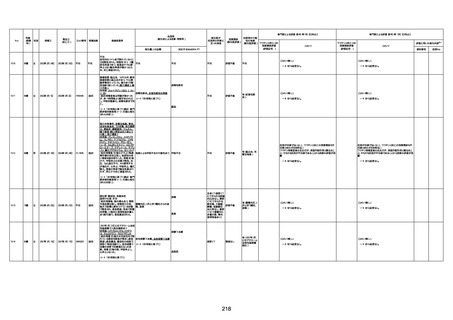
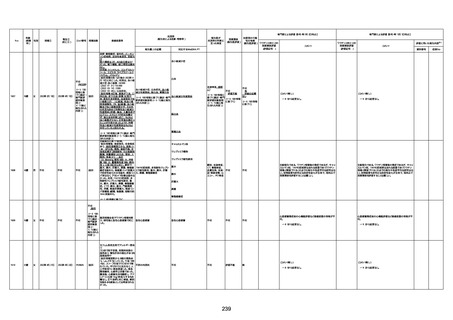
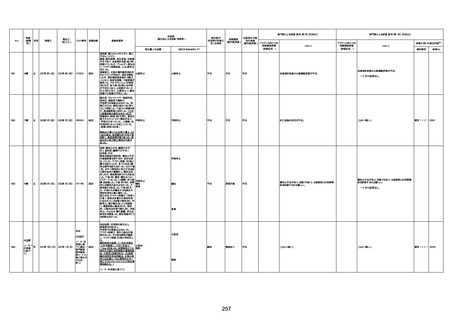
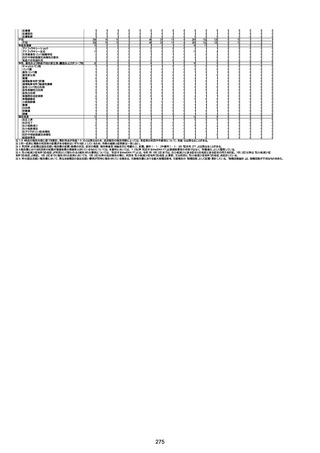
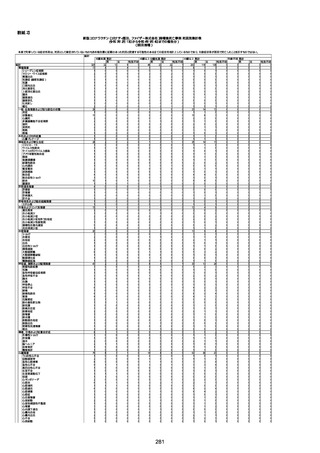
不明
不明
不明
不明
-
-
-
評価中
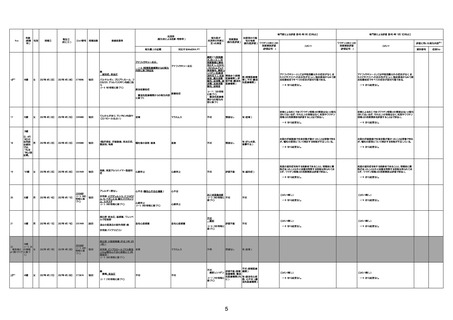
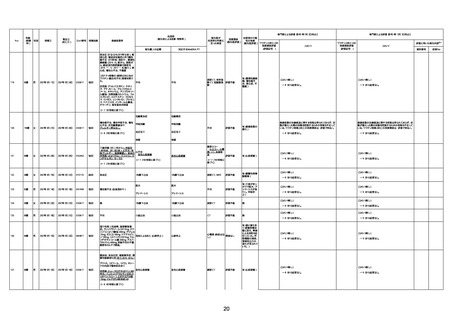
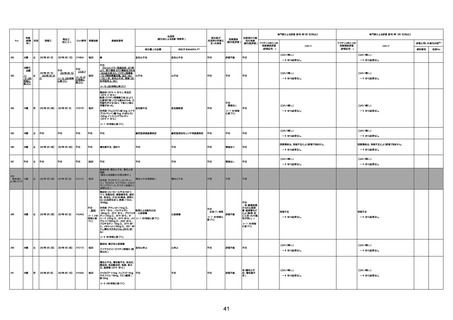
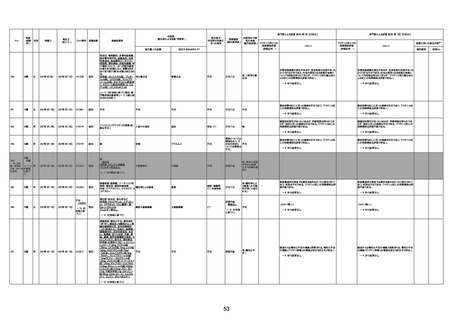
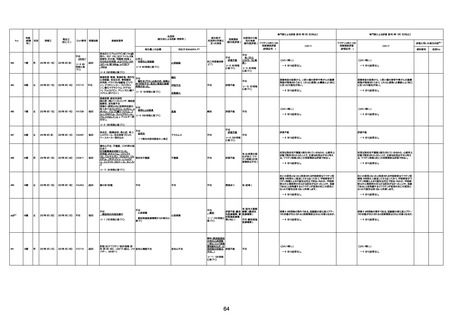
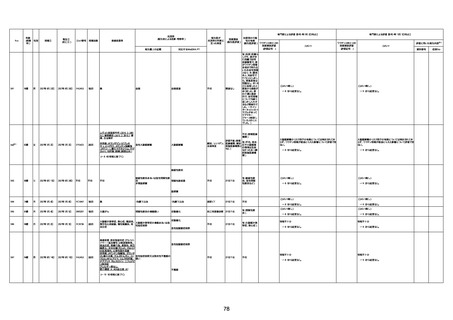
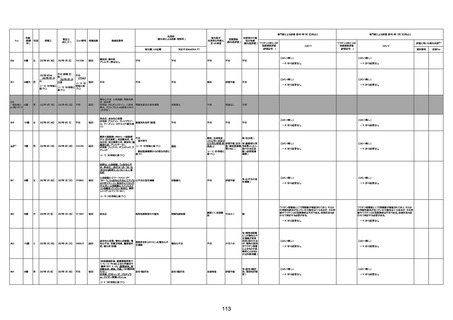
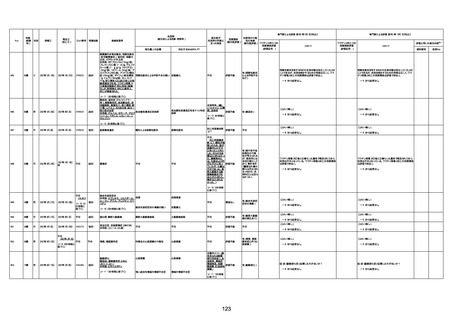
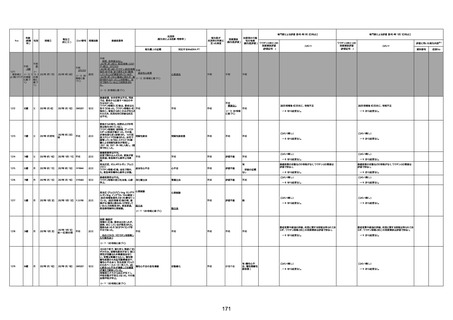
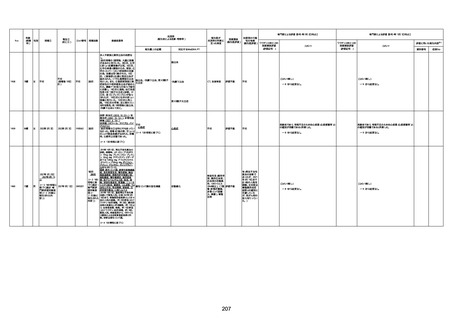
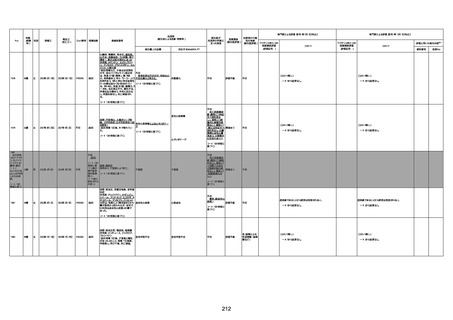
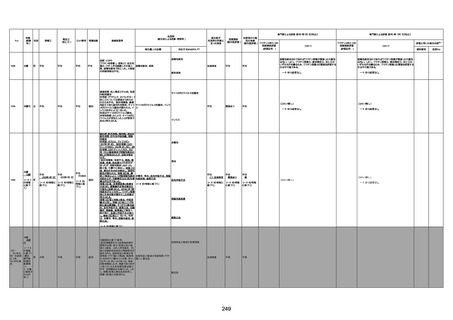
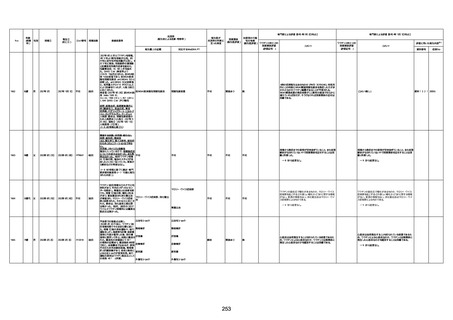
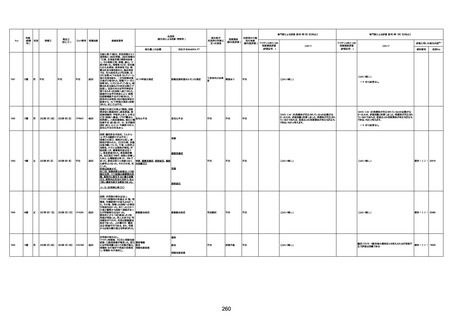
4回目
4回目
基礎疾患:進行性核上麻痺・パーキ
ンソン病・甲状腺機能低下症と加齢
によるフレイル進行
経過等:接種前の体温36.6度。在宅
訪問診療にて健康管理している状
況。接種8日目に強い呻吟と微熱
(37.9度)発生。往診にて診察、両肺
に乾性ラ音、SpO2 80〜85%と低
下。急性呼吸不全と診断し病院へ
救急搬送され入院となった。同病院
からの報告によると、リザーバーマ 間質性肺炎
スク10.0L/分でもSpO2 90%を維持
することが困難。CTにて両肺野びま
ん性磨りガラス陰影と牽引性気管
支拡張を伴う所見あり。KL-6 892
LDH 479U/l であった。急性間質性
肺炎によるびまん性肺胞障害と考
えられた。酸素療法・ステロイドパル
ス療法を行ったが接種から11日目
死亡と診断された。
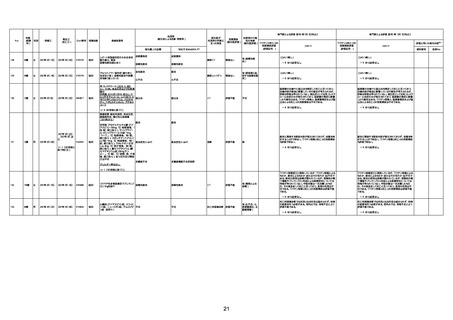
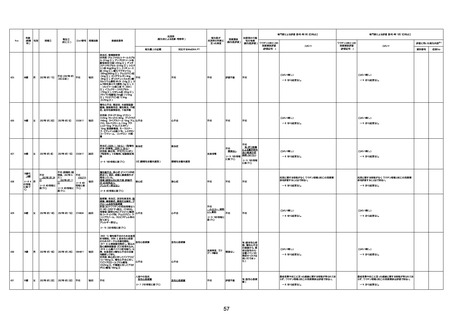
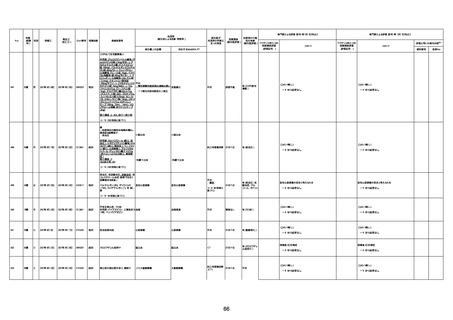
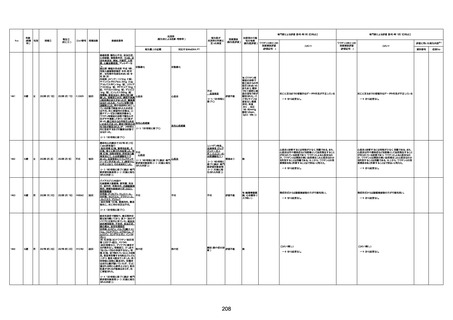
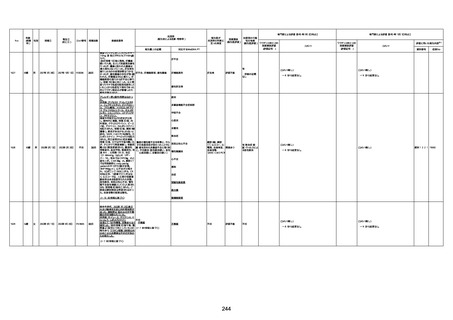
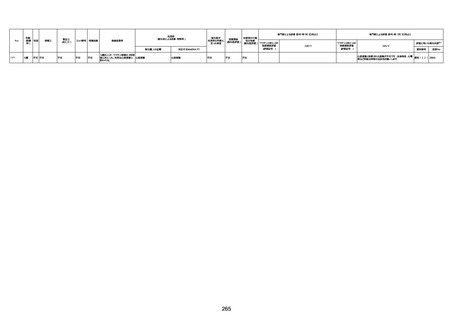
病歴:心不全、糖尿病、レビ−小体
型認知症。
併用薬:ドネペジル5mg、リスパ
ダール1mg、ジャヌビア、アスパラカ
リウム経口、アクチット点滴静注。
経過等:1日目、38.4度の熱出現。 不明
Spo2 83%。採血検査し、白血球
1960、ヘモグロビン低値。
5日目死亡。
剖検が実施されたかは報告なし。
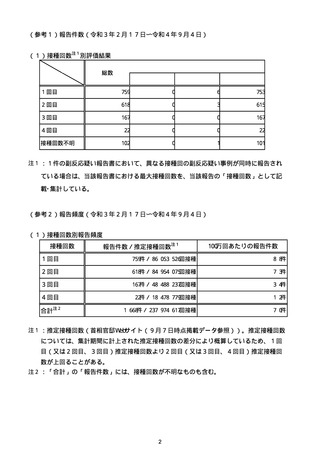
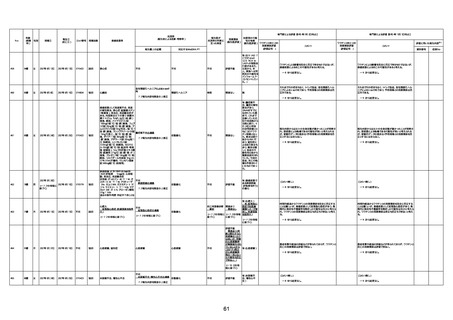
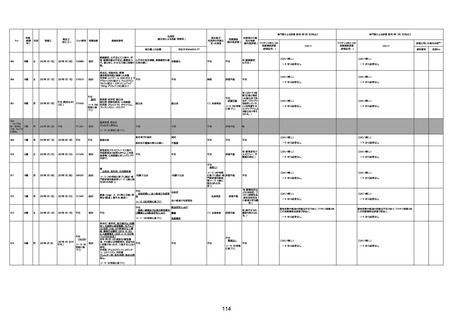
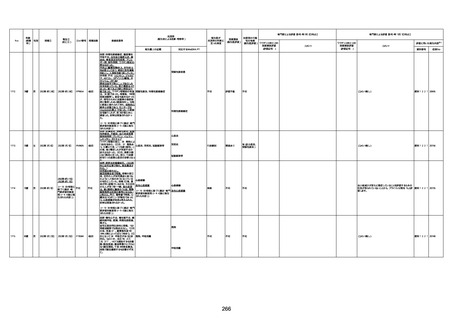
注1:各症例の記載は、令和3年2月17日〜令和4年8月19日までに、医療機関又は本ワクチンの製造販売業者から副反応疑い報告された内容に基づく。専門家による評価は、特記した場合を除き、令和4年8月7日時点の報告内容に基づき実施。
注2:直近の集計対象期間において新規又は追加報告された症例について、対応する症例Noを記入している。同一症例であっても、報告内容の更新等により医療機関又は製造販売業者から複数回報告される場合がある。同一症例について複数回報告された場合は、評価時点で最後に報告された報告内容に基づき評価している。
注3:2021年3月30日に製造販売業者から厚生労働省に一報。詳細調査の後、4月6日に副反応疑い報告がなされた。
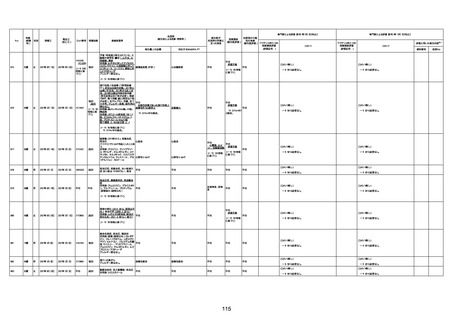
注4:接種医療機関及び搬送先医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注5:接種医療機関及び解剖実施医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注6:接種医療機関及び検視医から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注7:接種医療機関及び主治医から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注8:搬送先医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注9:主治医及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注10:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1−1−2や資料1−2−2の「症状名(PT)」とは異なることがある。
270
注2
症例No