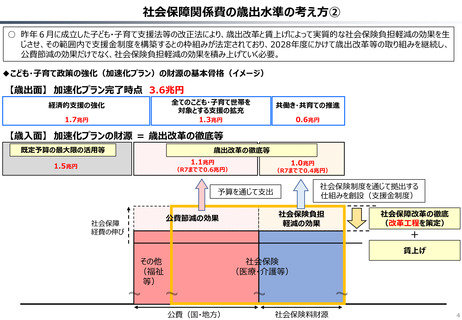
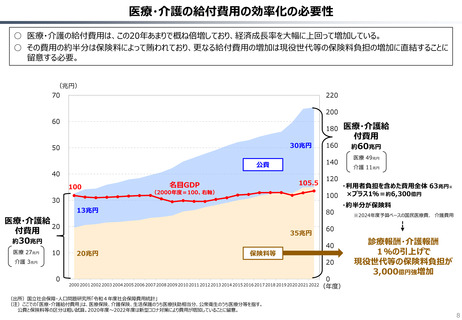
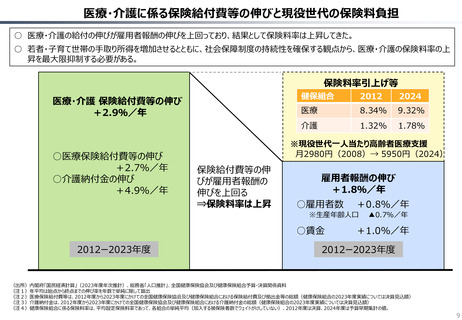
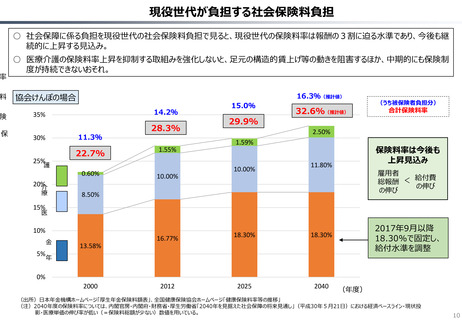
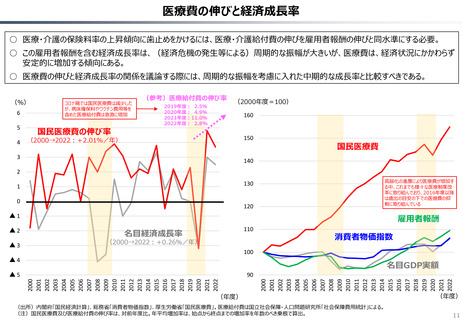
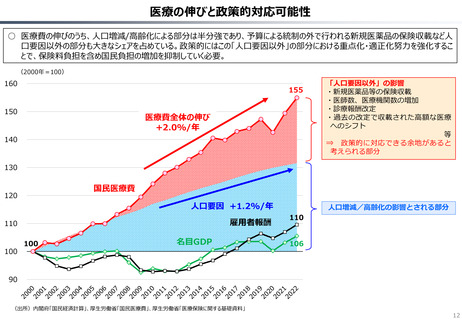
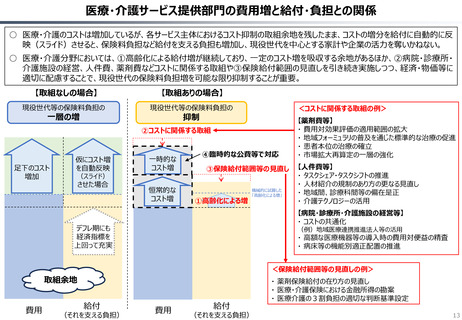
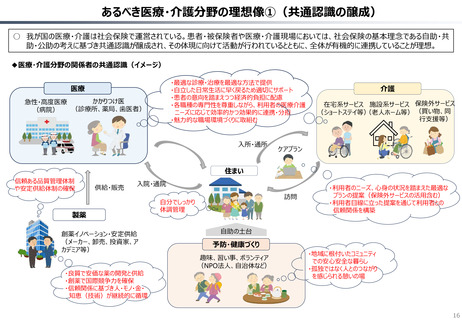
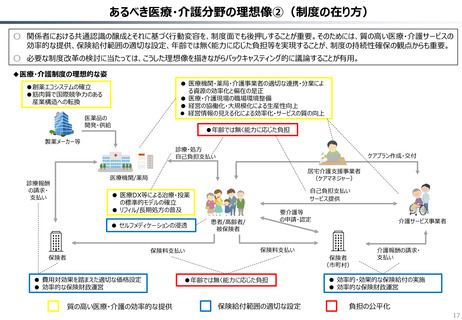
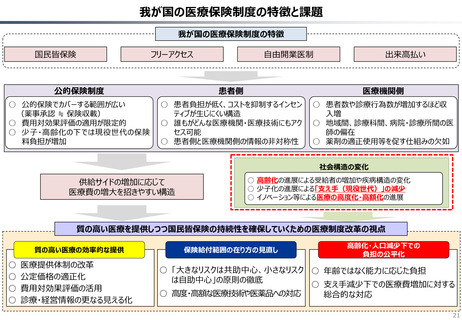
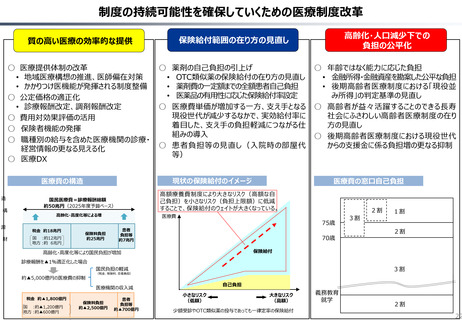
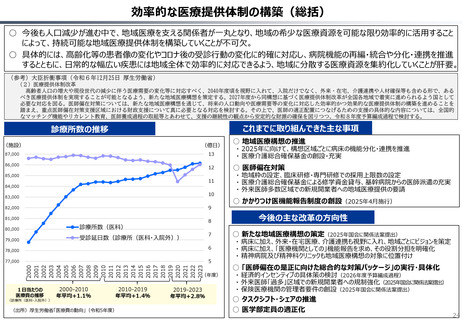
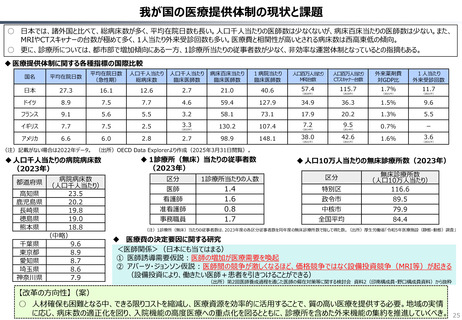
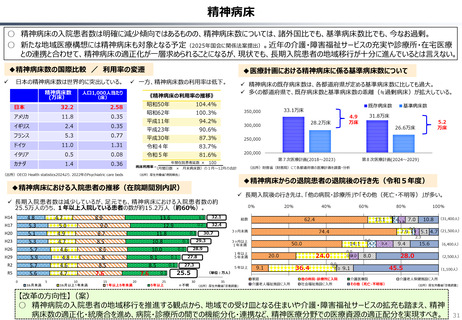
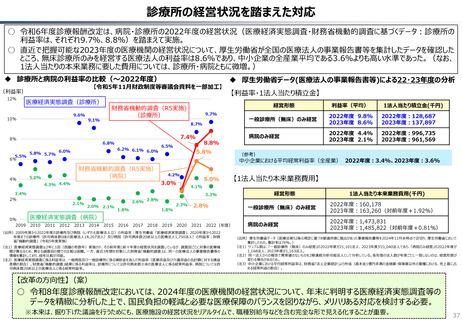
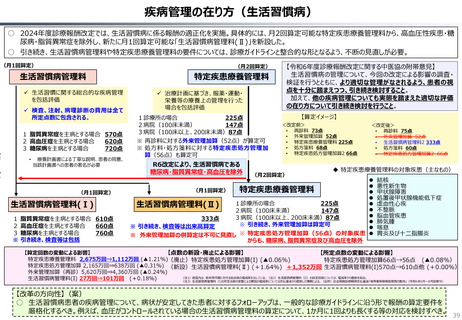
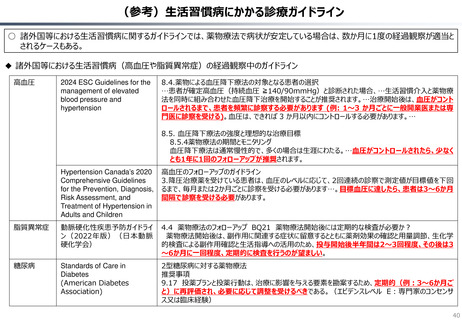
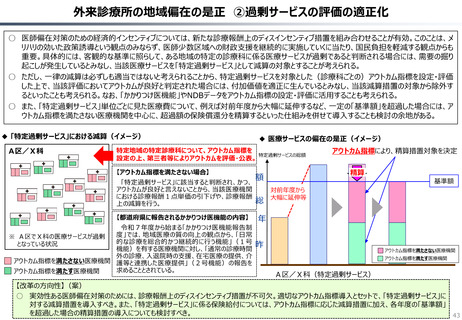
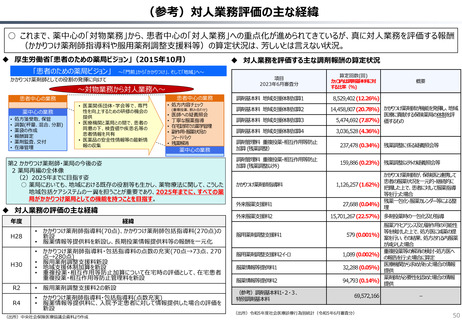
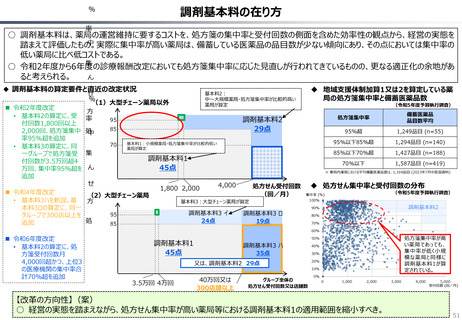
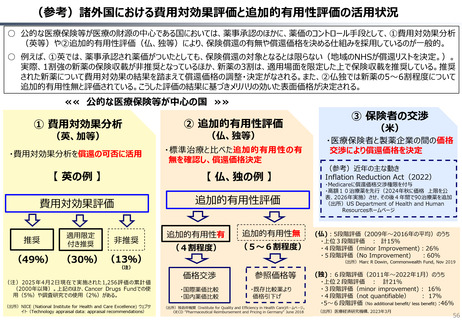
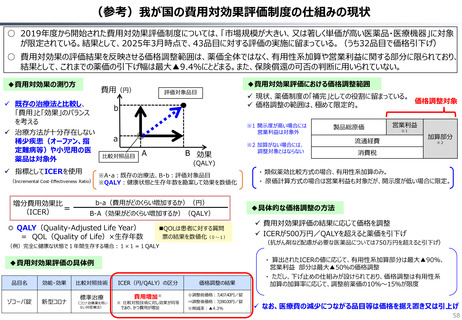
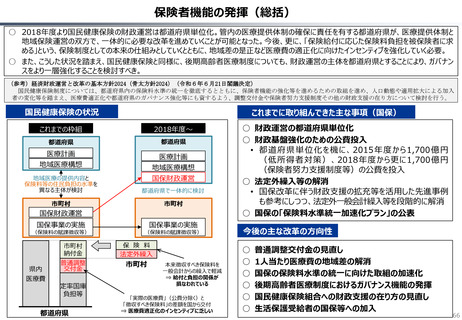
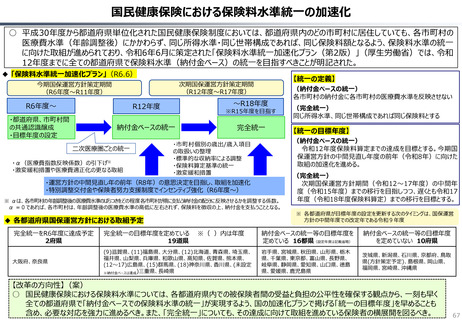
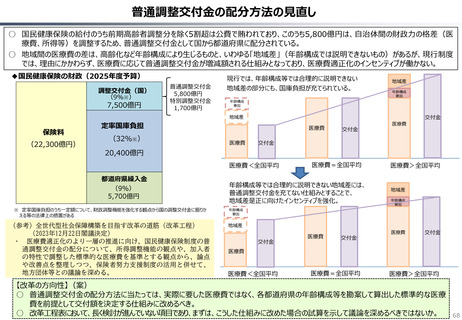
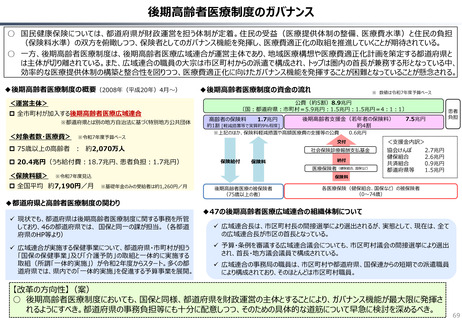
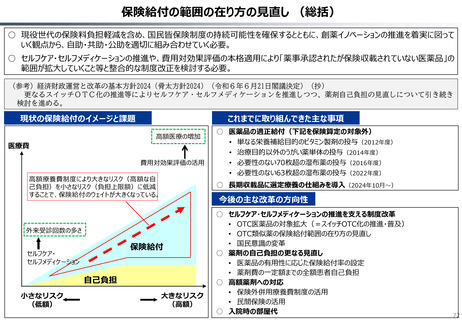
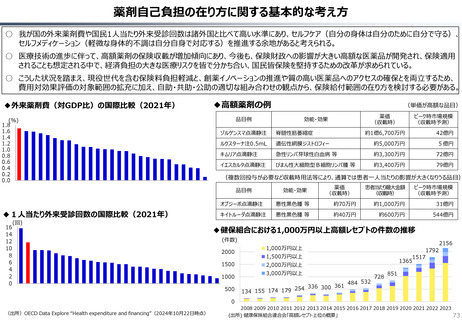
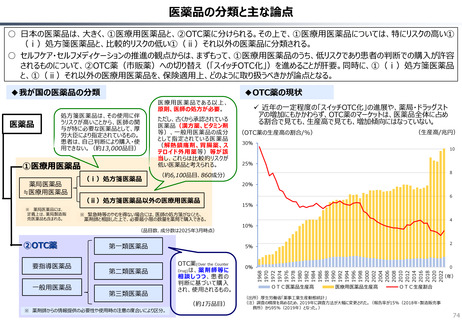
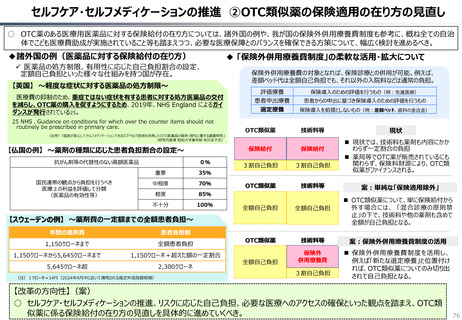
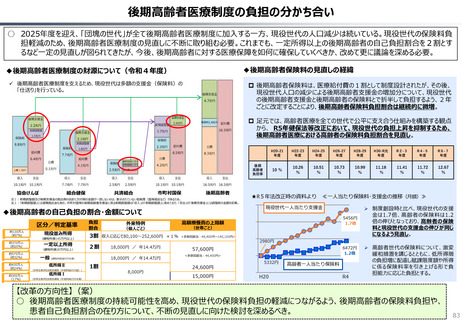
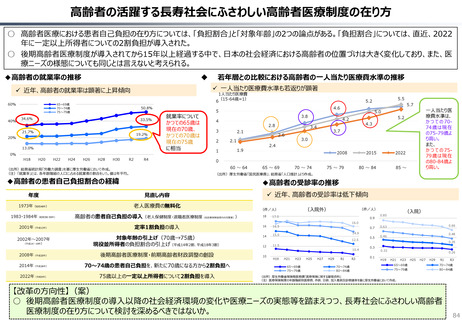
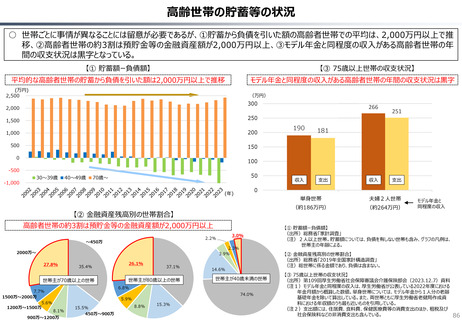
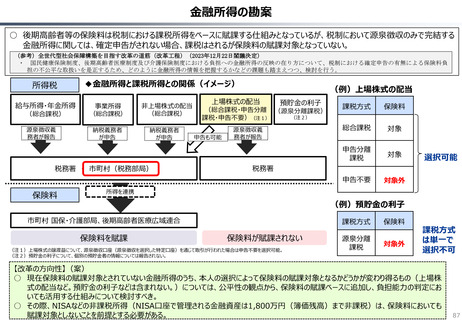
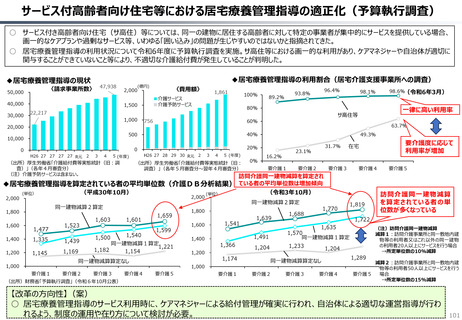
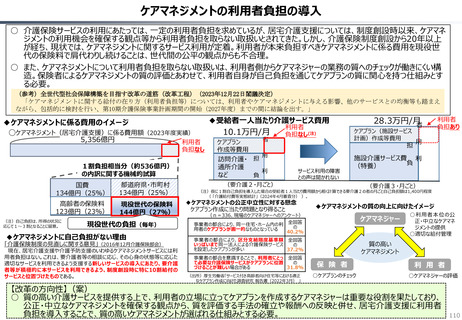
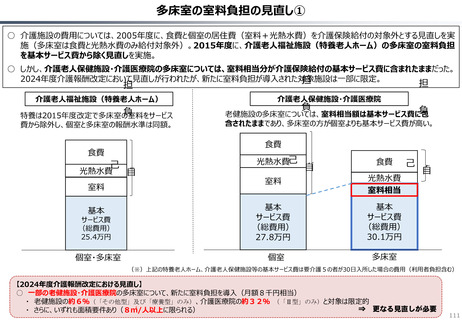
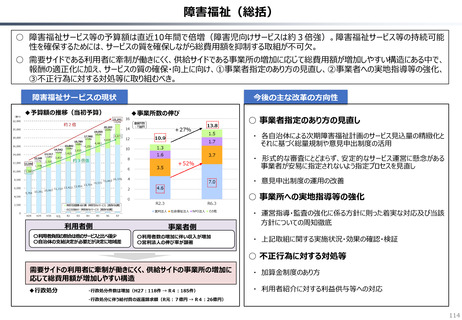
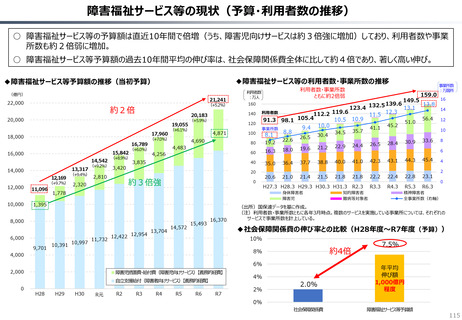
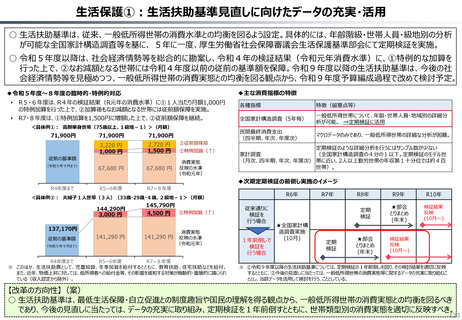
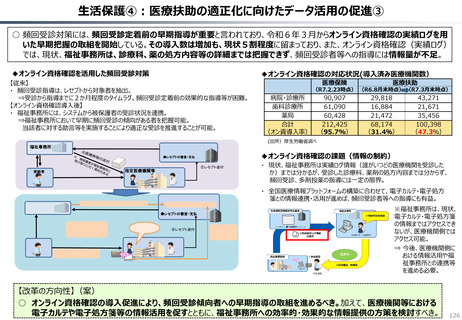
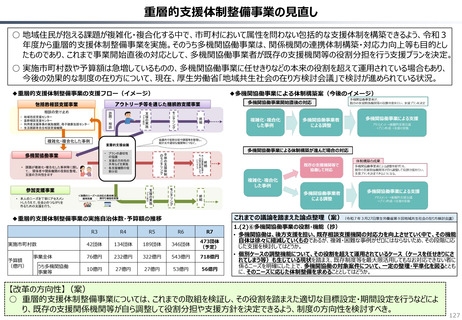
資料 持続可能な社会保障制度の構築(財政各論Ⅱ) (62 ページ)
出典
| 公開元URL | https://www.mof.go.jp/about_mof/councils/fiscal_system_council/sub-of_fiscal_system/proceedings/material/20250423zaiseia.html |
| 出典情報 | 財政制度等審議会 財政制度分科会(4/23)《財務省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
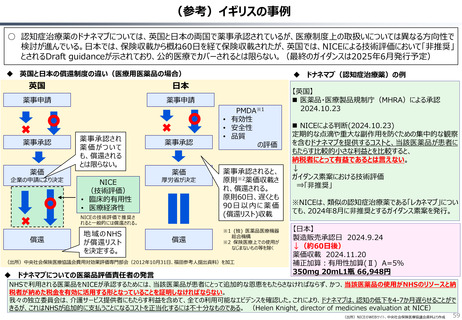
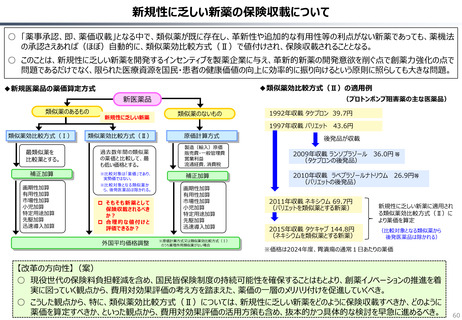
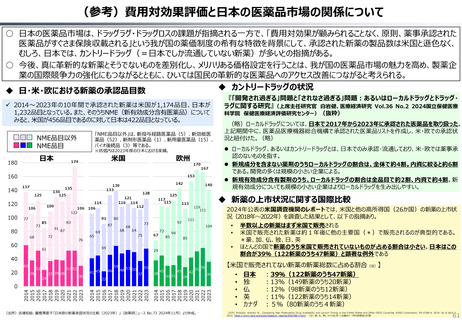
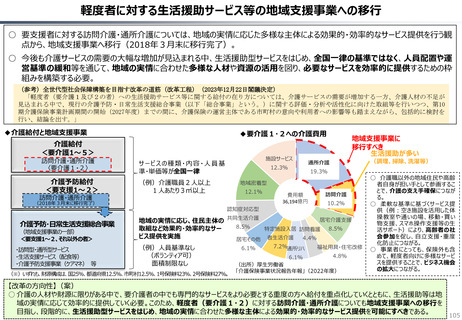
○ 日本の医薬品市場は、ドラッグラグ・ドラッグロスの課題が指摘される一方で、「費用対効果が顧みられることなく、原則、薬事承認された
医薬品がすぐさま保険収載される」という我が国の薬価制度の希有な特徴を背景にして、承認された新薬の製品数は米国と遜色なく、
むしろ、日本では、カントリードラッグ(=日本でしか流通していない新薬)が多いとの指摘がある。
○ 今後、真に革新的な新薬とそうでないものを差別化し、メリハリある価格設定を行うことは、我が国の医薬品市場の魅力を高め、製薬企
業の国際競争力の強化にもつながるとともに、ひいては国民の革新的な医薬品へのアクセス改善につながると考えられる。
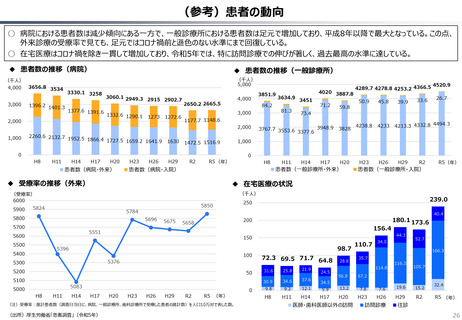
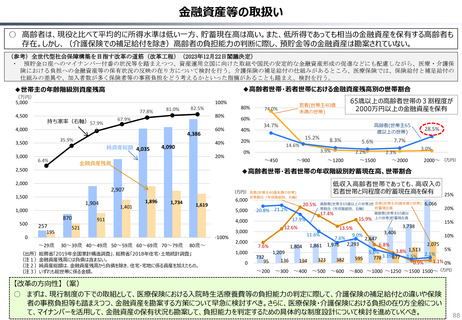
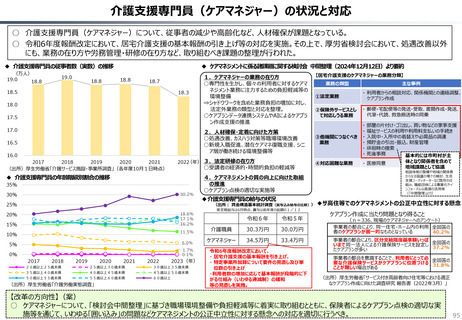
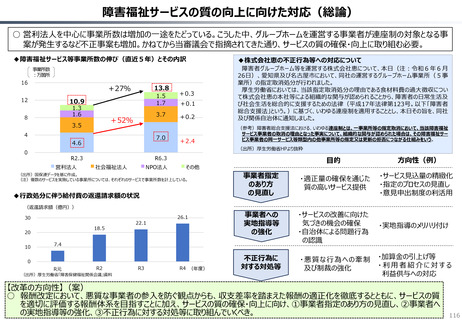
カントリードラッグの状況
日・米・欧における新薬の承認品目数
2014~2023年の10年間で承認された新薬は米国が1,174品目、日本が
1,232品目となっている。また、そのうちNME(新有効成分含有医薬品)について
みると、米国が456品目であるのに対して日本は422品目となっている。
「NME品目以外」は、新投与経路医薬品(5)、新効能医
薬品(52)、新剤形医薬品(1)、新用量医薬品(15)、
バイオ後続品(3)等である。
NME品目以外
NME品目
日本
180
※括弧内は2023年度の日本における実績。
米国
174
欧州
160
140
167
153
137
130
125
77
73
80
106
122
91
91
80
87
87
72
60
106
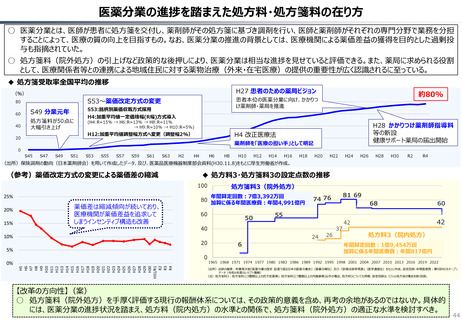
83
85
68
128
121
116 114
112
114
109
106
142
139
133
135
125
120
100
170
76
65
68
69
68
64
67
75
113
72
85
94
104
85
24
37 39 38
52 52
30
46
41 45
22
59
48 53 50
55
37
38
45
30 31
45
28
42
51 56
36
2014
2015
2016
2017
2018
2019
2020
2021
2022
2023
52
2014
2015
2016
2017
2018
2019
2020
2021
2022
2023
0
38
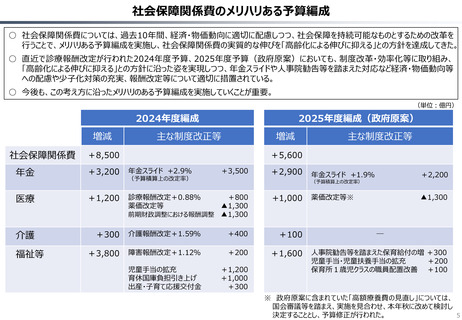
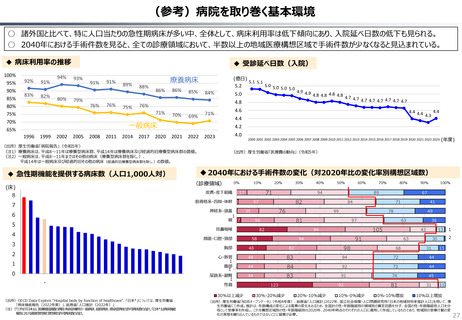
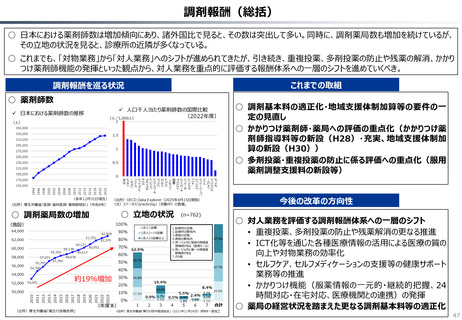
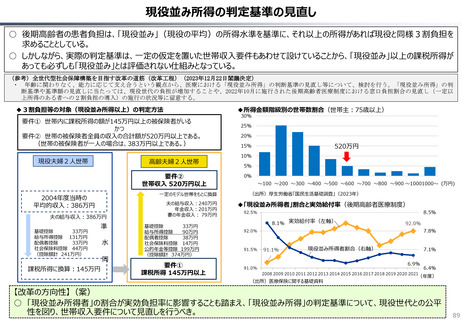
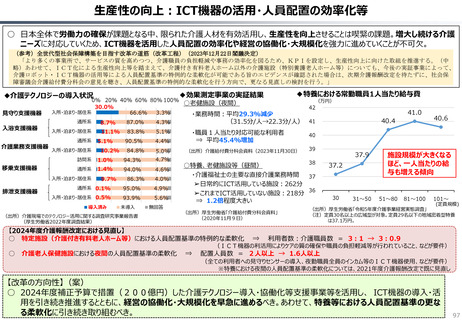
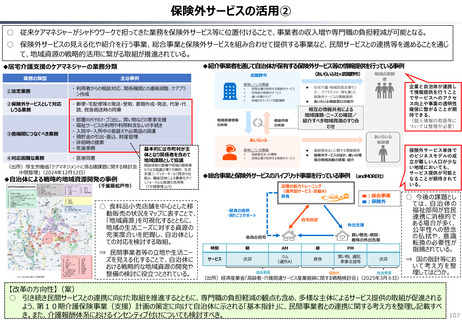
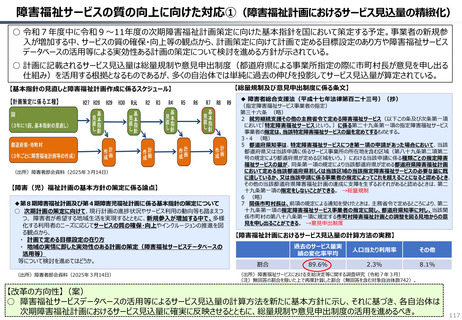
ローカルドラッグ、あるいはカントリードラッグとは、日本でのみ承認・流通しており、米・欧では薬事承
認のないものを指す。
新規成分を含まない薬剤のうちローカルドラッグの割合は、全体で約4割。内資に絞ると約6割
である。開発の多くは規模の小さい企業による。
新規有効成分含有製剤のうち、ローカルドラッグの割合は全品目で約2割、内資で約4割。新
規有効成分についても規模の小さい企業はよりローカルドラッグを生み出しやすい。
•
•
•
29
2014
2015
2016
2017
2018
2019
2020
2021
2022
2023
60
(略)ローカルドラッグについては、日本で2017年から2023年に承認された医薬品を取り扱った。
上記期間中に、医薬品医療機器総合機構で承認された医薬品リストを作成し、米・欧での承認状
況と紐付けた。(略)
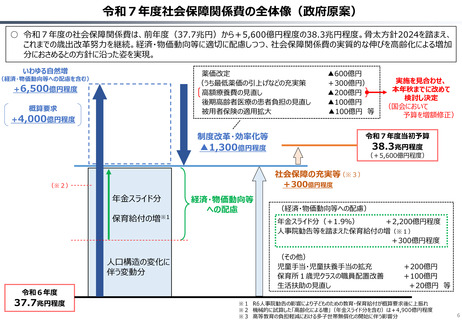
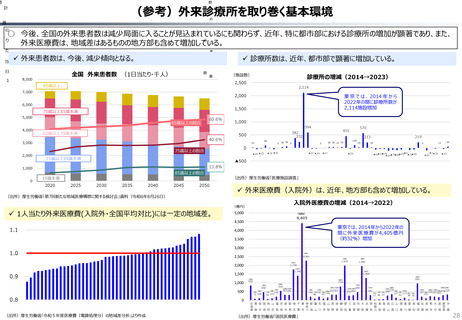
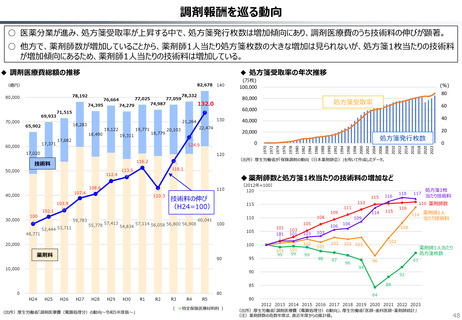
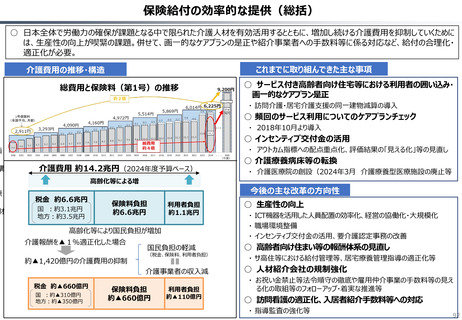
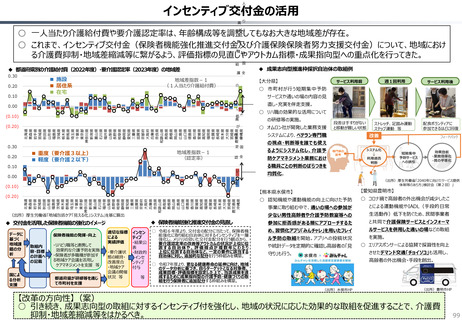
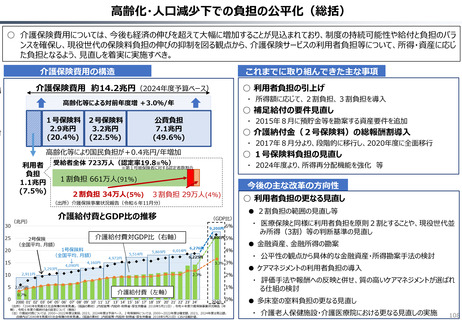
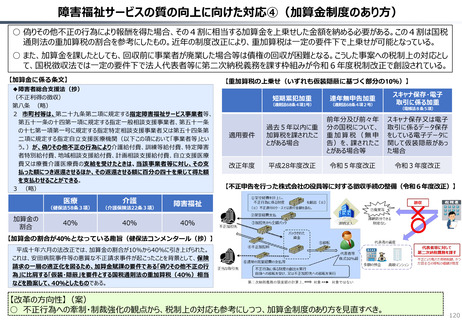
2024年公表の米国調査機関のレポートでは、米国と他の高所得国(26か国)の新薬の上市状
況(2018年~2022年)を調査した結果として、以下の指摘あり。
40
20
科学院 保健医療経済評価研究センター)(抜粋)
新薬の上市状況に関する国際比較
119
111
111
97
73
69
61
125
117
115
140
『「開発され過ぎる」問題と「されなさ過ぎる」問題:あるいはローカルドラッグとドラッグ・
ラグに関する研究』(上席主任研究官 白岩健、医療経済研究 Vol.36 No.2 2024国立保健医療
(出所)吉浦知絵、富樫満里子「日米欧の新薬承認状況の比較(2023年)」(政策研ニュース No.73 2024年11月)より作成。
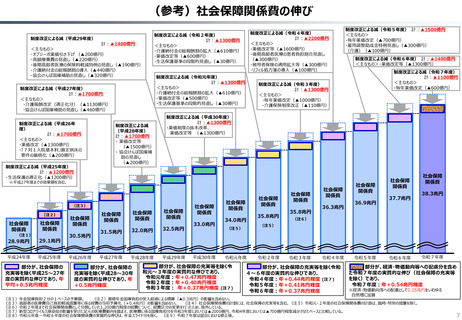
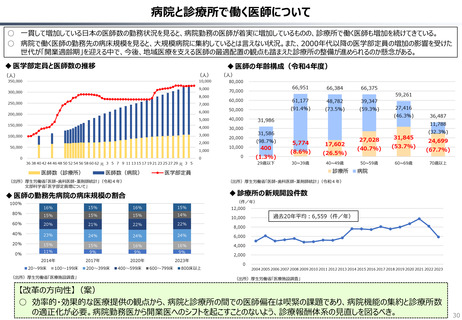
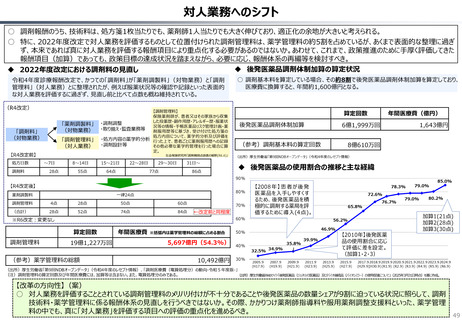
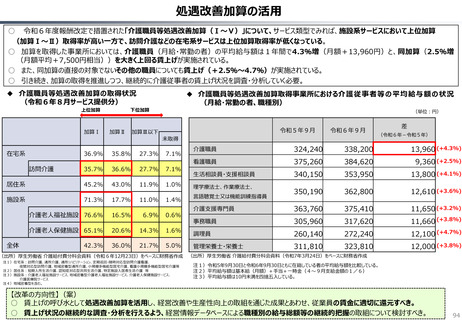
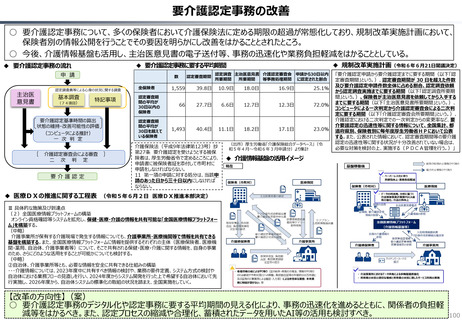
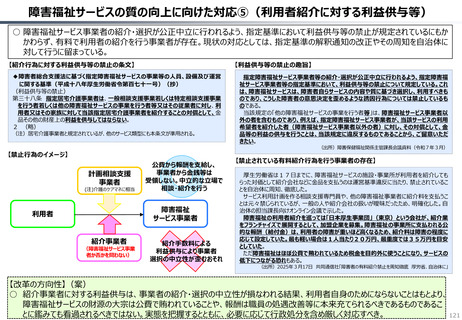
半数以上の新薬はまず米国で販売される
米国で販売された新薬は約1年後に他の主要国(*)で販売されるのが典型的である。
*豪、加、仏、独、日、英
ほとんどの国で新薬のうち米国で販売されていないものが占める割合は小さい。日本はこの
割合が39%(122新薬のうち47新薬)と顕著な例外である
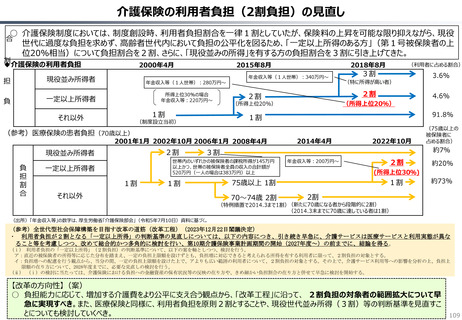
【米国で販売されてない新薬の新薬総数に占める割合(注)】
• 日本 :39%(122新薬のうち47新薬)
• 独
:13%(149新薬のうち20新薬)
• 仏
:12%(98新薬のうち12新薬)
• 英
:11%(122新薬のうち14新薬)
• カナダ :5%(80新薬のうち4新薬)
(出所)Mulcahy, Andrew W., Comparing New Prescription Drug Availability and Launch Timing in the United States and Other OECD Countries, RAND Corporation, RR-A788-4, 2024. As of April 3,
2024: https://www.rand.org/pubs/research_reports/RRA788-4.html (注)独、仏、英についてはレポート記載のデータから財務省で計算
61