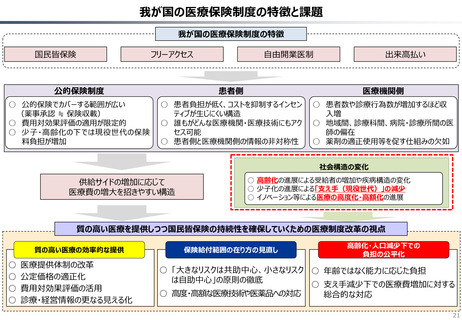
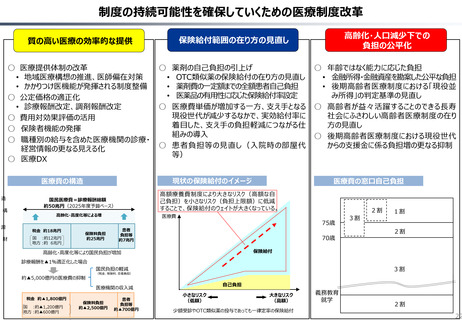
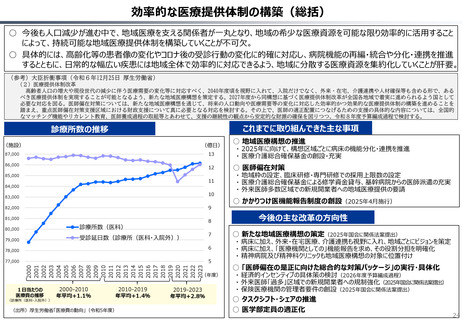
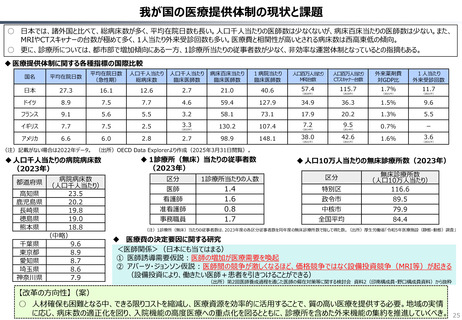
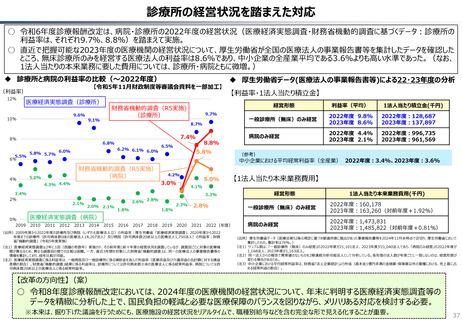
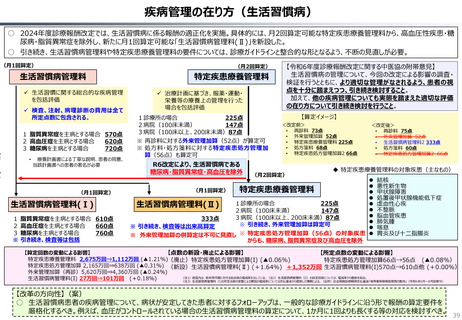
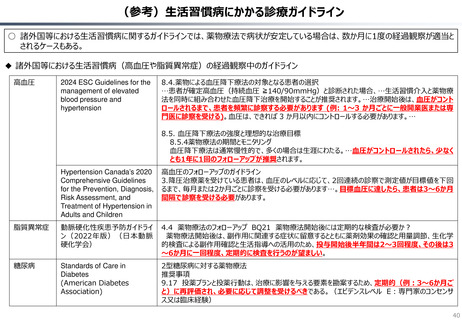
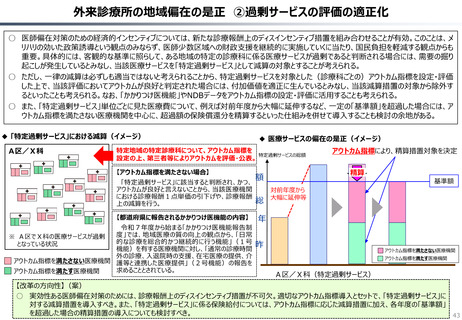
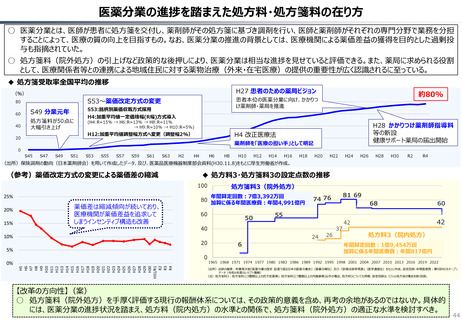
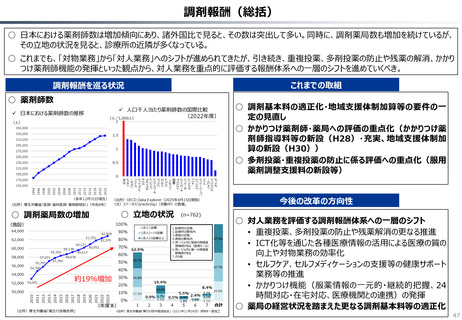
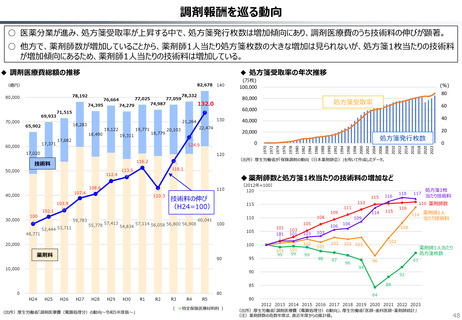
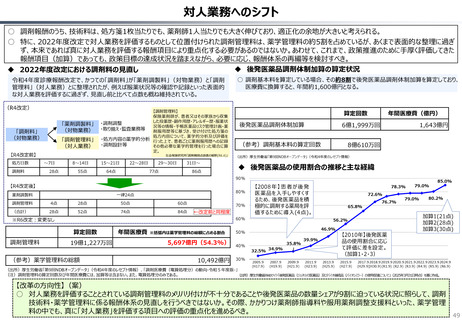
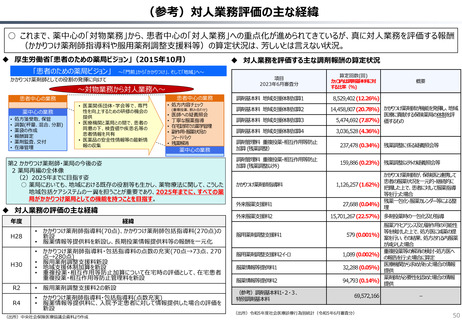
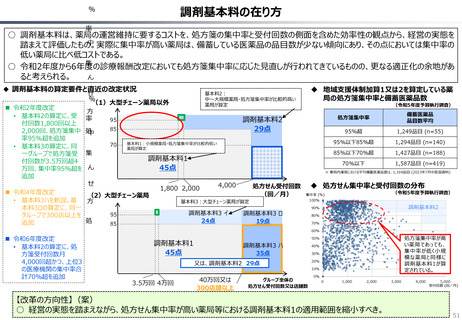
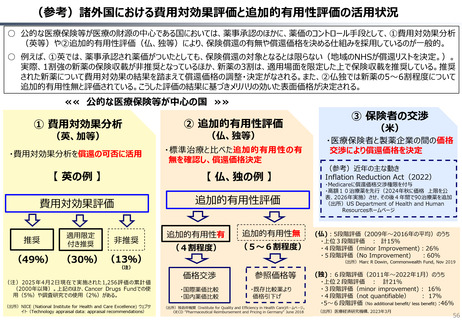
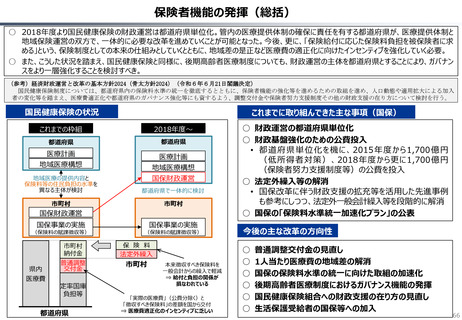
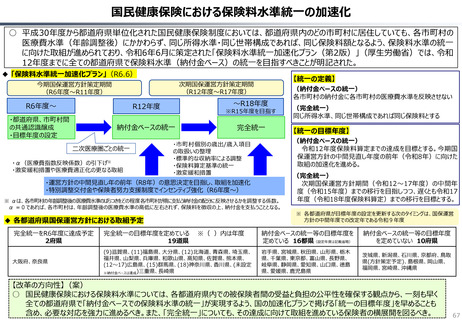
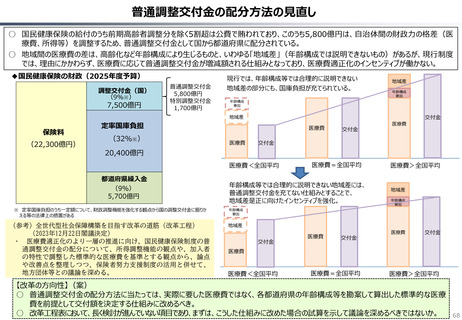
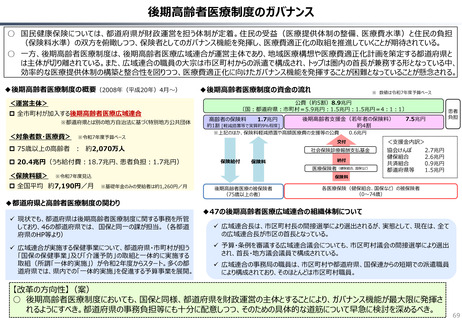
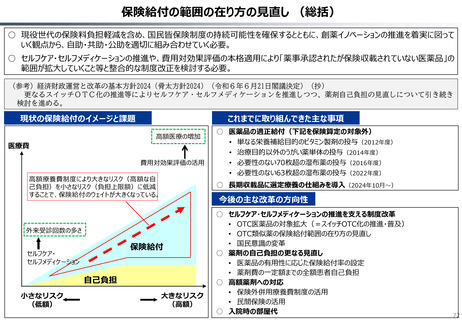
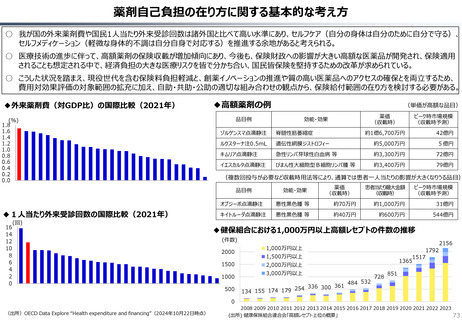
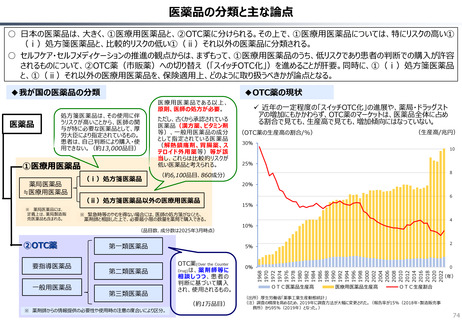
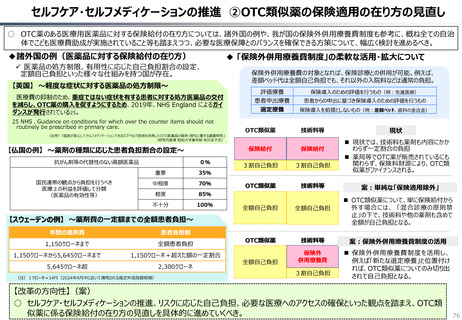
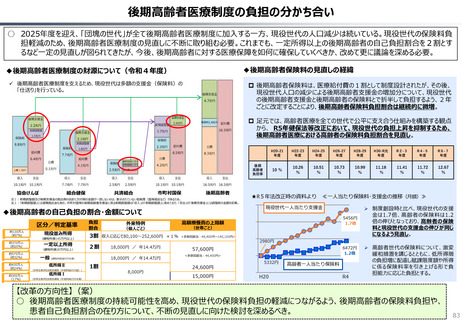
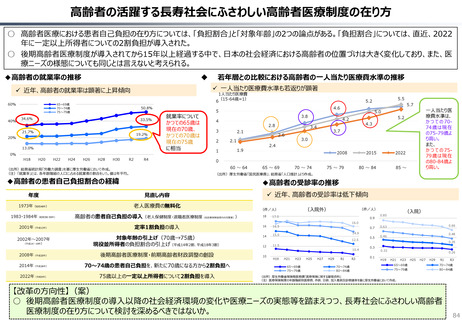
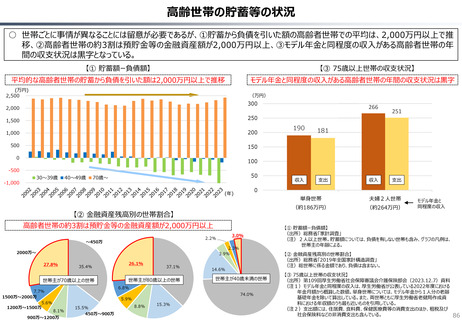
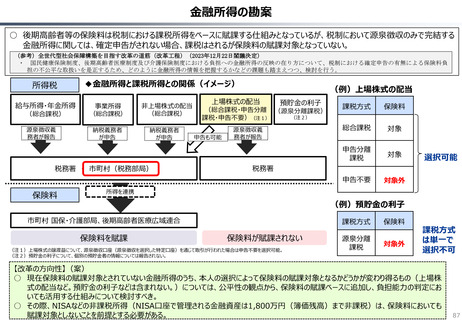
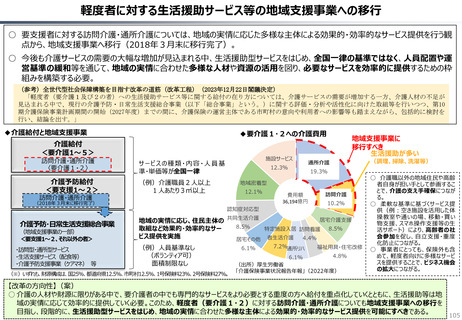
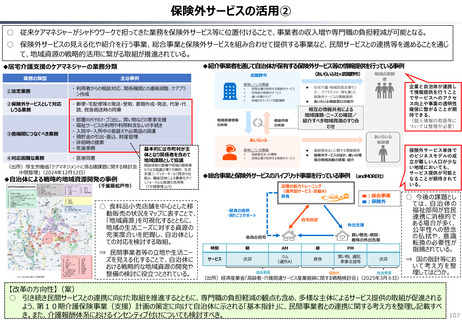
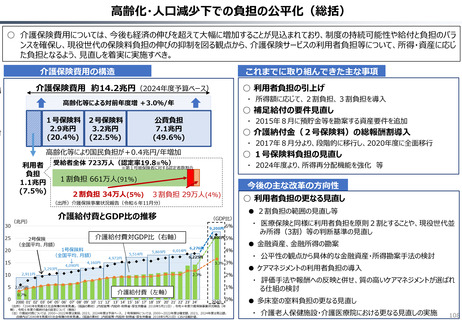
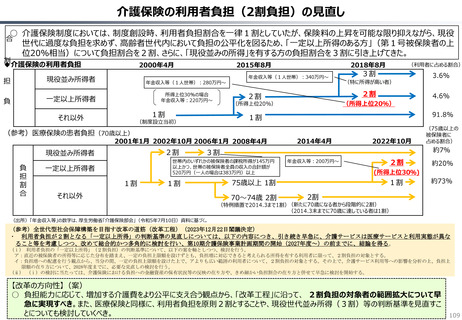
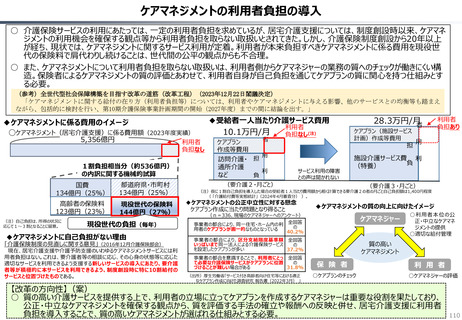
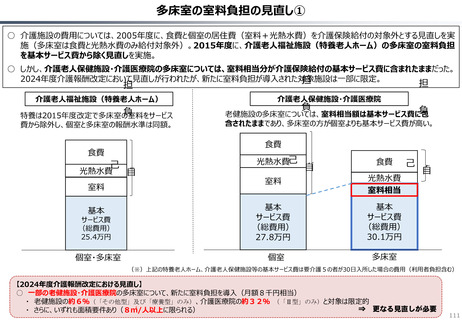
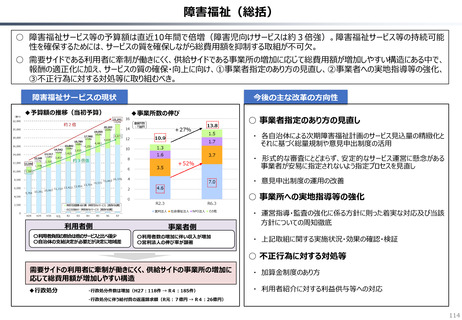
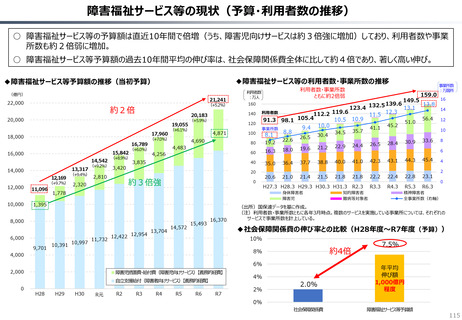
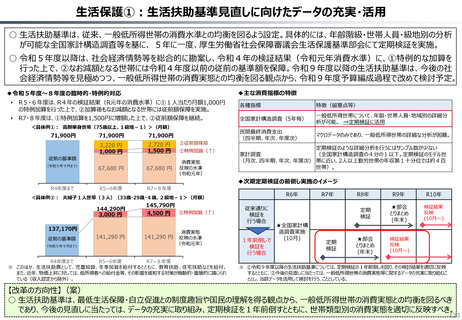
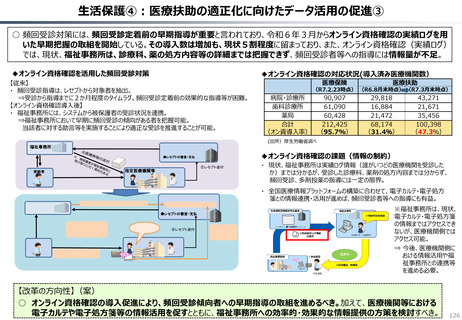
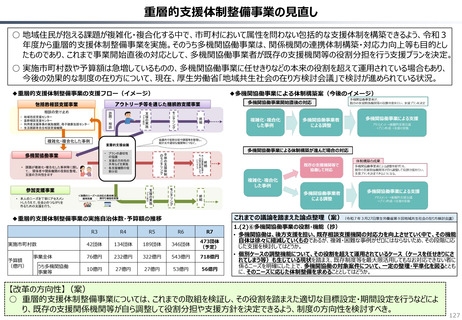
資料 持続可能な社会保障制度の構築(財政各論Ⅱ) (60 ページ)
出典
| 公開元URL | https://www.mof.go.jp/about_mof/councils/fiscal_system_council/sub-of_fiscal_system/proceedings/material/20250423zaiseia.html |
| 出典情報 | 財政制度等審議会 財政制度分科会(4/23)《財務省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
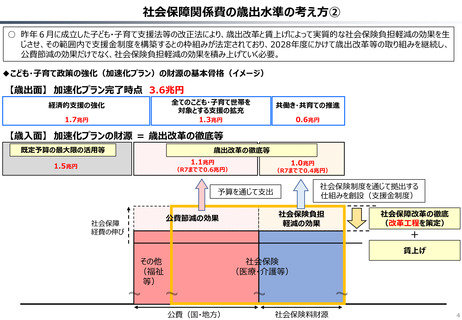
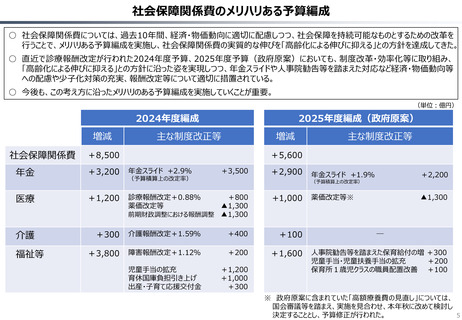
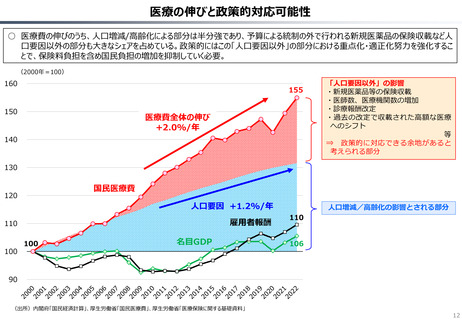
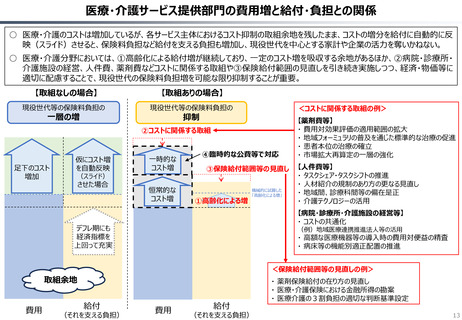
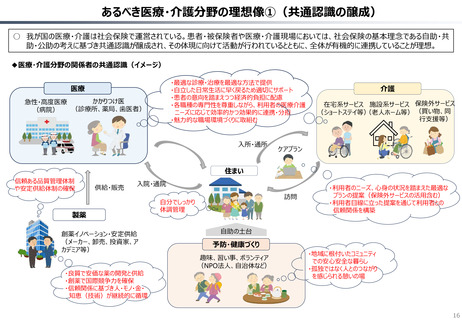
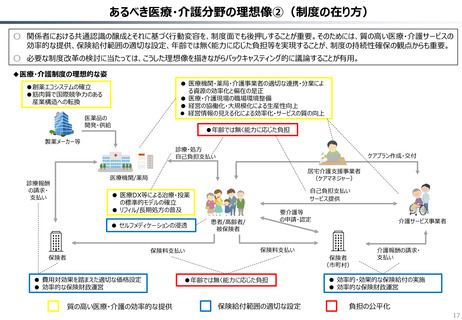
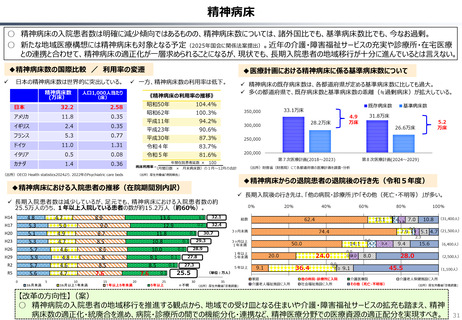
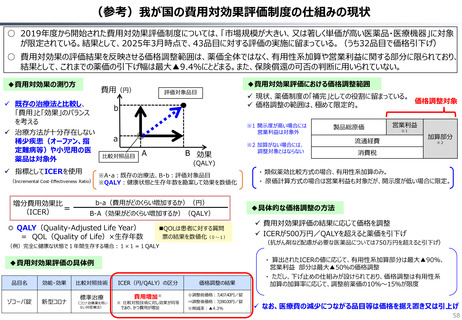
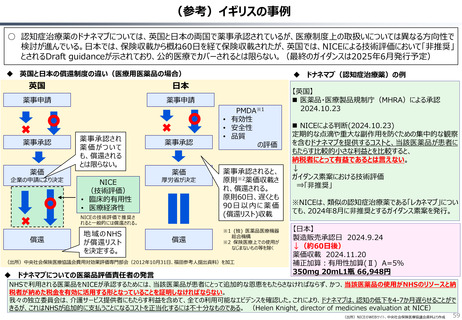
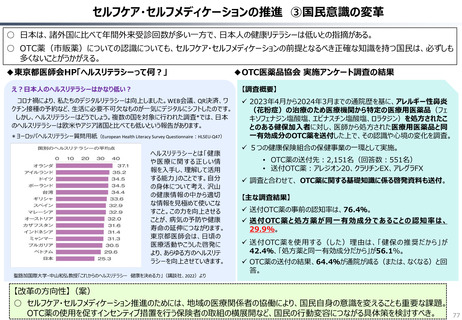
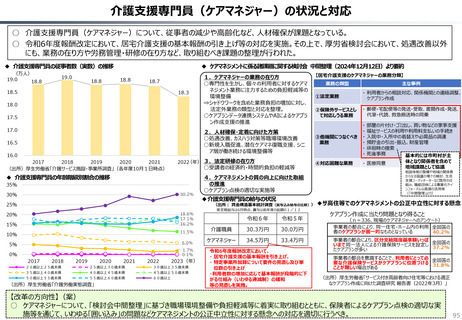
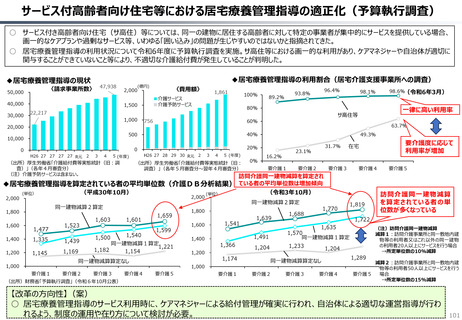
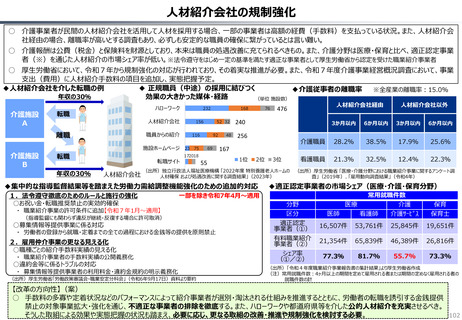
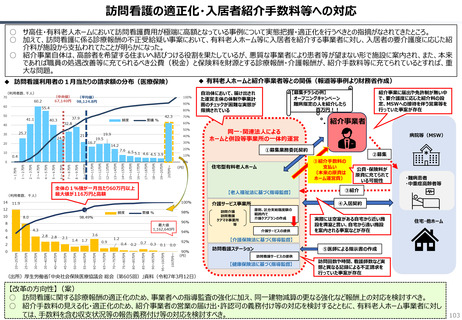
○ 認知症治療薬のドナネマブについては、英国と日本の両国で薬事承認されているが、医療制度上の取扱いについては異なる方向性で
検討が進んでいる。日本では、保険収載から概ね60日を経て保険収載されたが、英国では、NICEによる技術評価において「非推奨」
とされるDraft guidanceが示されており、公的医療でカバーされるとは限らない。(最終のガイダンスは2025年6月発行予定)
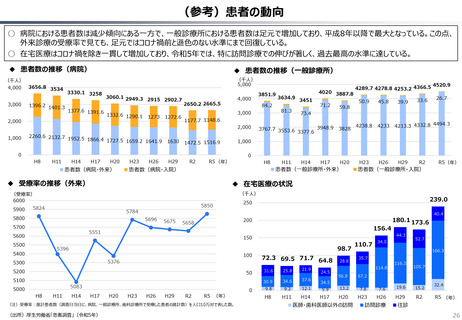
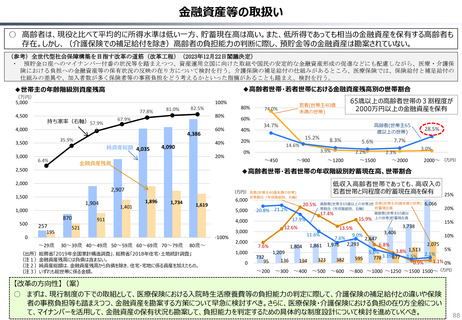
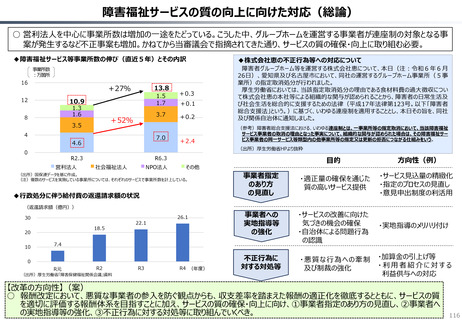
英国と日本の償還制度の違い(医療用医薬品の場合)
英国
日本
薬事申請
薬事申請
薬事承認
薬価
企業の申請により決定
薬事承認され
薬価がついて
も、償還される
とは限らない。
NICE
(技術評価)
• 臨床的有用性
• 医療経済性
薬事承認
薬価
厚労省が決定
NICEの技術評価で推奨さ
れると一般的には償還される。
償還
地 域 の NHS
が償還リスト
を決定する。
償還
ドナネマブ(認知症治療薬)の例
PMDA※1
• 有効性
• 安全性
• 品質
の評価
薬事承認されると、
原則※2薬価収載さ
れ、償還される。
原則60日、遅くとも
90 日 以 内 に 薬 価
(償還リスト)収載
※1 (独) 医薬品医療機器
総合機構
※2 保険医療上での使用が
なじまないもの等を除く
(出所)中央社会保険医療協議会費用対効果評価専門部会(2012年10月31日、福田参考人提出資料)を加工
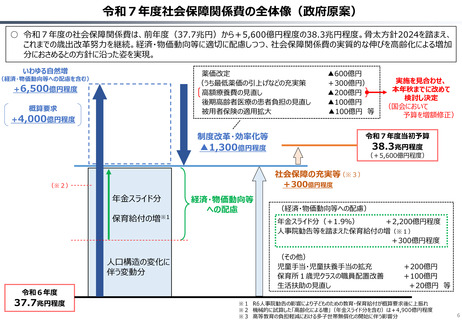
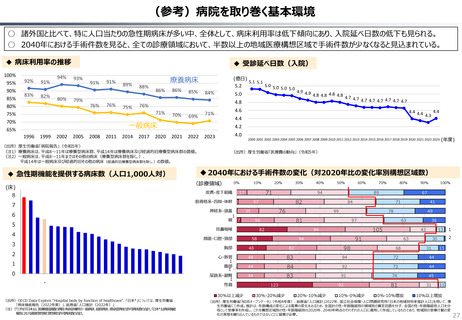
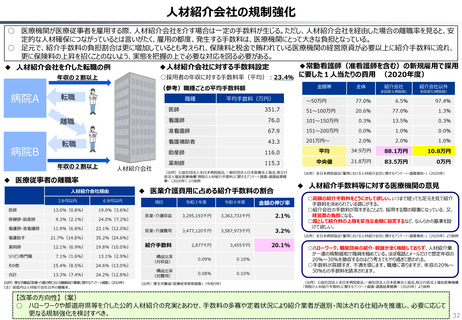
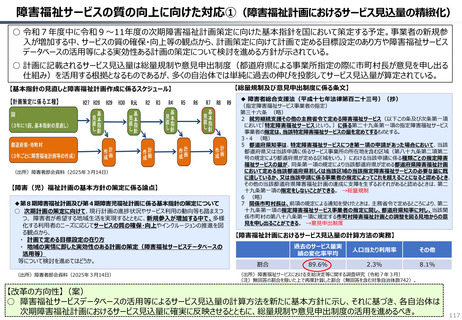
ドナネマブについての医薬品評価責任者の発言
【英国】
医薬品・医療製品規制庁(MHRA)による承認
2024.10.23
NICEによる判断(2024.10.23)
定期的な点滴や重大な副作用を防ぐための集中的な観察
を含むドナネマブを提供するコストと、当該医薬品が患者に
もたらす比較的小さな利益とを比較すると、
納税者にとって有益であるとは言えない。
↓
ガイダンス素案における技術評価
⇒「非推奨」
※NICEは、類似の認知症治療薬である「レカネマブ」につい
ても、2024年8月に非推奨とするガイダンス素案を発行。
【日本】
製造販売承認日 2024.9.24
↓(約60日後)
薬価収載 2024.11.20
補正加算:有用性加算(Ⅱ) A=5%
350mg 20mL1瓶 66,948円
NHSで利用される医薬品をNICEが承認するためには、当該医薬品が患者にとって追加的な恩恵をもたらさなければならず、かつ、当該医薬品の使用がNHSのリソースと納
税者が納めた税金を有効に活用する形となっていることを証明しなければならない。
我々の独立委員会は、介護サービス提供者にもたらす利益を含めて、全ての利用可能なエビデンスを確認した。これにより、ドナネマブは、認知の低下を4-7か月遅らせることがで
きるが、これはNHSが追加的に支払うことになるコストを正当化するには不十分なものである。 (Helen Knight, director of medicines evaluation at NICE)
(出所)NICEのWEBサイト、中央社会保険医療協議会資料より作成
59