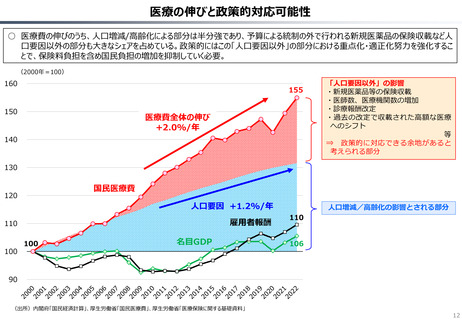
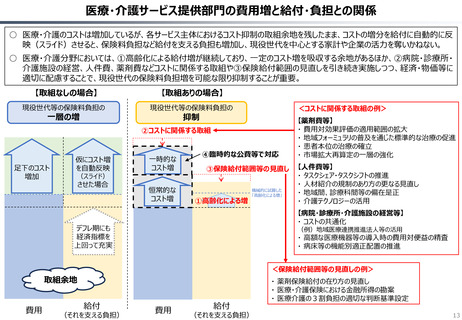
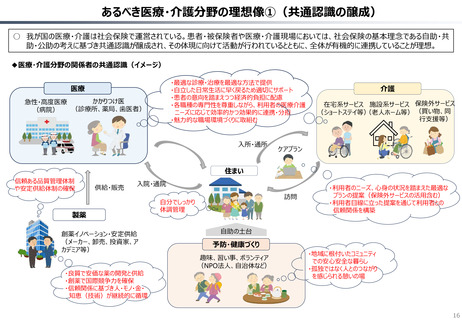
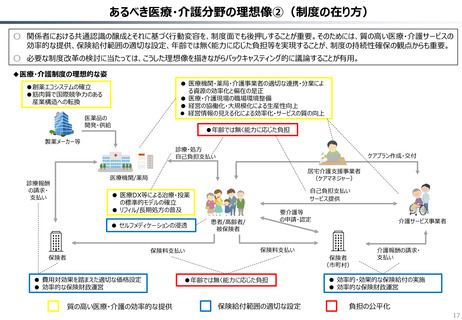
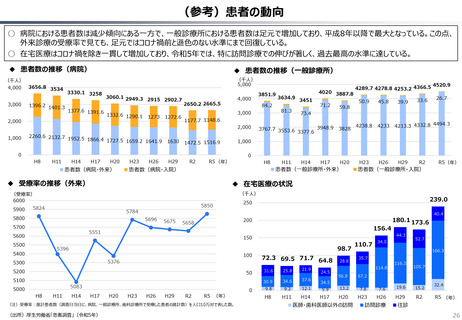
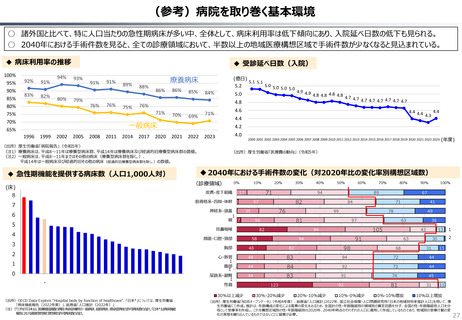
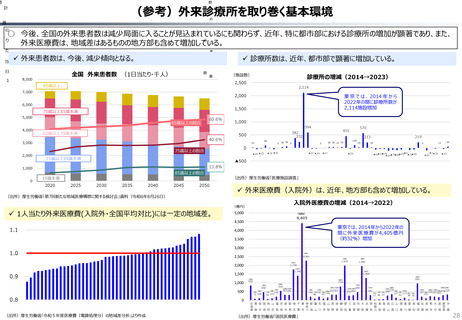
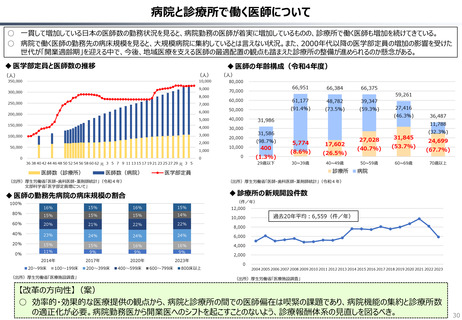
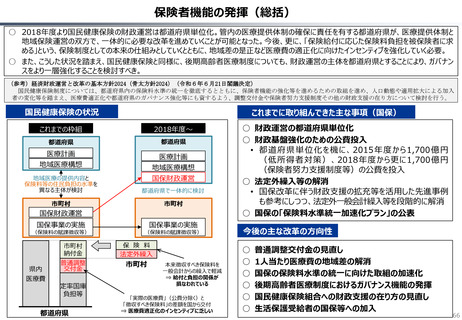
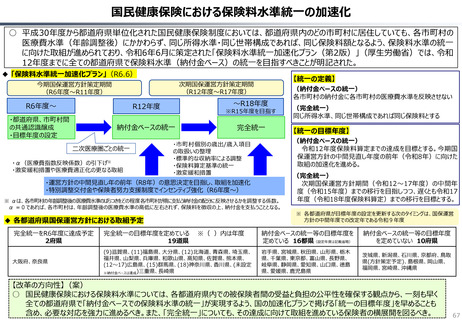
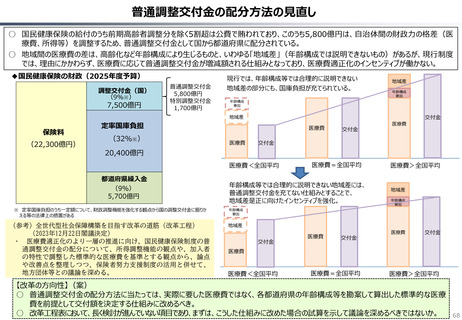
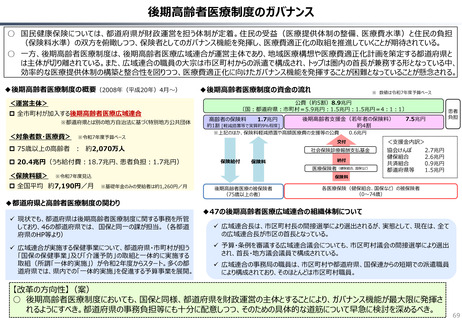
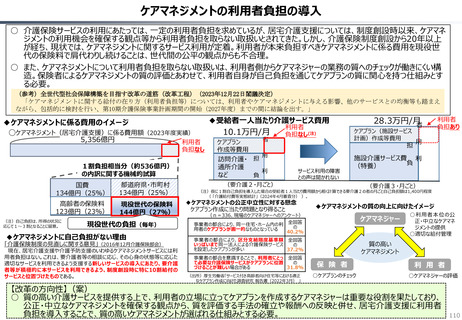
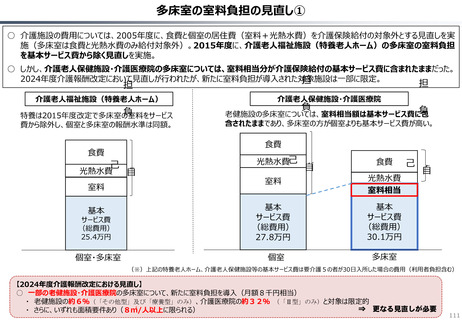
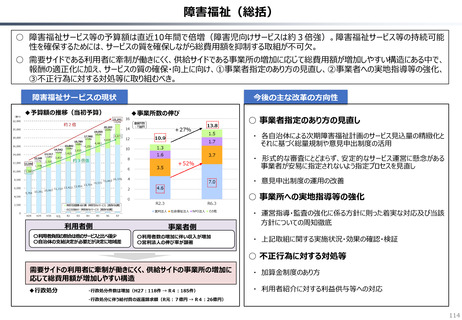
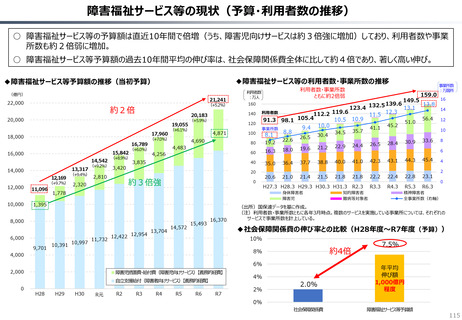
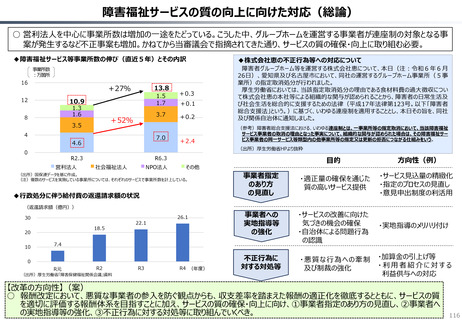
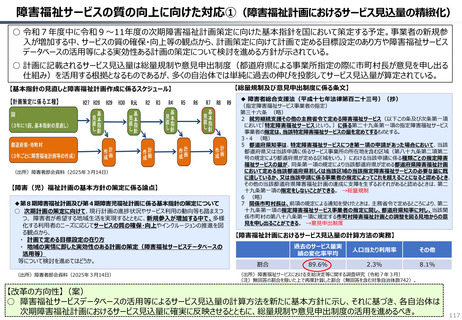
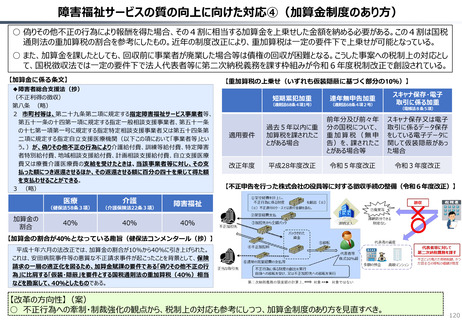
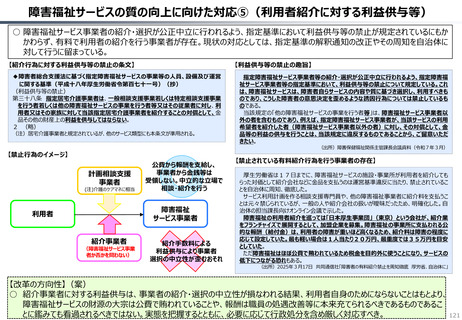
資料 持続可能な社会保障制度の構築(財政各論Ⅱ) (55 ページ)
出典
| 公開元URL | https://www.mof.go.jp/about_mof/councils/fiscal_system_council/sub-of_fiscal_system/proceedings/material/20250423zaiseia.html |
| 出典情報 | 財政制度等審議会 財政制度分科会(4/23)《財務省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
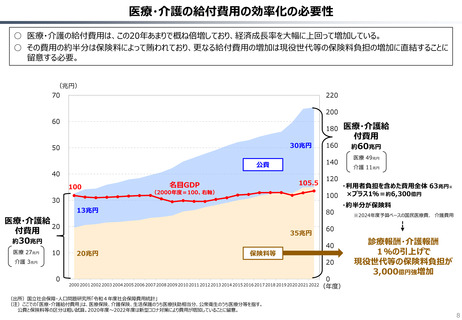
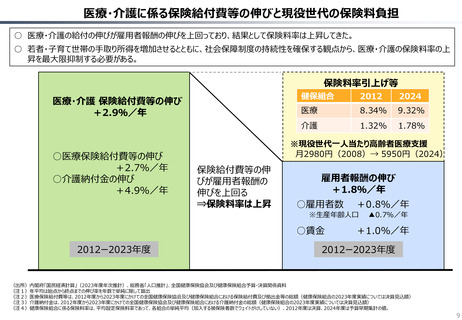
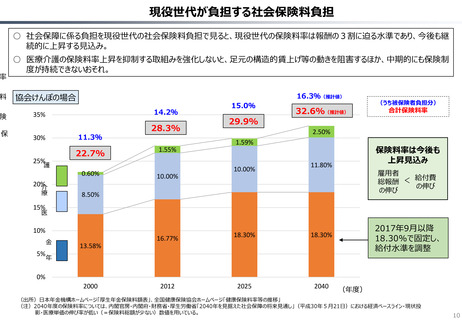
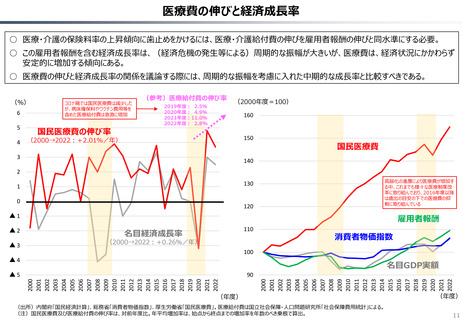
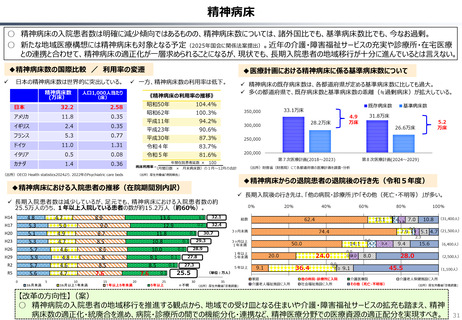
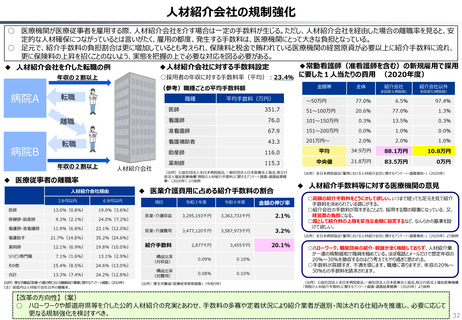
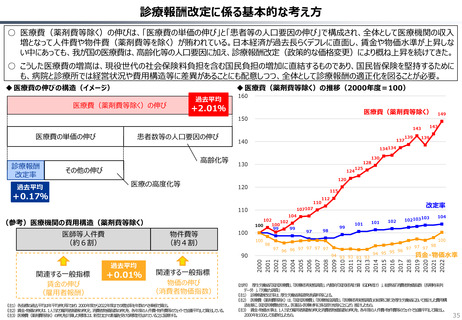
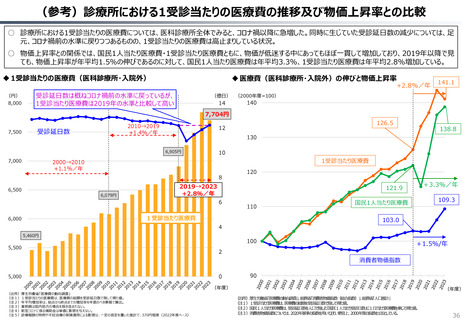
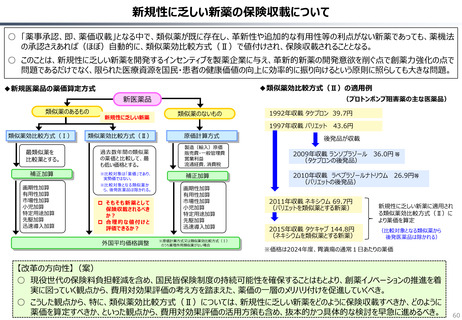
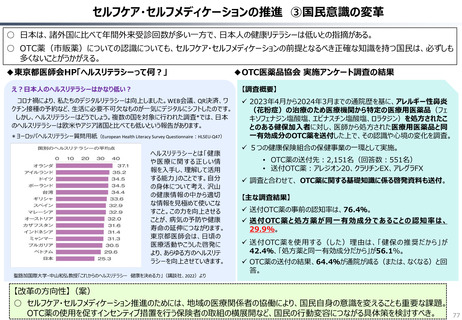
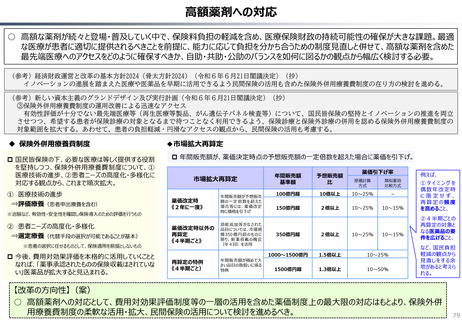
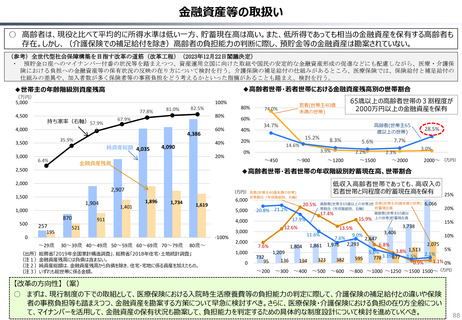
○ 日本では、薬事承認された医薬品は、事実上すべて、速やかに公的保険の対象となる。こうした「無条件での薬価基準への収載」による財
政影響は予算統制の枠外となっており、また、一旦保険収載された医薬品に対しては、その後の費用対効果評価の適用も極めて限定的。
○ 「薬事承認、即、薬価収載」は、1980年代の日米MOSS協議で決まった「60日ルール」により強化され、明確化されたものだが、そうした
運用の起源としては、1961年に国民皆保険が実現する前後で生じた「制限診療」を巡る歴史的な経緯の存在が挙げられる。
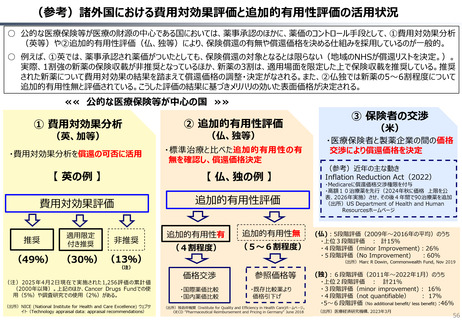
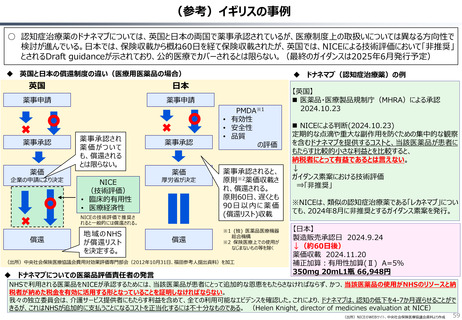
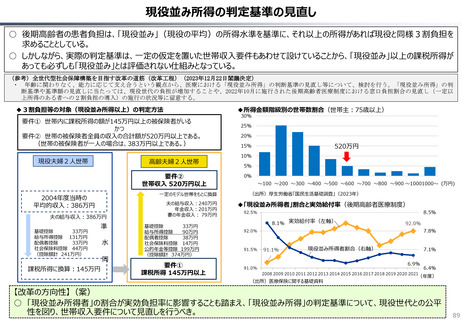
○ 諸外国を見ると、①英国では、薬事承認後、費用対効果評価(臨床的有用性、医療経済性の評価)の結果に応じて、公的医療制度
(NHS)での償還が判断され、②仏・独では追加的有用性評価を幅広く適用し、新薬の価格が決定・調整される。
◆「薬事承認≒薬価収載」となった歴史的経緯
~ 1960年当時は、療養担当規則で医薬品の使用基準が規定されており、医師が
保険診療を実施する場合、自由に診療を行うことが認められてはいなかった~
1960年
8月
日本医師会が「制限診療の撤廃」を含む4項目を強く要望
1961年
厚生省との調整が難航する中、医師会による「全国一斉休診」の実施
(2月19日)、「保険医総辞退」の与党への通告・収拾を経て、非公開の
「医療懇談会」での協議となる。(この間、中医協は停止状態。)
9月5日、医療保険懇談会の了解事項として、新薬・新療法をできるだけ
速やかに保険に採用し、制限診療を緩和すること等が決定
~「薬事承認済だが保険未収載」の医薬品がある製薬企業は保険適用に向け積
極的に活動~
~規制緩和が進み「薬事承認⇒薬価収載」が慣習化~
1967年
9月
「医薬品の製造承認等に関する基本方針について」(昭和42年9月30日薬発第
645号)にて、慣行上行われてきた薬事承認と薬価基準収載の手続きに係
る一体的な運用方針を通知
~薬の「経済性」が考慮されず、無条件で薬価収載される慣行が完成~
1986年
10月
2000年
9月
1985 年 の 日 米 MOSS 協 議 ( Market-Oriented Sector-Selective
talks)で無条件・迅速な保険収載という慣行を「60日ルール」として合意
「医療用医薬品の薬価基準収載等に係る取扱いについて」(平成12年9月1日
健政発第1032号保発第152号)で初通知の発出
~公式な政策として、「無条件での薬価収載」「60日ルール」が明確化~
(出所) 『医薬品の無条件収載(1)』(印南一路.(2024)『週刊社会保障』3295)等を基に作成
● 『日本医師会通史』(https://med.or.jp/jma/about/50th/)
[昭和36年は]日本医師会の歴史のなかでもトップクラスの激動が続いた年であった。
(略)皆保険体制に入るには最低限これだけの前提条件の整備が必要だとして、日
本医師会が政府に求めたものが昭和35年夏の4項目要求であった。(略)
[1961年の2月の調整の過程で]まず制限診療の緩和について具体的な申し合わせ
が交わされた。①学会が緊急必要と認める医薬品については、指針関係といえども簡素
な手続きで保険に採用する。(略)この合意を評価して、日本医師会は3月1日からの
保険医総辞退届の提出を延期した。(略)
[懇談会での精力的な議論の結果、]9月5日の第8回の会合で、全会一致で次のよう
な了解事項をまとめた。①医療の水準を向上させるために新薬、新療法をできるだけす
みやかに保険に採用し、制限診療を緩和する。(以下、略)
●制限診療の緩和
懇談会の合意を受けて灘尾厚相は9月15日、中医協に制限診療の緩和を諮問した。
「高血圧治療指針を改正して血圧降下剤を新たに保険診療に採用する。精神科の治
療指針を改正して新薬を採用して、1日使用量を増やす。歯槽膿漏治療指針を新設す
る」という内容であった。中医協は即日、諮問どおりの答申をした。
● 『平成23年度版、厚生労働白書』
(略)国民皆保険後の保健医療では、1962(昭和37)年に保険診療において抗
生物質、抗がん剤、副腎皮質ホルモン等の使用を認可するなど、いわゆる制限診療の
撤廃が行われた。
● 『新薬はなぜ、承認から60日で患者さんに届くのか -60日ルールの誕生と現状、
これから- 』(医薬産業政策研究所主任研究員 吉田晃子氏)
(略)6回の協議を経て、1985年12月11日に基本的合意が達成され、この合意に
より、医薬品・医療機器の承認審査手続きの簡素化・迅速化が実施される。(略)そ
れまでは年に何回といった取り決めはなく、慣例的に年2回程度だった新薬の収載は、
1986年度より年4回収載へと変更された。承認を受けた医薬品がいつ保険適用にな
るのか見通せないという米国側の強い主張が通った格好であり、これが60日ルールの
始まりである。具体的な合意事項としては、「新薬は、承認後、より早く薬価収載される
よう、製造又は輸入の承認時期に合わせて年4回定期的に収載される。承認後できる
だけ早く、原則60日以内、遅くとも90日以内に収載する。この方針は、1986年度以
降に承認された新薬に適用される。」というものであり、有効期限はない。
54