よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
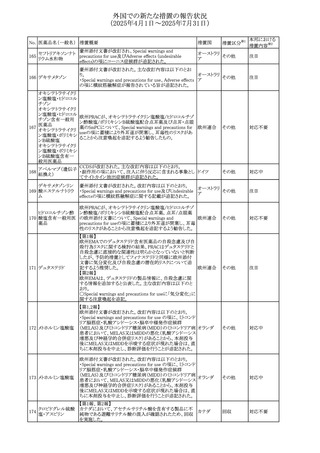
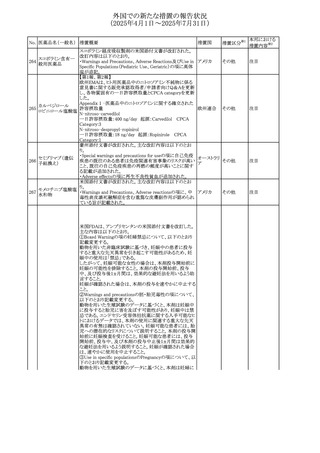
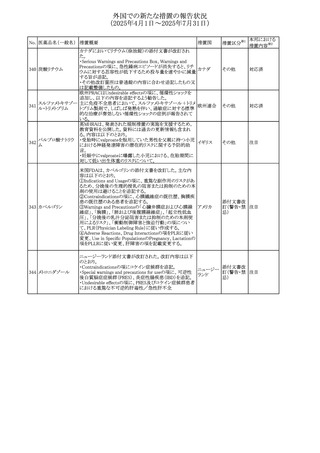
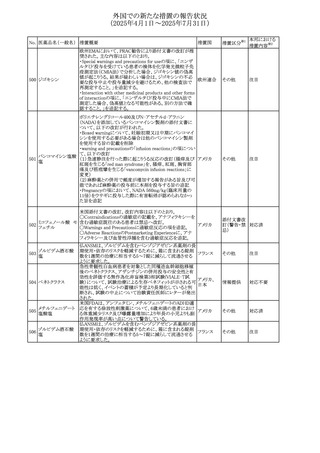
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
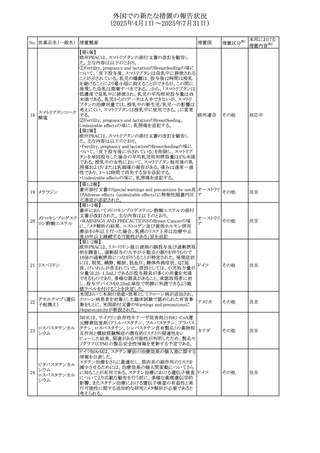
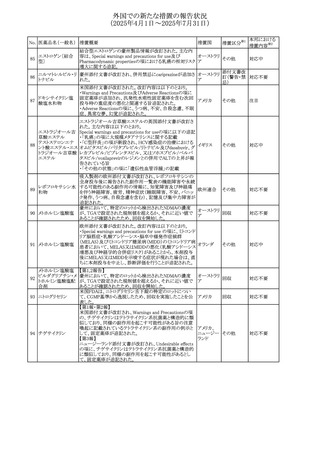
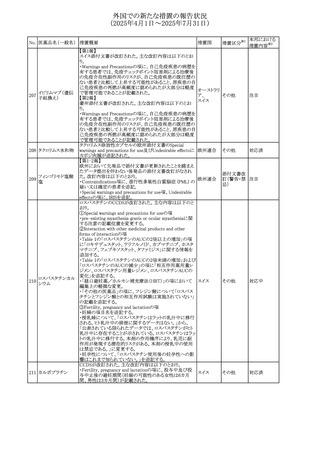
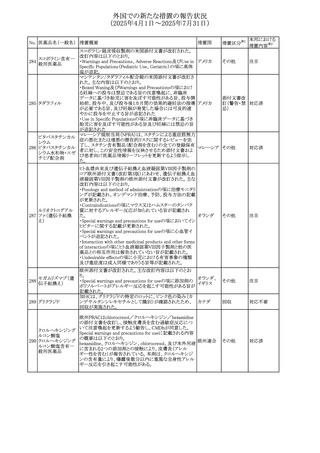
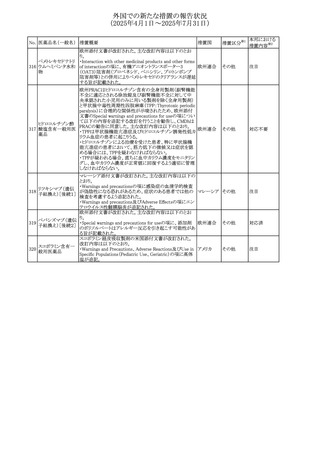
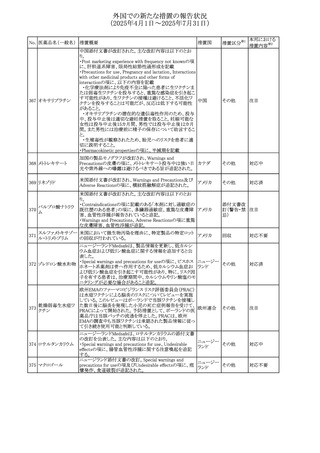
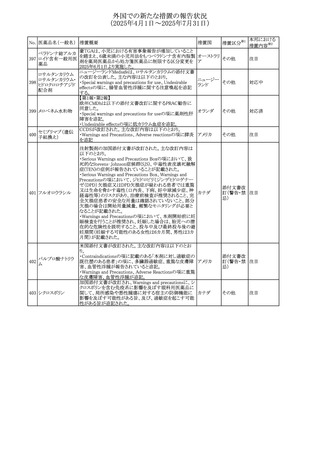
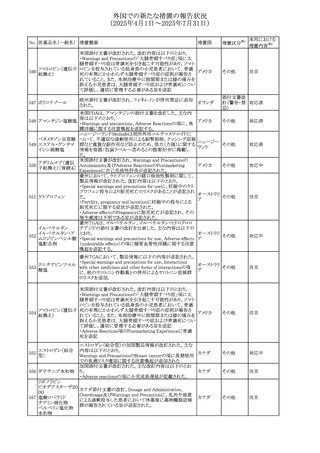
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
欧州PRACが欧州添付文書の改訂を勧告した。主な内容は
テガフール・ギメラシ
以下のとおり。
59 ル・オテラシルカリウ
欧州連合 その他
・Special warnings and precautions for use、Undesirable
ム配合剤
effectsの項に高アンモニア血症を追記
豪州添付文書のSpecial warnings and precautions for use及
オーストラリ
60 メサラジン
びAdverse effects(undesirable effects)に特発性頭蓋内圧
その他
ア
亢進症が追記された。
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Special warnings and precautions for useの項に、遺伝毒
タモキシフェンクエ 性があるため、投与中及び最終投与後の避妊期間(妊娠の オーストラリ
61
その他
ン酸塩
可能性のある女性は9カ月間、男性は6カ月間)が記載され ア
た。また、投与中は妊娠しないよう助言すること、避妊はバリ
ア法、その他の非ホルモン性避妊法を使用することが記載
された。
豪州添付文書が改訂され、Special warnings and
セファゾリンナトリウ
オーストラリ
62
precautions for use及びAdverse effects (undesirable
その他
ム
ア
effects)の項にコーニス症候群が追記された。
メトロニダゾールの豪州添付文書が改訂された。主な改訂
内容は以下のとおり。
ボノプラザンフマル ・Contraindicationsの項にコケイン症候群の患者を追記。
添付文書改
酸塩・アモキシシリ ・Contraindications及びAdverse effects (undesirable
オーストラリ
63
訂(警告・禁
ン水和物・メトロニダ effects)の項に、コケイン症候群患者へのメトロニダゾールの ア
忌)
ゾール
全身使用において、急速に発症し致死的転帰を伴う症例を
含む、重度の不可逆的肝毒性、急性肝不全の症例が報告
されている旨を追記。
64 ミルタザピン
65 カルバマゼピン
66 タクロリムス水和物
FAERSデータベースで特定されたシグナルに関する報告。
・中止時に出現するカタプレキシーのシグナルについて、措 アメリカ
置の必要性を評価しているとのこと。
その他
ニュージーランドMedsafeは、Safety Informationでカルバマ
ゼピンに対する注意喚起のための情報を発出した。
・最近の観察研究により、出生前のカルバマゼピン曝露が、
ニュージー
一般集団及びてんかん患者の児の両方において、妊娠期
その他
ランド
間に比して小さい児として生まれるリスク増加、又は小頭症
で生まれる児のリスク増加と関連している可能性が判明し
た。
【第1報】
独BfArMは、医薬品の安全性に関する報告書(2025年3月)
に、現在のリスク情報として欧州EMAのPRACによる評価の
結果、タクロリムス(全身投与製剤)とカポジ肉腫との間の因
果関係について、少なくとも合理的な可能性があるとの見解 ドイツ、
その他
を掲載した。
欧州連合
【第2報】
タクロリムス徐放性カプセルの欧州添付文書のSpecial
warnings and precautions for use及びUndesirable effectsに
カポジ肉腫が追記された。
本邦における
措置内容※2
対応中
注目
対応済
対応済
注目
注目
注目
対応済
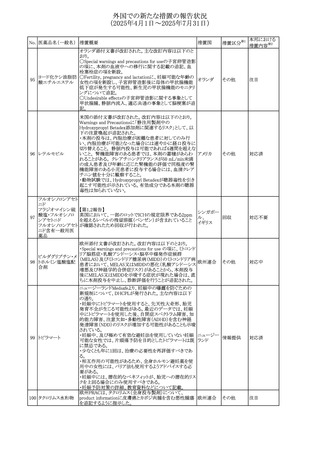
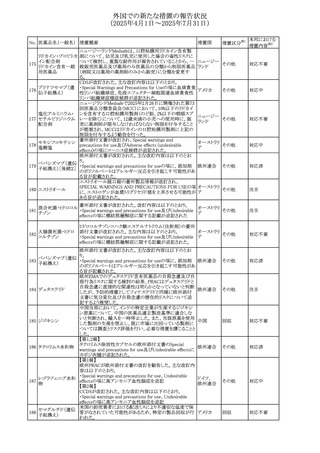
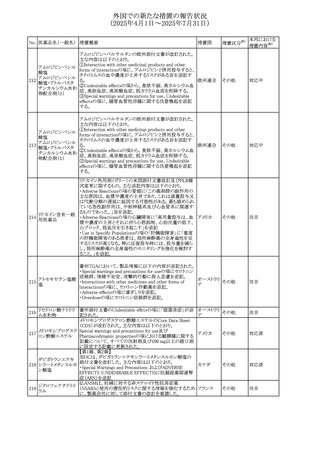
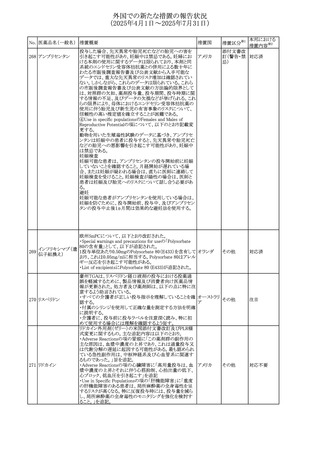
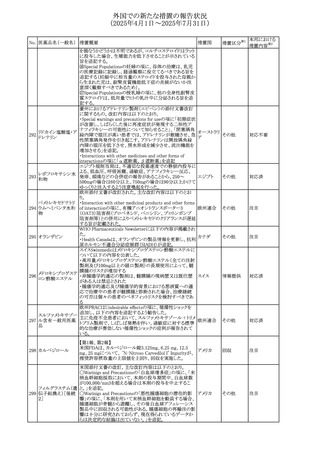
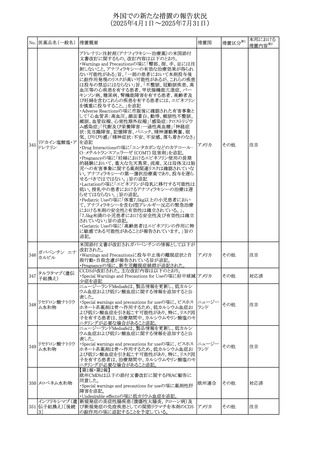
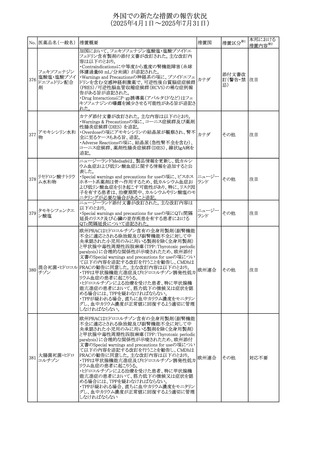
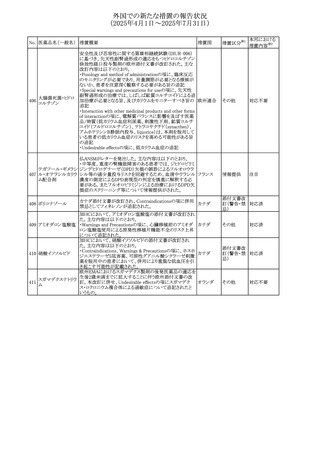
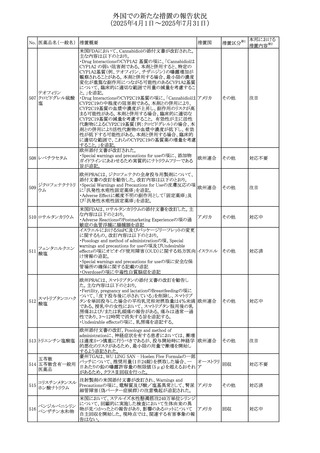
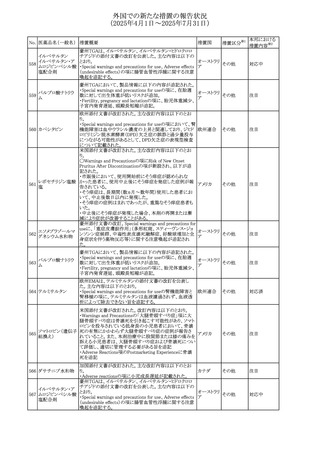
67 メトホルミン塩酸塩
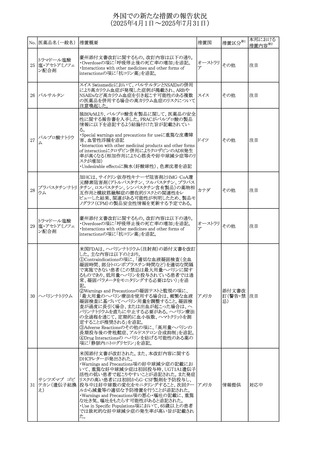
欧州添付文書が改訂された。改訂内容は以下のとおり。
・Special warnings and precautions for use の項に、ミトコンド
リア脳筋症・乳酸アシドーシス・脳卒中様発作症候群
(MELAS)及びミトコンドリア糖尿病(MIDD)のミトコンドリア病
欧州連合
患者において、MELAS又はMIDDの悪化(乳酸アシドーシス
増悪及び神経学的合併症リスク)があることから、本剤投与
後にMELAS又はMIDDを示唆する症状が現れた場合は、直
ちに本剤投与を中止し、診断評価を行うことが追記された。
その他
対応中
68 メトトレキサート
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
①Special warnings and precautions for useの項に、光線過
敏症が追記された。
オーストラリ
②Interactions with other medicines and other forms of
その他
ア
interactionsの項に、血液毒性を有する医薬品との相互作用
により、重篤な血液毒性の副作用の可能性が高まること、メト
トレキサートをレフルノミドと併用すると、汎血球減少症及び
間質性肺炎のリスクが高まる可能性がある旨が追記された。
対応中
8
(2025年4月1日~2025年7月31日)
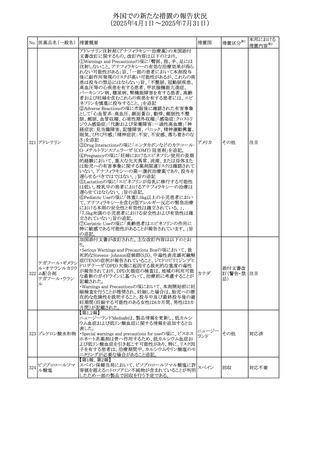
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
欧州PRACが欧州添付文書の改訂を勧告した。主な内容は
テガフール・ギメラシ
以下のとおり。
59 ル・オテラシルカリウ
欧州連合 その他
・Special warnings and precautions for use、Undesirable
ム配合剤
effectsの項に高アンモニア血症を追記
豪州添付文書のSpecial warnings and precautions for use及
オーストラリ
60 メサラジン
びAdverse effects(undesirable effects)に特発性頭蓋内圧
その他
ア
亢進症が追記された。
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Special warnings and precautions for useの項に、遺伝毒
タモキシフェンクエ 性があるため、投与中及び最終投与後の避妊期間(妊娠の オーストラリ
61
その他
ン酸塩
可能性のある女性は9カ月間、男性は6カ月間)が記載され ア
た。また、投与中は妊娠しないよう助言すること、避妊はバリ
ア法、その他の非ホルモン性避妊法を使用することが記載
された。
豪州添付文書が改訂され、Special warnings and
セファゾリンナトリウ
オーストラリ
62
precautions for use及びAdverse effects (undesirable
その他
ム
ア
effects)の項にコーニス症候群が追記された。
メトロニダゾールの豪州添付文書が改訂された。主な改訂
内容は以下のとおり。
ボノプラザンフマル ・Contraindicationsの項にコケイン症候群の患者を追記。
添付文書改
酸塩・アモキシシリ ・Contraindications及びAdverse effects (undesirable
オーストラリ
63
訂(警告・禁
ン水和物・メトロニダ effects)の項に、コケイン症候群患者へのメトロニダゾールの ア
忌)
ゾール
全身使用において、急速に発症し致死的転帰を伴う症例を
含む、重度の不可逆的肝毒性、急性肝不全の症例が報告
されている旨を追記。
64 ミルタザピン
65 カルバマゼピン
66 タクロリムス水和物
FAERSデータベースで特定されたシグナルに関する報告。
・中止時に出現するカタプレキシーのシグナルについて、措 アメリカ
置の必要性を評価しているとのこと。
その他
ニュージーランドMedsafeは、Safety Informationでカルバマ
ゼピンに対する注意喚起のための情報を発出した。
・最近の観察研究により、出生前のカルバマゼピン曝露が、
ニュージー
一般集団及びてんかん患者の児の両方において、妊娠期
その他
ランド
間に比して小さい児として生まれるリスク増加、又は小頭症
で生まれる児のリスク増加と関連している可能性が判明し
た。
【第1報】
独BfArMは、医薬品の安全性に関する報告書(2025年3月)
に、現在のリスク情報として欧州EMAのPRACによる評価の
結果、タクロリムス(全身投与製剤)とカポジ肉腫との間の因
果関係について、少なくとも合理的な可能性があるとの見解 ドイツ、
その他
を掲載した。
欧州連合
【第2報】
タクロリムス徐放性カプセルの欧州添付文書のSpecial
warnings and precautions for use及びUndesirable effectsに
カポジ肉腫が追記された。
本邦における
措置内容※2
対応中
注目
対応済
対応済
注目
注目
注目
対応済
67 メトホルミン塩酸塩
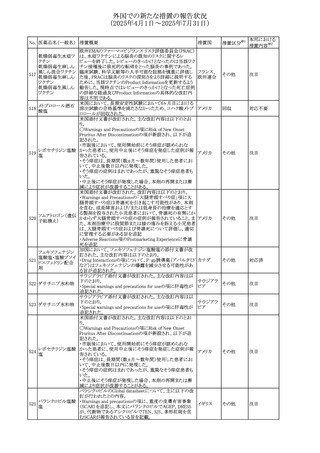
欧州添付文書が改訂された。改訂内容は以下のとおり。
・Special warnings and precautions for use の項に、ミトコンド
リア脳筋症・乳酸アシドーシス・脳卒中様発作症候群
(MELAS)及びミトコンドリア糖尿病(MIDD)のミトコンドリア病
欧州連合
患者において、MELAS又はMIDDの悪化(乳酸アシドーシス
増悪及び神経学的合併症リスク)があることから、本剤投与
後にMELAS又はMIDDを示唆する症状が現れた場合は、直
ちに本剤投与を中止し、診断評価を行うことが追記された。
その他
対応中
68 メトトレキサート
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
①Special warnings and precautions for useの項に、光線過
敏症が追記された。
オーストラリ
②Interactions with other medicines and other forms of
その他
ア
interactionsの項に、血液毒性を有する医薬品との相互作用
により、重篤な血液毒性の副作用の可能性が高まること、メト
トレキサートをレフルノミドと併用すると、汎血球減少症及び
間質性肺炎のリスクが高まる可能性がある旨が追記された。
対応中
8