よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (70 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
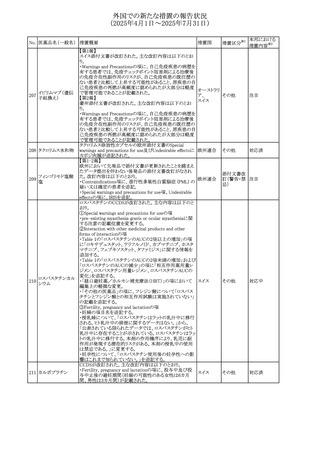
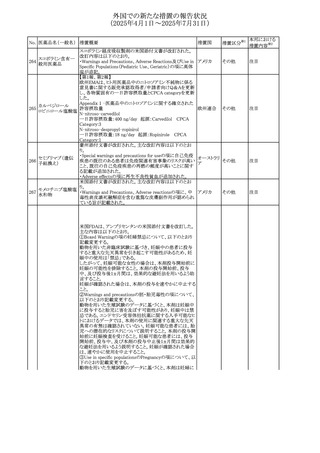
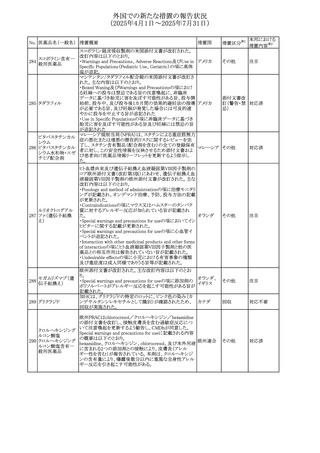
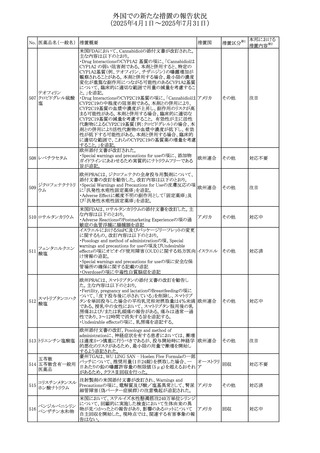
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
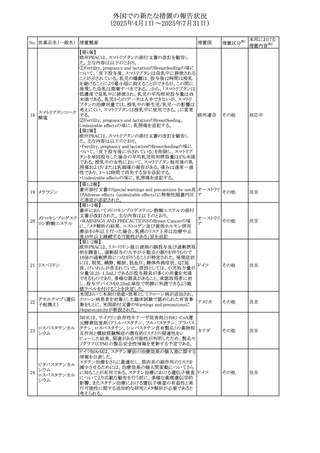
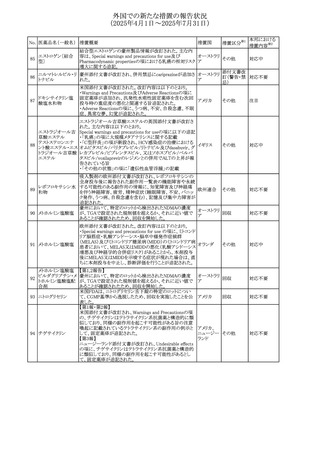
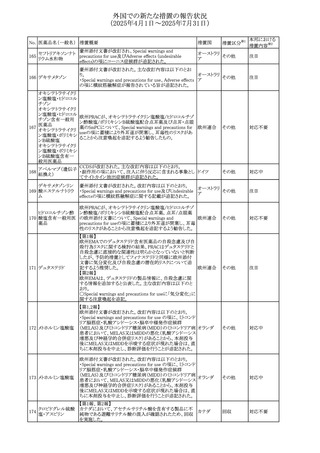
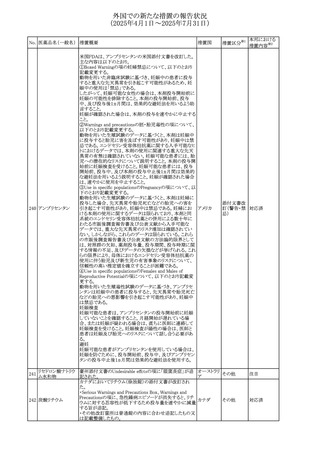
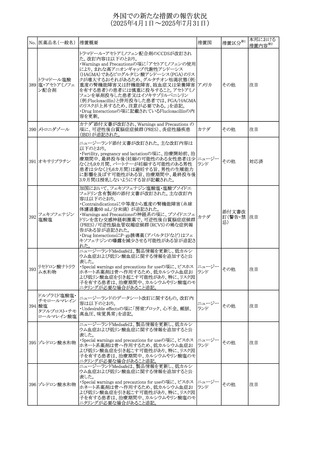
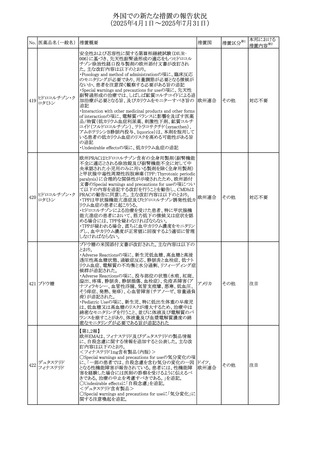
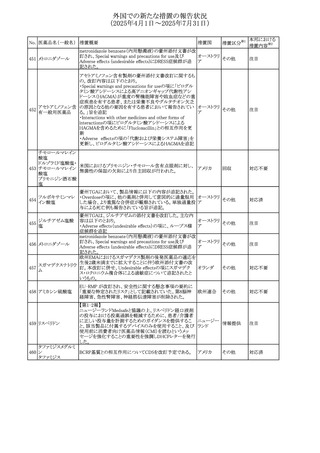
No. 医薬品名(一般名) 措置概要
措置国
米国FDAにおいて、Cannabidiolの添付文書が改訂された。
主な内容は以下のとおり。
・Drug InteractionsのCYP1A2 基質の項に、「Cannabidiolは
CYP1A2 の弱い阻害剤である。本剤と併用すると、特定の
CYP1A2基質(例、テオフィリン、チザニジン)の曝露増加が
観察されることがある。本剤と併用する場合、最小限の濃度
変化が重篤な副作用につながる可能性のあるCYP1A2基質
について、臨床的に適切な範囲で用量の減量を考慮するこ
テオフィリン
と。」を追記。
507 クロピドグレル硫酸 ・Drug InteractionsのCYP2C19基質の項に、「Cannabidiolは アメリカ
塩
CYP2C19の中程度の阻害剤である。本剤との併用により、
CYP2C19基質の血漿中濃度が上昇し、副作用のリスクが高
まる可能性がある。本剤と併用する場合、臨床的に適切な
CYP2C19基質の減量を考慮すること。 有効性が主に活性
代謝物によるCYP2C19基質(例:クロピドグレル)の場合、本
剤との併用により活性代謝物の血漿中濃度が低下し、有効
性が低下する可能性がある。本剤と併用する場合、臨床的
に適切な範囲で、これらのCYP2C19の基質薬の増量を考慮
すること。」を追記。
欧州添付文書が改訂された。
・Special warnings and precautions for useの項に、添加物
508 レベチラセタム
欧州連合
ガイドラインにあわせるため実質的にナトリウムフリーである
旨が追記。
欧州PRACは、ジクロフェナクの全身投与用製剤について、
添付文書の改訂を勧告した。改訂内容は以下のとおり。
ジクロフェナクナトリ ・Special Warnings and Precautions for Useの皮膚反応の項
509
欧州連合
ウム
に「汎発性水疱性固定薬疹」を追記。
・Adverse Effectに頻度不明の副作用として「固定薬疹」及
び「汎発性水疱性固定薬疹」を追記。
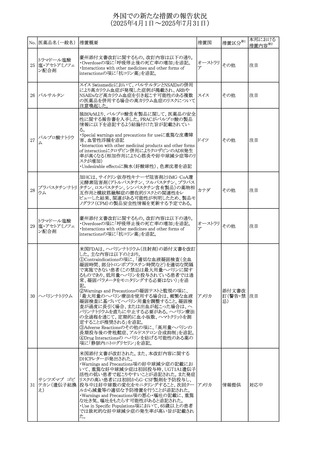
510 ロサルタンカリウム
511
フェンタニルクエン
酸塩
措置区分※1
本邦における
措置内容※2
その他
注目
その他
対応不要
その他
注目
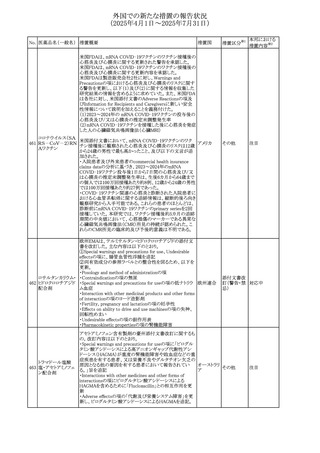
米国FDAは、ロサルタンカリウムの添付文書を改訂した。主
な内容は以下のとおり。
アメリカ
その他
・Adverse ReactionsのPostmarketing Experienceの項の過
敏症の血管浮腫に腸腫脹を追記
イスラエルにおけるSmPC及びパッケージリーフレットの変更
に関するもの。改訂内容は以下のとおり。
・Posology and method of administrationの項、Special
warnings and precautions for useの項及びUndesirable
effectsの項にオピオイド使用障害(OUD)に関する処方医向 イスラエル その他
け情報の追記。
・Special warnings and precautions for useの項に安全な保
管場所の確保に関する記載の追記
・Overdoseの項に中毒性白質脳症を追記
欧州PRACは、スマトリプタンの添付文書の改訂を勧告し
た。主な内容は以下のとおり。
・Fertility, pregnancy and lactationのBreastfeedingの項に
ついて、「皮下投与後に示されている」を削除し、スマトリプ
スマトリプタンコハク
512
タンを単回投与した場合の平均乳児相対摂取量は4%未満 欧州連合
酸塩
である。授乳中の女性において、スマトリプタン服用後の乳
房痛および/または乳頭痛の報告がある。痛みは通常一過
性であり、3~12時間で消失する旨を追記する。
・Undesirable effectsの項に、乳房痛を追記する。
その他
欧州添付文書の改訂。Posology and method of
administrationに、神経症状を有する患者においては、漸増
513 トリエンチン塩酸塩 は適度かつ慎重に行うべきであるが、投与開始時に神経学 欧州連合 その他
的悪化のリスクがあるため、最小限の用量で漸増を開始し
するよう追記された。
豪州TGAは、WU LING SAN - Hoelen Five Formulaの一部
五苓散
バッチについて、推奨用量(1日24錠)を摂取した場合、一 オーストラリ
514 五苓散含有一般用
回収
日あたりの鉛の曝露許容量の制限値(5μg)を超えるおそれ ア
医薬品
があるため、クラスⅡ回収を行った。
515
注射製剤の米国添付文書が改訂され、Warnings and
コリスチンメタンスル
Precautionsの項に、電解質及び酸/塩基異常として、腎尿 アメリカ
ホン酸ナトリウム
細管障害(偽バーター症候群)の注意喚起が追記された。
米国において、ステルイズ水性懸濁筋注240万単位シリンジ
について、回顧的に実施した検査において生体由来の異
ベンジルペニシリン
516
物が見つかったとの報告があり、影響のあるロットについて アメリカ
ベンザチン水和物
自主回収を開始した。現時点では、関連する有害事象の報
告はない。
70
対応中
対応済
対応中
注目
対応不要
その他
対応済
回収
対応中
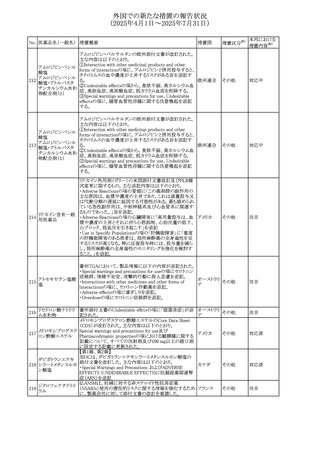
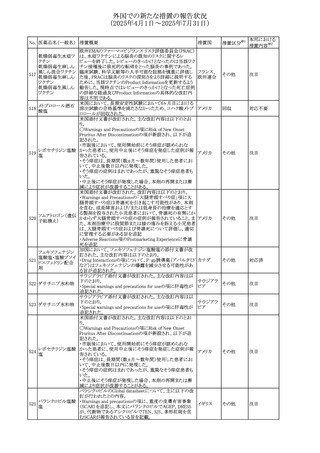
(2025年4月1日~2025年7月31日)
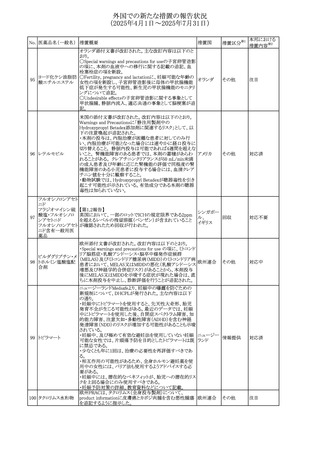
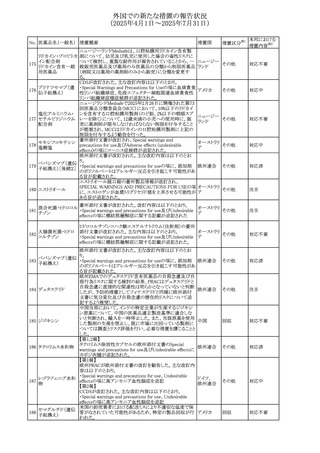
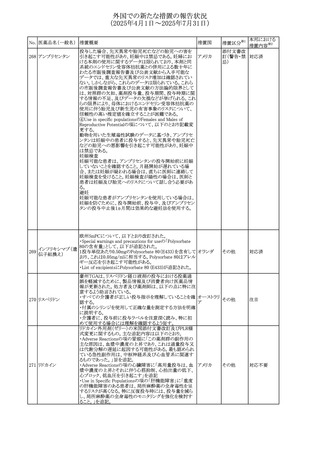
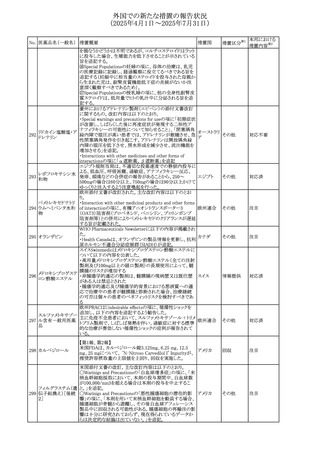
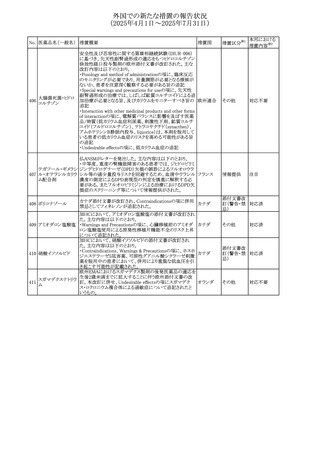
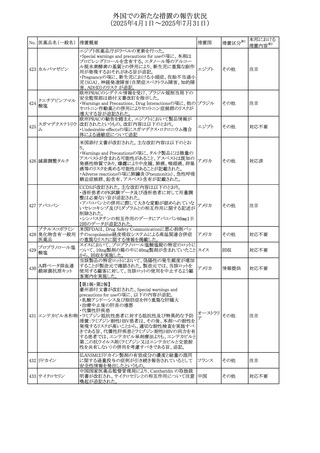
No. 医薬品名(一般名) 措置概要
措置国
米国FDAにおいて、Cannabidiolの添付文書が改訂された。
主な内容は以下のとおり。
・Drug InteractionsのCYP1A2 基質の項に、「Cannabidiolは
CYP1A2 の弱い阻害剤である。本剤と併用すると、特定の
CYP1A2基質(例、テオフィリン、チザニジン)の曝露増加が
観察されることがある。本剤と併用する場合、最小限の濃度
変化が重篤な副作用につながる可能性のあるCYP1A2基質
について、臨床的に適切な範囲で用量の減量を考慮するこ
テオフィリン
と。」を追記。
507 クロピドグレル硫酸 ・Drug InteractionsのCYP2C19基質の項に、「Cannabidiolは アメリカ
塩
CYP2C19の中程度の阻害剤である。本剤との併用により、
CYP2C19基質の血漿中濃度が上昇し、副作用のリスクが高
まる可能性がある。本剤と併用する場合、臨床的に適切な
CYP2C19基質の減量を考慮すること。 有効性が主に活性
代謝物によるCYP2C19基質(例:クロピドグレル)の場合、本
剤との併用により活性代謝物の血漿中濃度が低下し、有効
性が低下する可能性がある。本剤と併用する場合、臨床的
に適切な範囲で、これらのCYP2C19の基質薬の増量を考慮
すること。」を追記。
欧州添付文書が改訂された。
・Special warnings and precautions for useの項に、添加物
508 レベチラセタム
欧州連合
ガイドラインにあわせるため実質的にナトリウムフリーである
旨が追記。
欧州PRACは、ジクロフェナクの全身投与用製剤について、
添付文書の改訂を勧告した。改訂内容は以下のとおり。
ジクロフェナクナトリ ・Special Warnings and Precautions for Useの皮膚反応の項
509
欧州連合
ウム
に「汎発性水疱性固定薬疹」を追記。
・Adverse Effectに頻度不明の副作用として「固定薬疹」及
び「汎発性水疱性固定薬疹」を追記。
510 ロサルタンカリウム
511
フェンタニルクエン
酸塩
措置区分※1
本邦における
措置内容※2
その他
注目
その他
対応不要
その他
注目
米国FDAは、ロサルタンカリウムの添付文書を改訂した。主
な内容は以下のとおり。
アメリカ
その他
・Adverse ReactionsのPostmarketing Experienceの項の過
敏症の血管浮腫に腸腫脹を追記
イスラエルにおけるSmPC及びパッケージリーフレットの変更
に関するもの。改訂内容は以下のとおり。
・Posology and method of administrationの項、Special
warnings and precautions for useの項及びUndesirable
effectsの項にオピオイド使用障害(OUD)に関する処方医向 イスラエル その他
け情報の追記。
・Special warnings and precautions for useの項に安全な保
管場所の確保に関する記載の追記
・Overdoseの項に中毒性白質脳症を追記
欧州PRACは、スマトリプタンの添付文書の改訂を勧告し
た。主な内容は以下のとおり。
・Fertility, pregnancy and lactationのBreastfeedingの項に
ついて、「皮下投与後に示されている」を削除し、スマトリプ
スマトリプタンコハク
512
タンを単回投与した場合の平均乳児相対摂取量は4%未満 欧州連合
酸塩
である。授乳中の女性において、スマトリプタン服用後の乳
房痛および/または乳頭痛の報告がある。痛みは通常一過
性であり、3~12時間で消失する旨を追記する。
・Undesirable effectsの項に、乳房痛を追記する。
その他
欧州添付文書の改訂。Posology and method of
administrationに、神経症状を有する患者においては、漸増
513 トリエンチン塩酸塩 は適度かつ慎重に行うべきであるが、投与開始時に神経学 欧州連合 その他
的悪化のリスクがあるため、最小限の用量で漸増を開始し
するよう追記された。
豪州TGAは、WU LING SAN - Hoelen Five Formulaの一部
五苓散
バッチについて、推奨用量(1日24錠)を摂取した場合、一 オーストラリ
514 五苓散含有一般用
回収
日あたりの鉛の曝露許容量の制限値(5μg)を超えるおそれ ア
医薬品
があるため、クラスⅡ回収を行った。
515
注射製剤の米国添付文書が改訂され、Warnings and
コリスチンメタンスル
Precautionsの項に、電解質及び酸/塩基異常として、腎尿 アメリカ
ホン酸ナトリウム
細管障害(偽バーター症候群)の注意喚起が追記された。
米国において、ステルイズ水性懸濁筋注240万単位シリンジ
について、回顧的に実施した検査において生体由来の異
ベンジルペニシリン
516
物が見つかったとの報告があり、影響のあるロットについて アメリカ
ベンザチン水和物
自主回収を開始した。現時点では、関連する有害事象の報
告はない。
70
対応中
対応済
対応中
注目
対応不要
その他
対応済
回収
対応中