よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
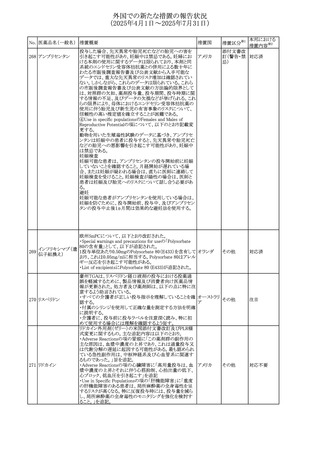
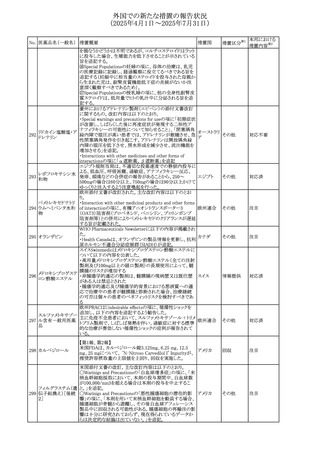
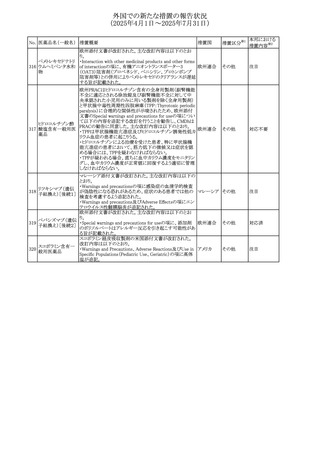
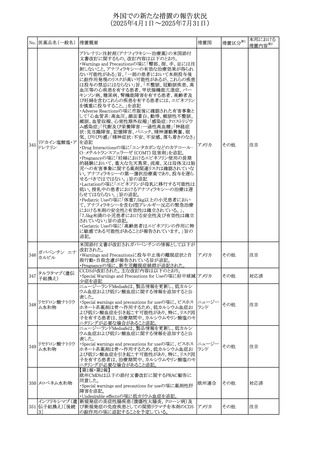
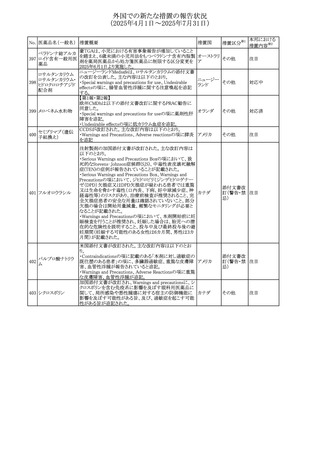
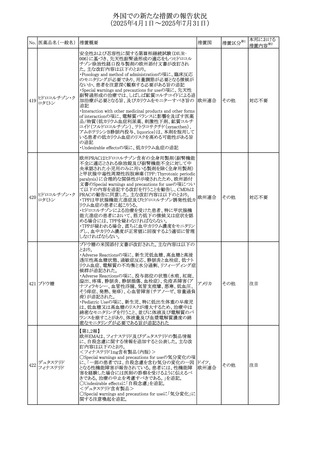
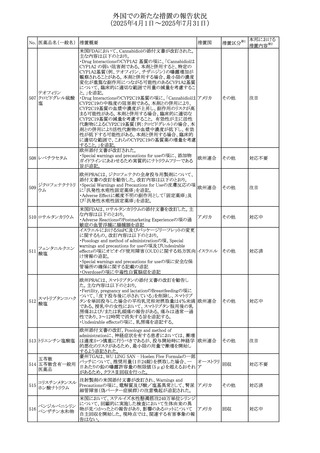
させるため、骨粗鬆症の発症又は悪化させる可能性がある
旨を追記する。
⑬Warnings and Precautionsの項に、長期使用により、後嚢
白内障、緑内障、眼球突出症、眼圧上昇が発現する可能性
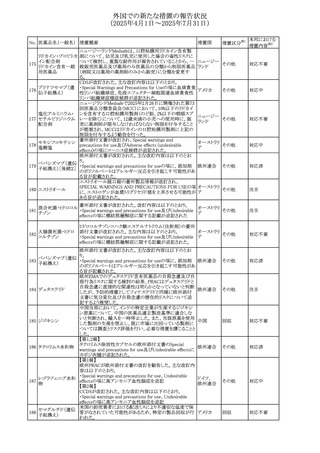
外国での新たな措置の報告状況
がある旨、中心性漿液性脈絡網膜症と関連しており、網膜
(2025年4月1日~2025年7月31日)
剥離を引き起こす可能性がある旨を追記する。
⑭Warnings and Precautionsの項に、抗うつ薬の使用は、副
腎皮質ステロイド誘発性の精神障害を悪化させる可能性が
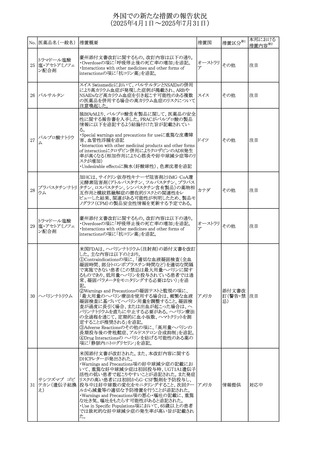
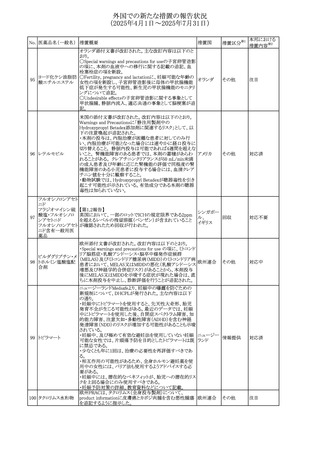
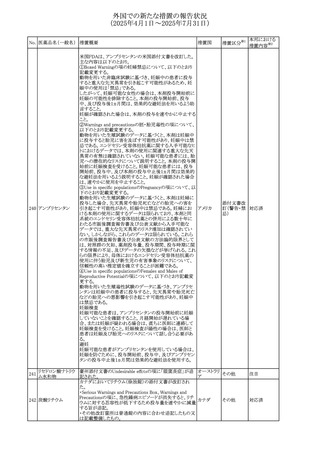
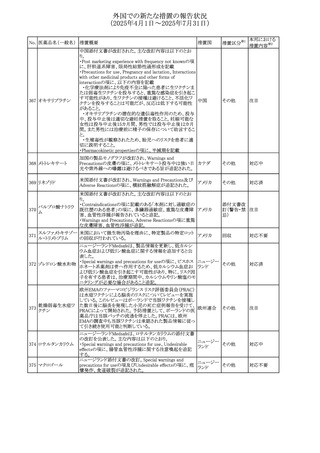
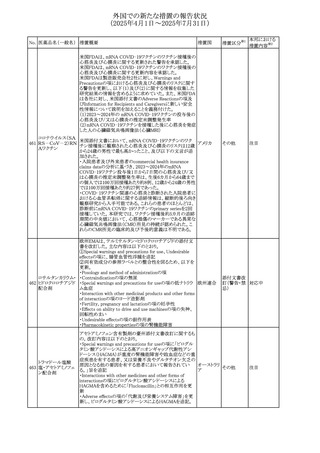
No. 医薬品名(一般名) ある旨を追記する。
措置概要
措置国
措置区分※1
⑮Warnings and Precautionsの項に、本剤がヒトの生殖能力
を損なうかどうかは不明であるが、コルチコステロイドはラット
に投与した場合、生殖能力を低下させることが示されている
旨を追記する。
⑯Special Populationsの妊婦の項に、母体の治療は、乳児
の医療記録に記録し、経過観察に役立てるべきである旨を
追記する(妊娠中に相当量のステロイドを投与された母親か
ら生まれた児は、副腎皮質機能低下症の兆候がないか注
意深く観察すべきであるため)。
⑰Special Populationsの授乳婦の項に、他の全身性副腎皮
質ステロイドは、低用量でヒトの乳汁中に分泌される旨を追
記する。
豪州におけるアドレナリン製剤(エピペン)の添付文書改訂
に関するもの。改訂内容は以下のとおり。
・Special warnings and precautions for useの項に「初期症状
が改善し、しばらくした後に再度症状が発現する二相性ア
ナフィラキシーの可能性について知らせること」、「閉塞隅角
リドカイン塩酸塩・ア
オーストラリ
292
緑内障で眼圧が高い患者では、アドレナリンが散瞳させ、急
その他
ドレナリン
ア
性閉塞隅角発作を引き起こす。アドレナリンは開放隅角緑
内障の眼圧を低下させ、房水形成を減少させ、流出機能を
増加させる」を追記。
・Interactions with other medicines and other forms of
interactionsの項に「α遮断薬、β遮断薬」を追記
エジプト規制当局は、不適切な投薬速度での静脈内投与に
よる、低血圧、呼吸困難、過敏症、アナフィラキシー反応、
レボフロキサシン水
293
発疹、頭痛などの合併症の報告があることから、250~
エジプト
その他
和物
500mgの場合は60分以上、750mgの場合は90分以上かけて
ゆっくりと注入するよう注意喚起を行った。
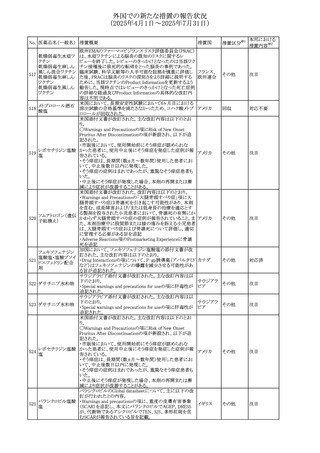
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
ペメトレキセドナトリ ・Interaction with other medicinal products and other forms
294 ウムヘミペンタ水和 of interactionの項に、有機アニオントランスポーター3
欧州連合 その他
物
(OAT3)阻害剤(プロベネシド、ペニシリン、プロトンポンプ
阻害剤等)との併用によりペメトレキセドのクリアランスが遅延
する旨が記載された。
WHO Pharmaceuticals Newsletterに以下の内容が掲載され
た。
295 オランザピン
カナダ
その他
・Health Canadaは、オランザピンの製品情報を更新し、抗利
尿ホルモン不適合分泌症候群(SIADH)が追記。
スイスSwissmedicはメドロキシプロゲステロン酢酸エステルに
ついて以下の内容を公表した。
・高用量メドロキシプロゲステロン酢酸エステル(全ての注射
製剤及び100mg以上の経口製剤)の長期使用によって、髄
膜腫のリスクが増加する
メドロキシプロゲステ
296
・非腫瘍学的適応の製剤は、髄膜腫の現病歴又は既往歴 スイス
情報提供
ロン酢酸エステル
がある人は禁忌とされた
・腫瘍学的適応及び腫瘍学的背景における悪液質への適
応で治療中の患者が髄膜腫と診断された場合、治療継続
の可否は個々の患者のベネフィットリスクを検討すべきであ
る
欧州PRACはUndesirable effectsの項に、循環性ショックを
追加し、以下の内容を追記するよう勧告した。
スルファメトキサゾー
主に免疫不全患者において、スルファメトキサゾール+トリメ
297 ル含有一般用医薬
欧州連合 その他
トプリム製剤で、しばしば発熱を伴い、過敏症に対する標準
品
的な治療が奏効しない循環性ショックの症例が報告されて
いる。
298 カルベジロール
【第1報、第2報】
米国FDAは、カルベジロール錠3.125mg、6.25 mg、12.5
アメリカ
mg、25 mgについて、 'N-Nitroso Carvedilol I' Impurityが、
推奨許容摂取量の上限値を上回り、回収を実施した。
米国添付文書の改訂。主な改訂内容は以下のとおり。
〇Warinigs and Precautionsの「白血球増多症」の項に、「末
梢血幹細胞採取において、本剤の投与期間中、白血球数
が100,000/mm3を超える場合は本剤の投与を中止するこ
フィルグラスチム(遺 と。」を追記。
299 伝子組換え)[後続 〇Warinigs and Precautionsの「悪性腫瘍細胞の潜在的影 アメリカ
2]
響」の項に、「本剤を用いて末梢血幹細胞を動員する場合、
腫瘍細胞が骨髄から遊離し、その後白血球アフェレーシス
製品中に回収される可能性がある。腫瘍細胞の再輸注の影
響は十分に研究されておらず、現在得られているデータか
らは決定的な結論は出ていない。」を追記。
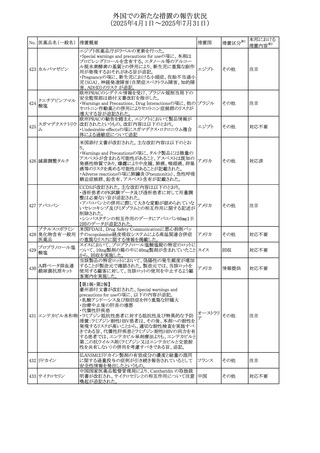
37
本邦における
措置内容※2
対応不要
対応済
注目
注目
対応済
対応済
回収
注目
その他
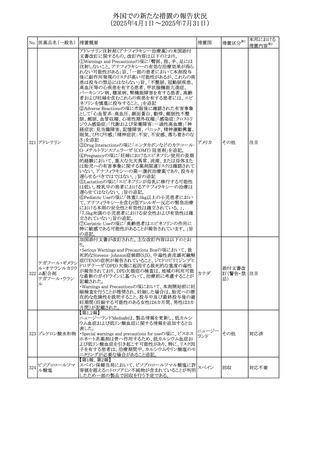
注目
旨を追記する。
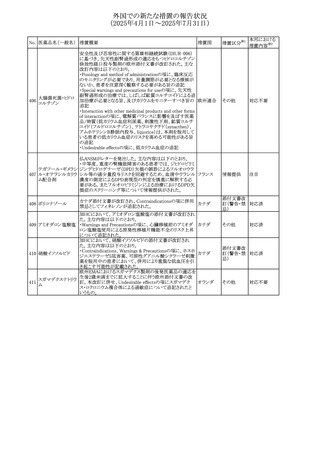
⑬Warnings and Precautionsの項に、長期使用により、後嚢
白内障、緑内障、眼球突出症、眼圧上昇が発現する可能性
外国での新たな措置の報告状況
がある旨、中心性漿液性脈絡網膜症と関連しており、網膜
(2025年4月1日~2025年7月31日)
剥離を引き起こす可能性がある旨を追記する。
⑭Warnings and Precautionsの項に、抗うつ薬の使用は、副
腎皮質ステロイド誘発性の精神障害を悪化させる可能性が
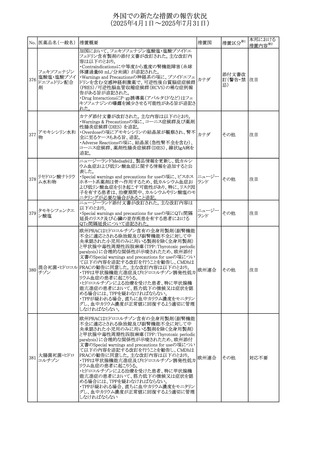
No. 医薬品名(一般名) ある旨を追記する。
措置概要
措置国
措置区分※1
⑮Warnings and Precautionsの項に、本剤がヒトの生殖能力
を損なうかどうかは不明であるが、コルチコステロイドはラット
に投与した場合、生殖能力を低下させることが示されている
旨を追記する。
⑯Special Populationsの妊婦の項に、母体の治療は、乳児
の医療記録に記録し、経過観察に役立てるべきである旨を
追記する(妊娠中に相当量のステロイドを投与された母親か
ら生まれた児は、副腎皮質機能低下症の兆候がないか注
意深く観察すべきであるため)。
⑰Special Populationsの授乳婦の項に、他の全身性副腎皮
質ステロイドは、低用量でヒトの乳汁中に分泌される旨を追
記する。
豪州におけるアドレナリン製剤(エピペン)の添付文書改訂
に関するもの。改訂内容は以下のとおり。
・Special warnings and precautions for useの項に「初期症状
が改善し、しばらくした後に再度症状が発現する二相性ア
ナフィラキシーの可能性について知らせること」、「閉塞隅角
リドカイン塩酸塩・ア
オーストラリ
292
緑内障で眼圧が高い患者では、アドレナリンが散瞳させ、急
その他
ドレナリン
ア
性閉塞隅角発作を引き起こす。アドレナリンは開放隅角緑
内障の眼圧を低下させ、房水形成を減少させ、流出機能を
増加させる」を追記。
・Interactions with other medicines and other forms of
interactionsの項に「α遮断薬、β遮断薬」を追記
エジプト規制当局は、不適切な投薬速度での静脈内投与に
よる、低血圧、呼吸困難、過敏症、アナフィラキシー反応、
レボフロキサシン水
293
発疹、頭痛などの合併症の報告があることから、250~
エジプト
その他
和物
500mgの場合は60分以上、750mgの場合は90分以上かけて
ゆっくりと注入するよう注意喚起を行った。
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
ペメトレキセドナトリ ・Interaction with other medicinal products and other forms
294 ウムヘミペンタ水和 of interactionの項に、有機アニオントランスポーター3
欧州連合 その他
物
(OAT3)阻害剤(プロベネシド、ペニシリン、プロトンポンプ
阻害剤等)との併用によりペメトレキセドのクリアランスが遅延
する旨が記載された。
WHO Pharmaceuticals Newsletterに以下の内容が掲載され
た。
295 オランザピン
カナダ
その他
・Health Canadaは、オランザピンの製品情報を更新し、抗利
尿ホルモン不適合分泌症候群(SIADH)が追記。
スイスSwissmedicはメドロキシプロゲステロン酢酸エステルに
ついて以下の内容を公表した。
・高用量メドロキシプロゲステロン酢酸エステル(全ての注射
製剤及び100mg以上の経口製剤)の長期使用によって、髄
膜腫のリスクが増加する
メドロキシプロゲステ
296
・非腫瘍学的適応の製剤は、髄膜腫の現病歴又は既往歴 スイス
情報提供
ロン酢酸エステル
がある人は禁忌とされた
・腫瘍学的適応及び腫瘍学的背景における悪液質への適
応で治療中の患者が髄膜腫と診断された場合、治療継続
の可否は個々の患者のベネフィットリスクを検討すべきであ
る
欧州PRACはUndesirable effectsの項に、循環性ショックを
追加し、以下の内容を追記するよう勧告した。
スルファメトキサゾー
主に免疫不全患者において、スルファメトキサゾール+トリメ
297 ル含有一般用医薬
欧州連合 その他
トプリム製剤で、しばしば発熱を伴い、過敏症に対する標準
品
的な治療が奏効しない循環性ショックの症例が報告されて
いる。
298 カルベジロール
【第1報、第2報】
米国FDAは、カルベジロール錠3.125mg、6.25 mg、12.5
アメリカ
mg、25 mgについて、 'N-Nitroso Carvedilol I' Impurityが、
推奨許容摂取量の上限値を上回り、回収を実施した。
米国添付文書の改訂。主な改訂内容は以下のとおり。
〇Warinigs and Precautionsの「白血球増多症」の項に、「末
梢血幹細胞採取において、本剤の投与期間中、白血球数
が100,000/mm3を超える場合は本剤の投与を中止するこ
フィルグラスチム(遺 と。」を追記。
299 伝子組換え)[後続 〇Warinigs and Precautionsの「悪性腫瘍細胞の潜在的影 アメリカ
2]
響」の項に、「本剤を用いて末梢血幹細胞を動員する場合、
腫瘍細胞が骨髄から遊離し、その後白血球アフェレーシス
製品中に回収される可能性がある。腫瘍細胞の再輸注の影
響は十分に研究されておらず、現在得られているデータか
らは決定的な結論は出ていない。」を追記。
37
本邦における
措置内容※2
対応不要
対応済
注目
注目
対応済
対応済
回収
注目
その他
注目