よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
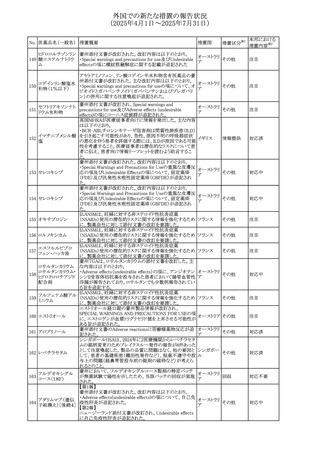
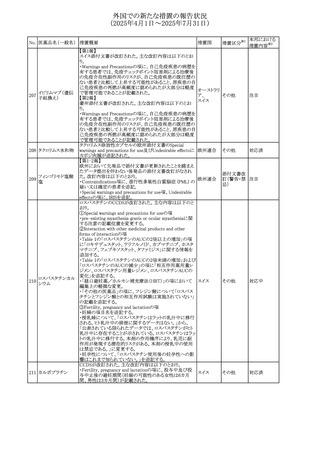
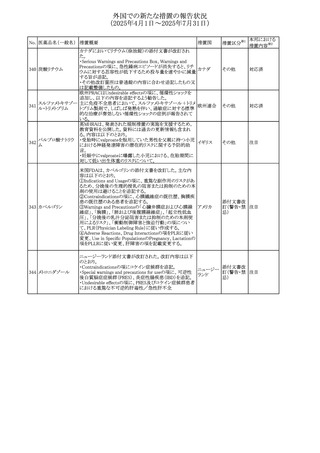
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
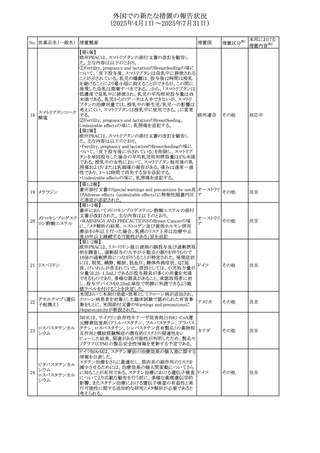
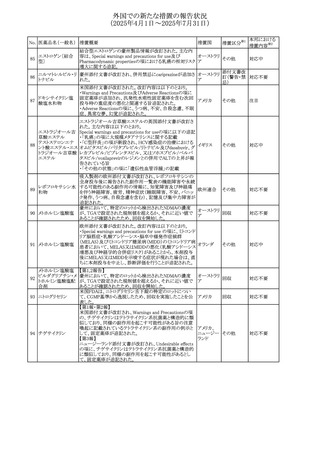
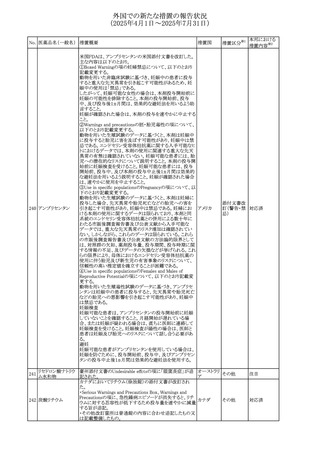
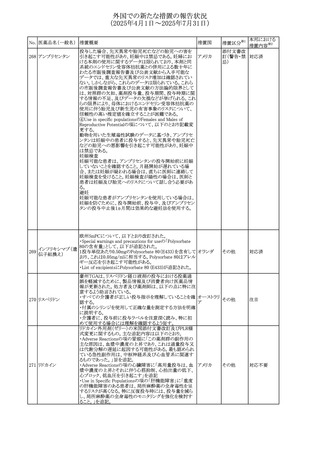
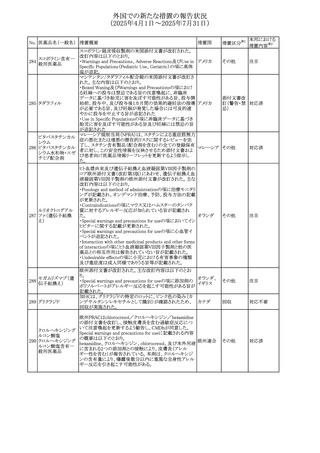
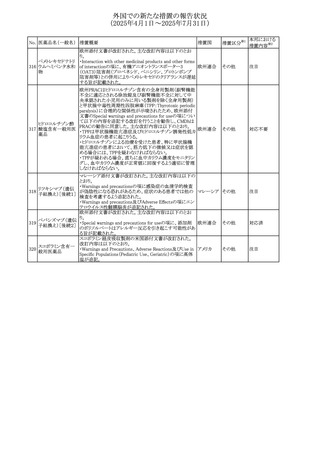
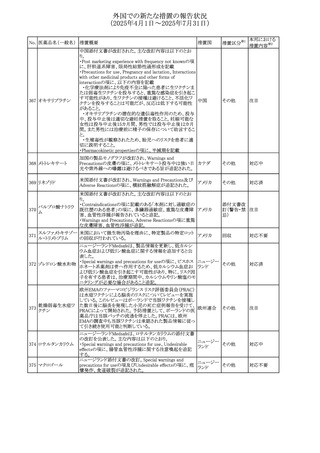
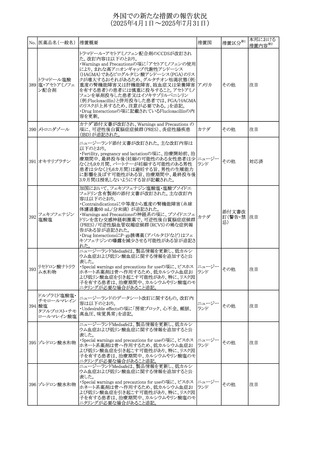
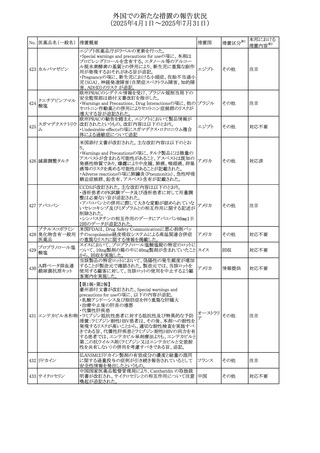
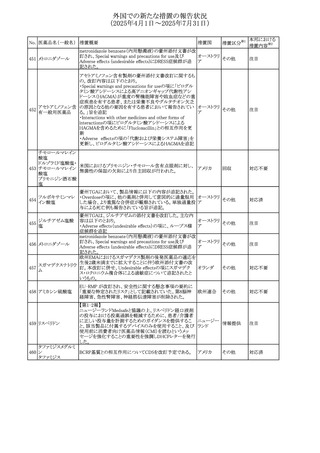
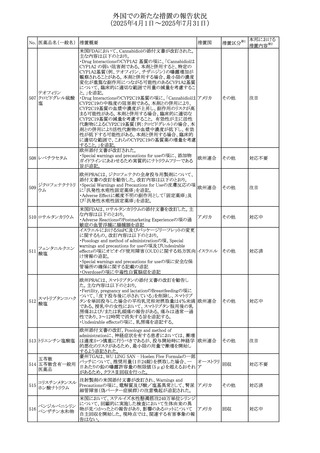
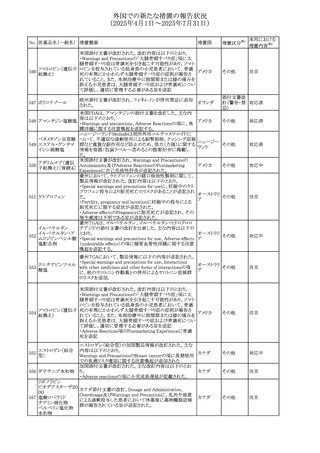
No. 医薬品名(一般名) 措置概要
284
スコポラミン含有一
般用医薬品
285 タダラフィル
ピタバスタチンカル
シウム
286 ピタバスタチンカル
シウム水和物・エゼ
チミブ配合剤
ルリオクトコグアル
287 ファ(遺伝子組換
え)
288
モガムリズマブ(遺
伝子組換え)
289 グリクラジド
措置国
措置区分※1
本邦における
措置内容※2
スコポラミン経皮吸収製剤の米国添付文書が改訂された。
改訂内容は以下のとおり。
・Warnings and Precautions、Adverse Reactions及びUse in アメリカ
その他
注目
Specific Populations(Pediatric Use、Geriatric)の項に高体
温が追記。
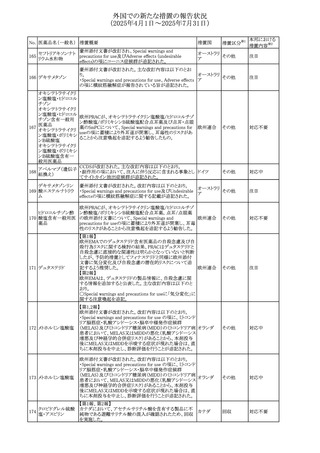
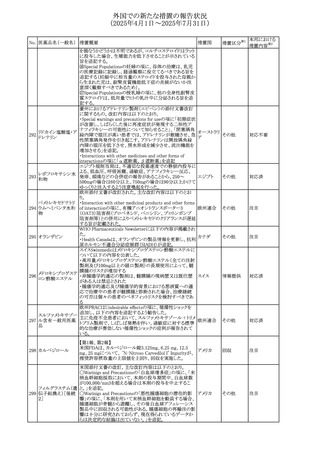
マシテンタン/タダラフィル配合錠の米国添付文書が改訂さ
れた。主な内容は以下のとおり。
・Boxed Waning及びWarnings and Precautionsの項におけ
る妊婦への投与は禁忌である旨の注意喚起に、非臨床
データに基づき胎児に害を及ぼす可能性がある旨、投与開
添付文書改
始前、投与中、及び投与後1カ月間の効果的避妊法の指導 アメリカ
訂(警告・禁 対応済
が必要である旨、及び妊娠が発覚した場合には可及的速
忌)
やかに投与を中止する旨が追記された
・Use in Specific Populationsの項に非臨床データに基づき
胎児に害を及ぼす可能性がある旨及び妊婦には禁忌の旨
が追記された
マレーシア規制当局(NPRA)は、スタチンによる重症筋無力
症の悪化または増悪の潜在的リスクに関するレビューを完
了し、スタチン含有製品(配合剤を含む)の全ての登録保有
マレーシア その他
対応済
者に対し、この安全性情報を反映させるため添付文書およ
び患者向け医薬品情報リーフレットを更新するよう指示し
た。
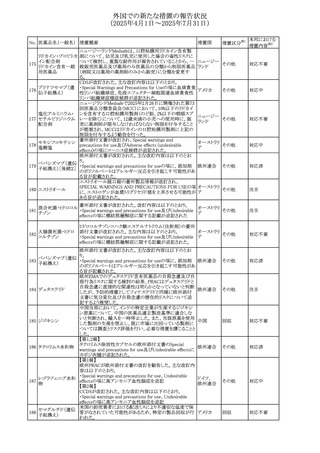
ヒト血漿由来及び遺伝子組換え血液凝固第VIII因子製剤の
コア欧州添付文書(改訂第3版)にあわせ、遺伝子組換え血
液凝固第VIII因子製剤の欧州添付文書が改訂された。主な
改訂内容は以下のとおり。
・Posology and method of administrationの項に治療モニタリ
ングが記載され、オンデマンド治療、予防、投与方法の記載
が更新された。
・Contraindicationsの項にマウス又はハムスターのタンパク
質に対するアレルギー反応が知られている旨が記載され
た。
オランダ
・Special warnings and precautions for useの項においてイン
ヒビターに関する記載が更新された。
・Special warnings and precautions for useの項に心血管イ
ベントが追記された。
・Interaction with other medicinal products and other forms
of interactionの項にヒト血液凝固第VIII因子製剤と他の医
薬品との相互作用は報告されていない旨が記載された。
・Undesirable effectsの項に小児における有害事象の種類
及び重症度は成人同様でありうる旨等が記載された。
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
オランダ、
・Special warnings and precautions for useの項に添加剤の
イギリス
ポリソルベートがアレルギー反応を起こす可能性がある旨が
記載された。
加HCは、グリクラジドの特定のロットに、ピンク色の染み(カ
ンデサルタンシレキセチルとして識別)が確認されたため、 カナダ
回収が実施された。
欧州PRACはchlorocresol/クロルヘキシジン/hexamidine
の添付文書を改訂し、接触皮膚炎を含む過敏症反応につ
いて注意喚起を更新するよう勧告し、CMDhが同意した。
クロルヘキシジング
Special warnings and precautions for useに記載される内容
ルコン酸塩
の概要は以下のとおり。
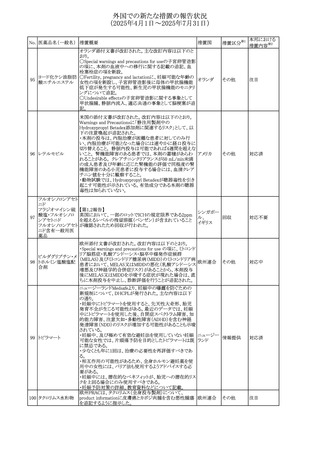
290 クロルヘキシジング
欧州連合
hexamidine、クロルヘキシジン、chlorocresol、及び本外用液
ルコン酸塩含有一
に含まれる2つの添加剤との接触により、皮膚炎(アレル
般用医薬品
ギー性を含む)が報告されている。本剤は、クロルヘキシジ
ンの含有量により、曝露後数分以内に重篤な全身性アレル
ギー反応を引き起こす可能性がある。
35
その他
注目
その他
注目
回収
対応不要
その他
対応済
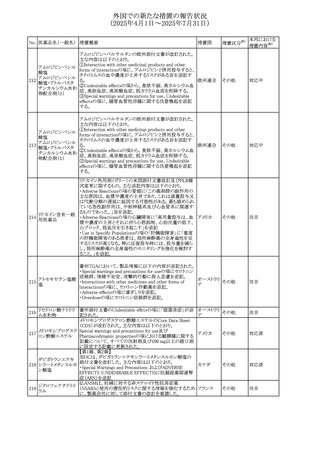
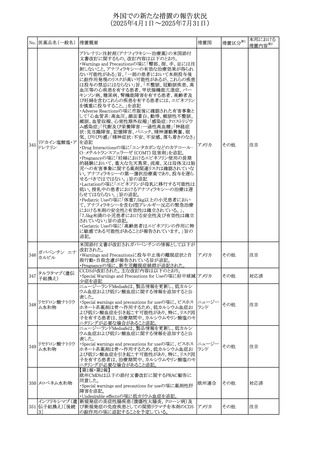
(2025年4月1日~2025年7月31日)
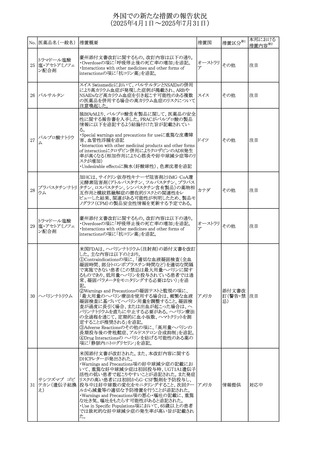
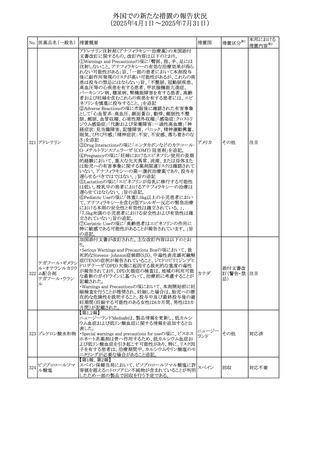
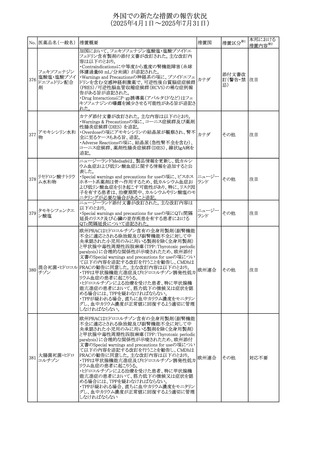
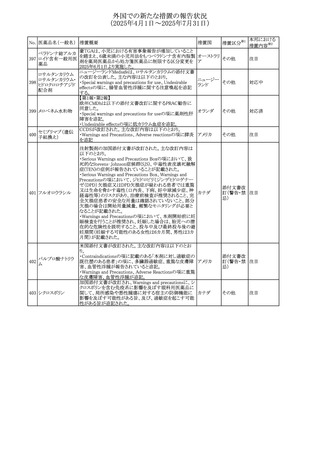
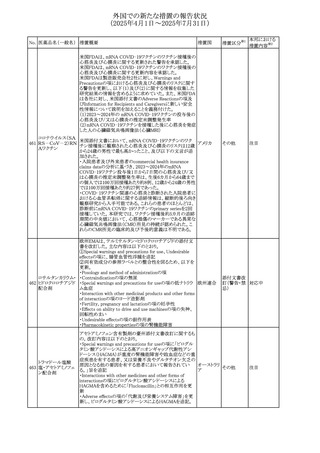
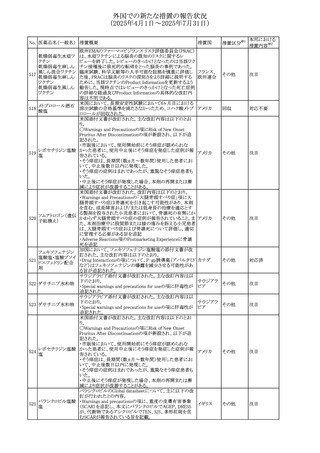
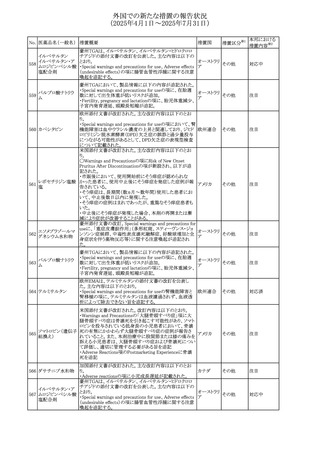
No. 医薬品名(一般名) 措置概要
284
スコポラミン含有一
般用医薬品
285 タダラフィル
ピタバスタチンカル
シウム
286 ピタバスタチンカル
シウム水和物・エゼ
チミブ配合剤
ルリオクトコグアル
287 ファ(遺伝子組換
え)
288
モガムリズマブ(遺
伝子組換え)
289 グリクラジド
措置国
措置区分※1
本邦における
措置内容※2
スコポラミン経皮吸収製剤の米国添付文書が改訂された。
改訂内容は以下のとおり。
・Warnings and Precautions、Adverse Reactions及びUse in アメリカ
その他
注目
Specific Populations(Pediatric Use、Geriatric)の項に高体
温が追記。
マシテンタン/タダラフィル配合錠の米国添付文書が改訂さ
れた。主な内容は以下のとおり。
・Boxed Waning及びWarnings and Precautionsの項におけ
る妊婦への投与は禁忌である旨の注意喚起に、非臨床
データに基づき胎児に害を及ぼす可能性がある旨、投与開
添付文書改
始前、投与中、及び投与後1カ月間の効果的避妊法の指導 アメリカ
訂(警告・禁 対応済
が必要である旨、及び妊娠が発覚した場合には可及的速
忌)
やかに投与を中止する旨が追記された
・Use in Specific Populationsの項に非臨床データに基づき
胎児に害を及ぼす可能性がある旨及び妊婦には禁忌の旨
が追記された
マレーシア規制当局(NPRA)は、スタチンによる重症筋無力
症の悪化または増悪の潜在的リスクに関するレビューを完
了し、スタチン含有製品(配合剤を含む)の全ての登録保有
マレーシア その他
対応済
者に対し、この安全性情報を反映させるため添付文書およ
び患者向け医薬品情報リーフレットを更新するよう指示し
た。
ヒト血漿由来及び遺伝子組換え血液凝固第VIII因子製剤の
コア欧州添付文書(改訂第3版)にあわせ、遺伝子組換え血
液凝固第VIII因子製剤の欧州添付文書が改訂された。主な
改訂内容は以下のとおり。
・Posology and method of administrationの項に治療モニタリ
ングが記載され、オンデマンド治療、予防、投与方法の記載
が更新された。
・Contraindicationsの項にマウス又はハムスターのタンパク
質に対するアレルギー反応が知られている旨が記載され
た。
オランダ
・Special warnings and precautions for useの項においてイン
ヒビターに関する記載が更新された。
・Special warnings and precautions for useの項に心血管イ
ベントが追記された。
・Interaction with other medicinal products and other forms
of interactionの項にヒト血液凝固第VIII因子製剤と他の医
薬品との相互作用は報告されていない旨が記載された。
・Undesirable effectsの項に小児における有害事象の種類
及び重症度は成人同様でありうる旨等が記載された。
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
オランダ、
・Special warnings and precautions for useの項に添加剤の
イギリス
ポリソルベートがアレルギー反応を起こす可能性がある旨が
記載された。
加HCは、グリクラジドの特定のロットに、ピンク色の染み(カ
ンデサルタンシレキセチルとして識別)が確認されたため、 カナダ
回収が実施された。
欧州PRACはchlorocresol/クロルヘキシジン/hexamidine
の添付文書を改訂し、接触皮膚炎を含む過敏症反応につ
いて注意喚起を更新するよう勧告し、CMDhが同意した。
クロルヘキシジング
Special warnings and precautions for useに記載される内容
ルコン酸塩
の概要は以下のとおり。
290 クロルヘキシジング
欧州連合
hexamidine、クロルヘキシジン、chlorocresol、及び本外用液
ルコン酸塩含有一
に含まれる2つの添加剤との接触により、皮膚炎(アレル
般用医薬品
ギー性を含む)が報告されている。本剤は、クロルヘキシジ
ンの含有量により、曝露後数分以内に重篤な全身性アレル
ギー反応を引き起こす可能性がある。
35
その他
注目
その他
注目
回収
対応不要
その他
対応済