よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (66 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
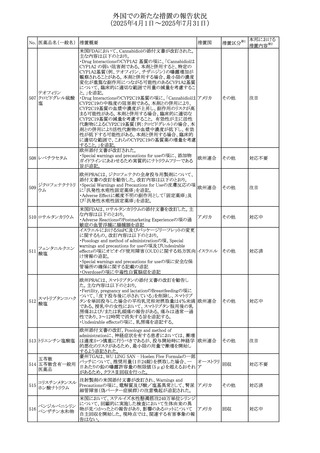
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
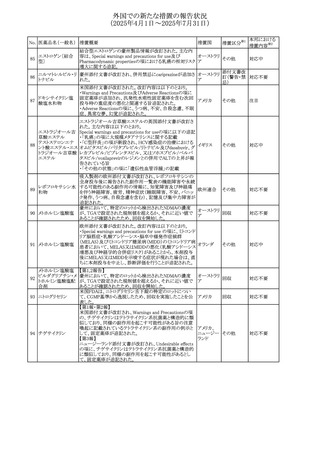
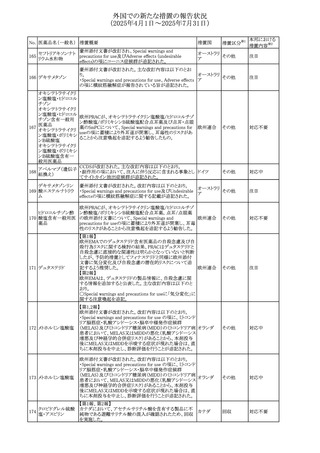
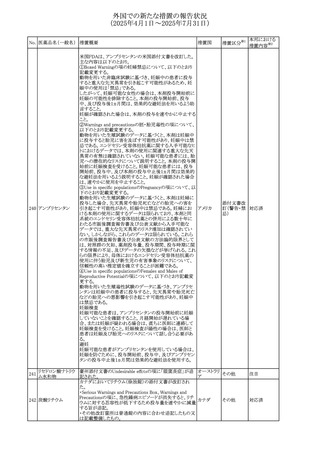
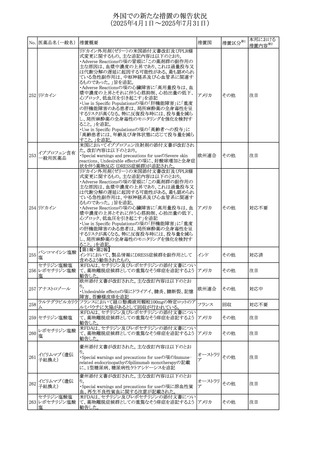
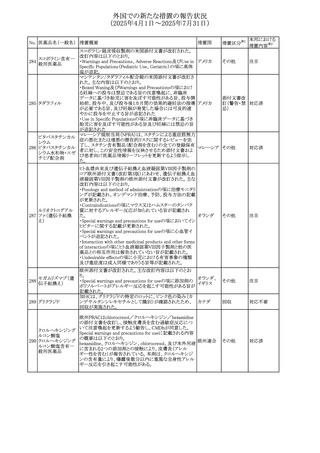
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
アセトアミノフェン含有製剤の豪州添付文書改訂に関するも
の。改訂内容は以下のとおり。
・Special warnings and precautions for useの項に「ピログル
タミン酸アシドーシスによる高アニオンギャップ代謝性アシ
ドーシス(HAGMA)が重度の腎機能障害や敗血症などの重
症疾患を有する患者、または栄養不良やグルタチオン欠乏
の原因となる他の要因を有する患者において報告されてい
アセトアミノフェン含
オーストラリ
479
る。」旨を追記
その他
有一般用医薬品
ア
・Interactions with other medicines and other forms of
interactionsの項にピログルタミン酸アシドーシスによる
HAGMAを含めるために「Flucloxacillin」との相互作用を更
新
・Adverse effectsの項の「代謝および栄養システム障害」を
更新し、ピログルタミン酸アシドーシスによるHAGMAを追
記。
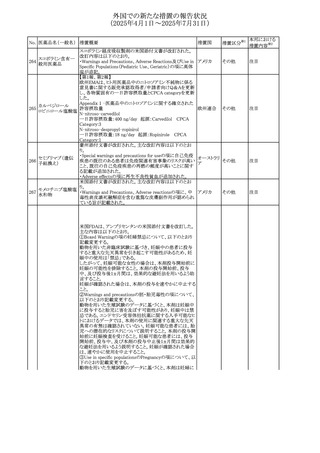
注目
豪州TGAにおいて、製品情報に以下の内容が追記された。
フルボキサミンマレ ・Overdoseの項に、他の薬剤と併用して意図的に過量服用 オーストラリ
480
その他
イン酸塩
した場合、より重篤な合併症が観察されている。単独過量投 ア
与による死亡例も報告されている旨が追記。
対応済
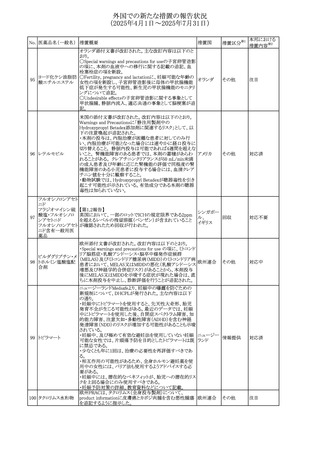
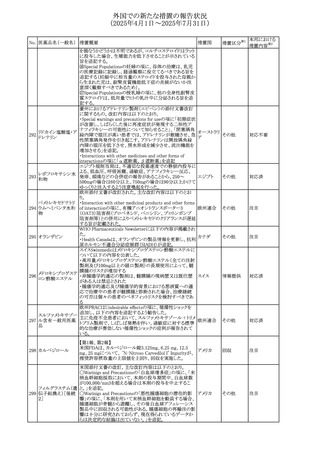
米国FDAは、mRNA COVID-19ワクチンのワクチン接種後の
心筋炎及び心膜炎に関する更新内容を承認した。
米国FDAは製造販売会社2社に対し、Warnings and
Precautionsの項における心筋炎及び心膜炎のリスクに関す
る警告を更新し、以下(1)及び(2)に関する情報を収集した
研究結果の情報を含めるように求めていた。また、米国FDA
は各社に対し、米国添付文書のAdverse Reactionsの項及
びInformation for Recipients and Caregiversに新しい安全
性情報について説明を加えることを義務付けた。
(1)2023~2024年の mRNA COVID-19ワクチンの投与後の
心筋炎及び/又は心膜炎の推定未調整発生率
(2)mRNA COVID-19ワクチンを接種した後に心筋炎を発症
した人の心臓磁気共鳴画像法(心臓MRI)
米国添付文書において、mRNA COVID-19ワクチンのワク
コロナウイルス(SA
チン接種後に観察された心筋炎及び心膜炎のリスクは12歳
481 RS-CoV-2)RN
アメリカ
から24歳の男性で最も高かったこと、及び以下の文言が追
Aワクチン
加された。
・入院患者及び外来患者のcommercial health insurance
claims dataの分析に基づき、2023~2024年のmRNA
COVID-19ワクチン投与後1日から7日間の心筋炎及び/又
は心膜炎の推定未調整発生率は、生後6カ月から64歳まで
の個人では100万回接種あたり約8例、12歳から24歳の男性
では100万回接種あたり約27例であった。
・COVID-19ワクチン関連の心筋炎と診断された入院患者に
おける心血管系転帰に関する追跡情報は、縦断的後ろ向き
観察研究から入手可能である。これらの患者のほとんどは、
診断前にmRNA COVID-19ワクチンのprimary seriesを2回
接種していた。本研究では、ワクチン接種後約5カ月の追跡
期間の中央値において、心筋損傷のマーカーである異常な
心臓磁気共鳴画像法(CMR)所見の持続が認められた。こ
れらのCMR所見の臨床的及び予後的意義は不明である。
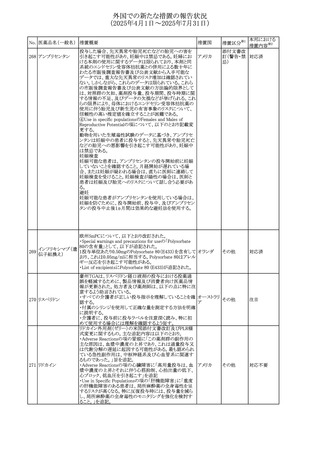
台湾FDAは、スタチン製剤の添付文書の改訂を勧告した。
主な内容は以下のとおり。
①Contraindicationsの項の肝疾患に関する記載を下記に
ピタバスタチンカル 統一する。
シウム
急性肝不全または非代償性肝硬変
482 ピタバスタチンカル ②Warning and important precautionsの項に下記を追記す 台湾
シウム水和物・エゼ る。
チミブ配合剤
アラニンアミノトランスフェラーゼ(ALT)及びアスパラギン酸
アミノトランスフェラーゼ(AST)が正常範囲の上限を3倍以上
超える場合、または黄疸が発現した場合は薬の投与中止を
検討する必要がある。
66
その他
注目
添付文書改
訂(警告・禁 対応済
忌)
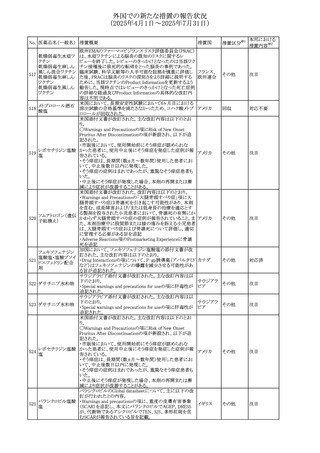
(2025年4月1日~2025年7月31日)
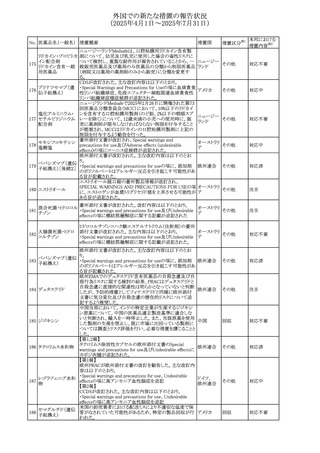
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
アセトアミノフェン含有製剤の豪州添付文書改訂に関するも
の。改訂内容は以下のとおり。
・Special warnings and precautions for useの項に「ピログル
タミン酸アシドーシスによる高アニオンギャップ代謝性アシ
ドーシス(HAGMA)が重度の腎機能障害や敗血症などの重
症疾患を有する患者、または栄養不良やグルタチオン欠乏
の原因となる他の要因を有する患者において報告されてい
アセトアミノフェン含
オーストラリ
479
る。」旨を追記
その他
有一般用医薬品
ア
・Interactions with other medicines and other forms of
interactionsの項にピログルタミン酸アシドーシスによる
HAGMAを含めるために「Flucloxacillin」との相互作用を更
新
・Adverse effectsの項の「代謝および栄養システム障害」を
更新し、ピログルタミン酸アシドーシスによるHAGMAを追
記。
注目
豪州TGAにおいて、製品情報に以下の内容が追記された。
フルボキサミンマレ ・Overdoseの項に、他の薬剤と併用して意図的に過量服用 オーストラリ
480
その他
イン酸塩
した場合、より重篤な合併症が観察されている。単独過量投 ア
与による死亡例も報告されている旨が追記。
対応済
米国FDAは、mRNA COVID-19ワクチンのワクチン接種後の
心筋炎及び心膜炎に関する更新内容を承認した。
米国FDAは製造販売会社2社に対し、Warnings and
Precautionsの項における心筋炎及び心膜炎のリスクに関す
る警告を更新し、以下(1)及び(2)に関する情報を収集した
研究結果の情報を含めるように求めていた。また、米国FDA
は各社に対し、米国添付文書のAdverse Reactionsの項及
びInformation for Recipients and Caregiversに新しい安全
性情報について説明を加えることを義務付けた。
(1)2023~2024年の mRNA COVID-19ワクチンの投与後の
心筋炎及び/又は心膜炎の推定未調整発生率
(2)mRNA COVID-19ワクチンを接種した後に心筋炎を発症
した人の心臓磁気共鳴画像法(心臓MRI)
米国添付文書において、mRNA COVID-19ワクチンのワク
コロナウイルス(SA
チン接種後に観察された心筋炎及び心膜炎のリスクは12歳
481 RS-CoV-2)RN
アメリカ
から24歳の男性で最も高かったこと、及び以下の文言が追
Aワクチン
加された。
・入院患者及び外来患者のcommercial health insurance
claims dataの分析に基づき、2023~2024年のmRNA
COVID-19ワクチン投与後1日から7日間の心筋炎及び/又
は心膜炎の推定未調整発生率は、生後6カ月から64歳まで
の個人では100万回接種あたり約8例、12歳から24歳の男性
では100万回接種あたり約27例であった。
・COVID-19ワクチン関連の心筋炎と診断された入院患者に
おける心血管系転帰に関する追跡情報は、縦断的後ろ向き
観察研究から入手可能である。これらの患者のほとんどは、
診断前にmRNA COVID-19ワクチンのprimary seriesを2回
接種していた。本研究では、ワクチン接種後約5カ月の追跡
期間の中央値において、心筋損傷のマーカーである異常な
心臓磁気共鳴画像法(CMR)所見の持続が認められた。こ
れらのCMR所見の臨床的及び予後的意義は不明である。
台湾FDAは、スタチン製剤の添付文書の改訂を勧告した。
主な内容は以下のとおり。
①Contraindicationsの項の肝疾患に関する記載を下記に
ピタバスタチンカル 統一する。
シウム
急性肝不全または非代償性肝硬変
482 ピタバスタチンカル ②Warning and important precautionsの項に下記を追記す 台湾
シウム水和物・エゼ る。
チミブ配合剤
アラニンアミノトランスフェラーゼ(ALT)及びアスパラギン酸
アミノトランスフェラーゼ(AST)が正常範囲の上限を3倍以上
超える場合、または黄疸が発現した場合は薬の投与中止を
検討する必要がある。
66
その他
注目
添付文書改
訂(警告・禁 対応済
忌)