よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
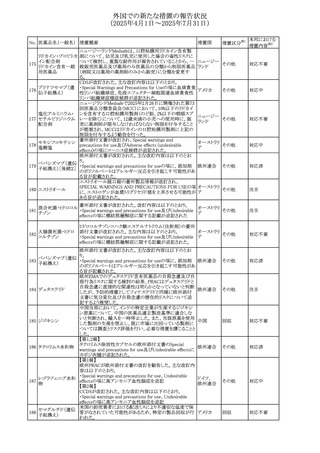
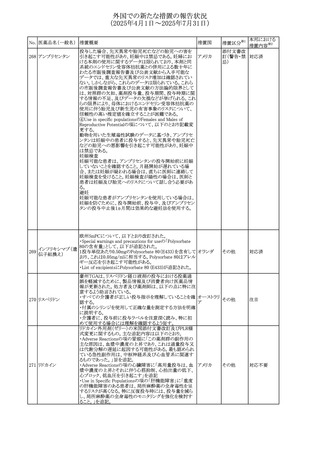
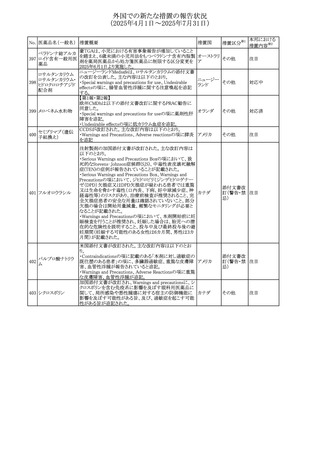
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
措置区分※1
本邦における
措置内容※2
ドイツBfArMは、欧州EMA・CHAPが、アジスロマイシンのベ
ネフィットとリスクを再評価した結果、中等度の尋常性ざ瘡、
ヘリコバクター・ピロリの除菌、好酸球性喘息及び非好酸球
性喘息の増悪(発作)予防に対する経口アジスロマイシンの
適応の削除を勧告した旨を公表した。
アジスロマイシン水
また、あわせて公表された欧州添付文書について以下の改
和物
訂がされている。
コルヒチン
ドイツ、
300
・Interaction with other medicinal products and other forms
レボフロキサシン水
欧州連合
of interactionの項に、併用注意として、治療域の狭いP-gp
和物
基質(ジゴキシン、コルヒチン等)、QT間隔を延長させること
クラリスロマイシン
が知られている医薬品(レボフロキサシン等)を追記。
・Pharmacodynamic propertiesの項に、23S rRNAにマクロラ
イド耐性の構造変化を起こすM-表現型では、アジスロマイ
シン、クラリスロマイシン、エリスロマイシン、ロキシスロマイシ
ンとの間に完全な交差耐性が認められる旨、追記。
その他
注目
エジプト規制当局は、本剤の不適切な投薬速度による静脈
内投与による、低血圧、呼吸困難、過敏症、アナフィラキ
レボフロキサシン水
301
シー反応、発疹、頭痛などの合併症の報告があることから、 エジプト
和物
250~500mgの場合は60分以上、750mgの場合は90分以上
かけてゆっくりと注入注意喚起を行った。
その他
対応済
欧州PRACはクロロクレゾール/クロルヘキシジン/ヘキサミジ
ンの添付文書を改訂し、接触皮膚炎を含む過敏症反応に
ついて注意喚起を更新するよう勧告し、CMDhが同意した。
Special warnings and precautions for useに記載される内容
クロルヘキシジン塩
の概要は以下のとおり。
302 酸塩・ジフェンヒドラ
欧州連合
ヘキサミジン、クロルヘキシジン、クロロクレゾール、及び本
ミン配合剤
外用液に含まれる2つの添加剤との接触により、皮膚炎(ア
レルギー性を含む)が報告されている。本剤は、クロルヘキ
シジンの含有量により、曝露後数分以内に重篤な全身性ア
レルギー反応を引き起こす可能性がある。
その他
対応済
303 プレガバリン
米国添付文書が改訂された。
・Warnings and Precautions、Adverse Reactionsの項に投与
中止後に自殺行動・自殺念慮を含む離脱症状が報告され
アメリカ
ている旨が追記。
・Pregnant Womenの項に、新生児離脱症候群が追記され
た。
その他
注目
304 ガドテリドール
加国Health Canadaは、ガドリウム造影剤の髄腔内投与によ
る痙攣、脳症、昏睡、死亡などの重篤な副作用の潜在的リス
クをレビューした結果を公表した。主な内容は以下の通り。
・ガドリニウム造影剤の髄腔内投与と痙攣、脳症、昏睡、死
カナダ
亡を含む重篤な副作用に関連がある可能性が認められた
・全てのガドリニウム造影剤の安全性情報を更新し、髄腔内
使用による痙攣、脳症、昏睡、死亡を含む重篤な副作用の
リスクについて記載する
その他
注目
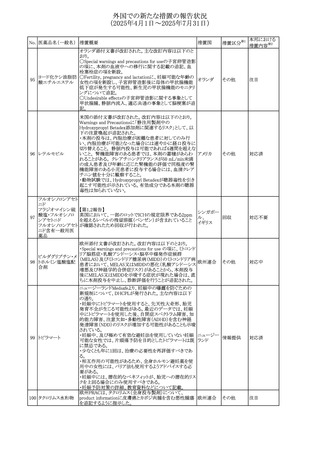
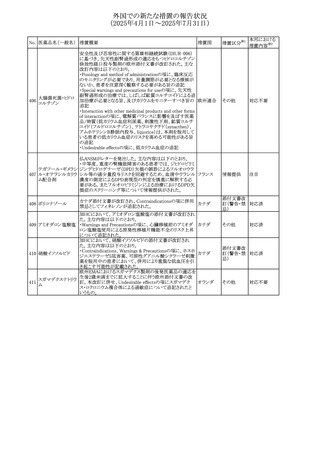
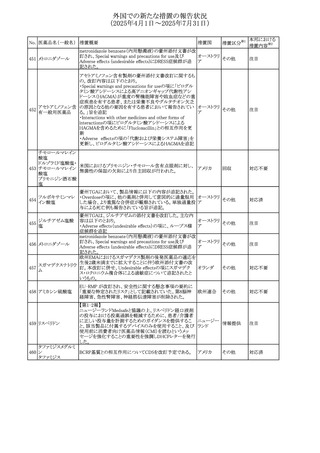
No. 医薬品名(一般名) 措置概要
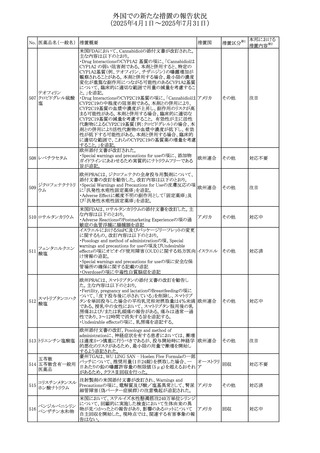
措置国
エジプト規制当局は、本剤の不適切な投薬速度による静脈
内投与による、低血圧、呼吸困難、過敏症、アナフィラキ
レボフロキサシン水
305
シー反応、発疹、頭痛などの合併症の報告があることから、 エジプト
その他
和物
250~500mgの場合は60分以上、750mgの場合は90分以上
かけてゆっくりと注入注意喚起を行った。
スコポラミン経皮吸収製剤の米国添付文書が改訂された。
改訂内容は以下のとおり。
スコポラミン含有一
306
・Warnings and Precautions、Adverse Reactions及びUse in アメリカ
その他
般用医薬品
Specific Populations(Pediatric Use、Geriatric)の項に高体
温が追記。
ニュージーランド添付文書が改訂された。主な改訂内容は
以下のとおり。
タモキシフェンクエ
ニュージー
307
・Special warnings and precautions for useの項にQTc間隔
その他
ン酸塩
ランド
延長のリスク及び心臓の並存疾患を有する患者における
QTc間隔延長について追記された。
38
対応済
注目
注目
(2025年4月1日~2025年7月31日)
措置区分※1
本邦における
措置内容※2
ドイツBfArMは、欧州EMA・CHAPが、アジスロマイシンのベ
ネフィットとリスクを再評価した結果、中等度の尋常性ざ瘡、
ヘリコバクター・ピロリの除菌、好酸球性喘息及び非好酸球
性喘息の増悪(発作)予防に対する経口アジスロマイシンの
適応の削除を勧告した旨を公表した。
アジスロマイシン水
また、あわせて公表された欧州添付文書について以下の改
和物
訂がされている。
コルヒチン
ドイツ、
300
・Interaction with other medicinal products and other forms
レボフロキサシン水
欧州連合
of interactionの項に、併用注意として、治療域の狭いP-gp
和物
基質(ジゴキシン、コルヒチン等)、QT間隔を延長させること
クラリスロマイシン
が知られている医薬品(レボフロキサシン等)を追記。
・Pharmacodynamic propertiesの項に、23S rRNAにマクロラ
イド耐性の構造変化を起こすM-表現型では、アジスロマイ
シン、クラリスロマイシン、エリスロマイシン、ロキシスロマイシ
ンとの間に完全な交差耐性が認められる旨、追記。
その他
注目
エジプト規制当局は、本剤の不適切な投薬速度による静脈
内投与による、低血圧、呼吸困難、過敏症、アナフィラキ
レボフロキサシン水
301
シー反応、発疹、頭痛などの合併症の報告があることから、 エジプト
和物
250~500mgの場合は60分以上、750mgの場合は90分以上
かけてゆっくりと注入注意喚起を行った。
その他
対応済
欧州PRACはクロロクレゾール/クロルヘキシジン/ヘキサミジ
ンの添付文書を改訂し、接触皮膚炎を含む過敏症反応に
ついて注意喚起を更新するよう勧告し、CMDhが同意した。
Special warnings and precautions for useに記載される内容
クロルヘキシジン塩
の概要は以下のとおり。
302 酸塩・ジフェンヒドラ
欧州連合
ヘキサミジン、クロルヘキシジン、クロロクレゾール、及び本
ミン配合剤
外用液に含まれる2つの添加剤との接触により、皮膚炎(ア
レルギー性を含む)が報告されている。本剤は、クロルヘキ
シジンの含有量により、曝露後数分以内に重篤な全身性ア
レルギー反応を引き起こす可能性がある。
その他
対応済
303 プレガバリン
米国添付文書が改訂された。
・Warnings and Precautions、Adverse Reactionsの項に投与
中止後に自殺行動・自殺念慮を含む離脱症状が報告され
アメリカ
ている旨が追記。
・Pregnant Womenの項に、新生児離脱症候群が追記され
た。
その他
注目
304 ガドテリドール
加国Health Canadaは、ガドリウム造影剤の髄腔内投与によ
る痙攣、脳症、昏睡、死亡などの重篤な副作用の潜在的リス
クをレビューした結果を公表した。主な内容は以下の通り。
・ガドリニウム造影剤の髄腔内投与と痙攣、脳症、昏睡、死
カナダ
亡を含む重篤な副作用に関連がある可能性が認められた
・全てのガドリニウム造影剤の安全性情報を更新し、髄腔内
使用による痙攣、脳症、昏睡、死亡を含む重篤な副作用の
リスクについて記載する
その他
注目
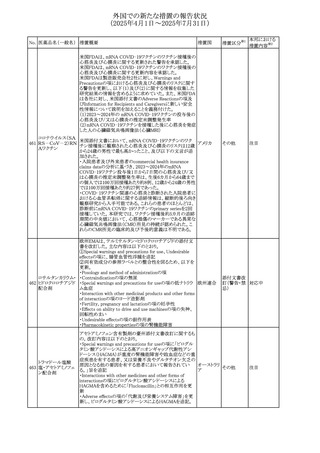
No. 医薬品名(一般名) 措置概要
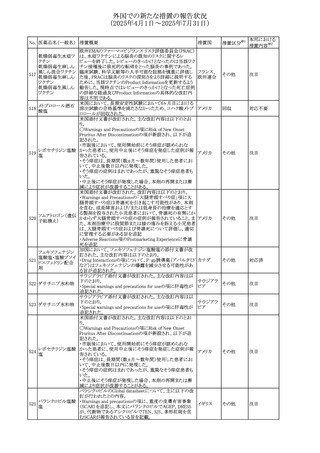
措置国
エジプト規制当局は、本剤の不適切な投薬速度による静脈
内投与による、低血圧、呼吸困難、過敏症、アナフィラキ
レボフロキサシン水
305
シー反応、発疹、頭痛などの合併症の報告があることから、 エジプト
その他
和物
250~500mgの場合は60分以上、750mgの場合は90分以上
かけてゆっくりと注入注意喚起を行った。
スコポラミン経皮吸収製剤の米国添付文書が改訂された。
改訂内容は以下のとおり。
スコポラミン含有一
306
・Warnings and Precautions、Adverse Reactions及びUse in アメリカ
その他
般用医薬品
Specific Populations(Pediatric Use、Geriatric)の項に高体
温が追記。
ニュージーランド添付文書が改訂された。主な改訂内容は
以下のとおり。
タモキシフェンクエ
ニュージー
307
・Special warnings and precautions for useの項にQTc間隔
その他
ン酸塩
ランド
延長のリスク及び心臓の並存疾患を有する患者における
QTc間隔延長について追記された。
38
対応済
注目
注目