よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
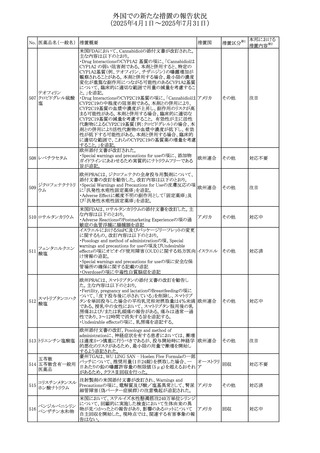
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
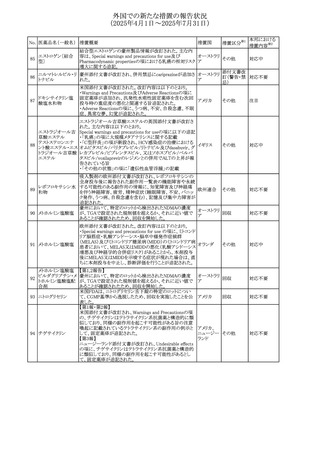
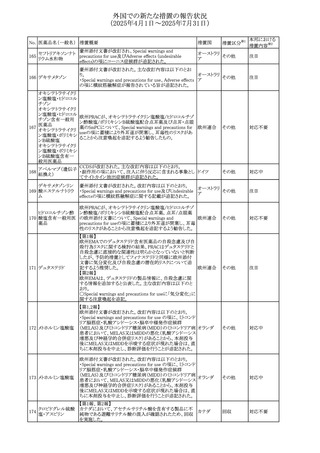
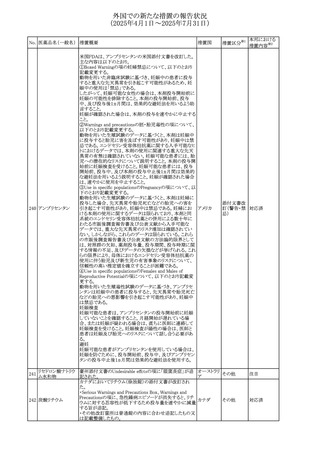
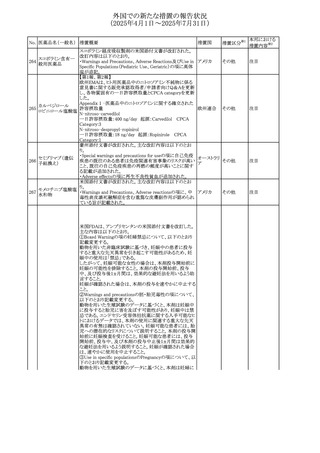
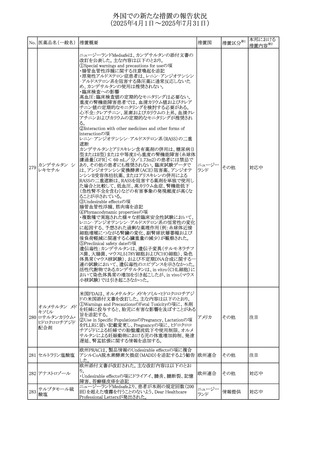
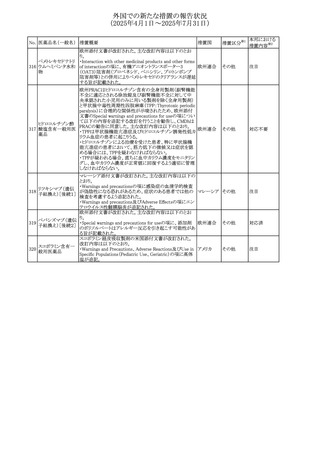
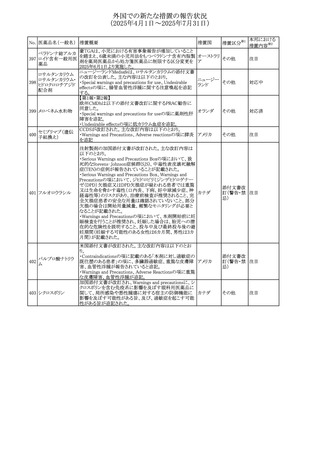
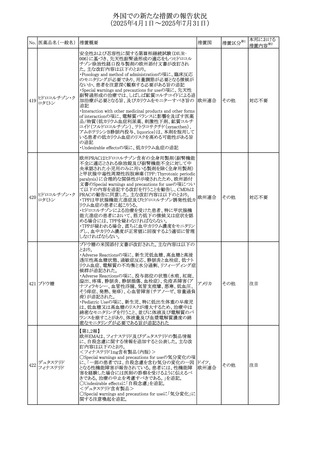
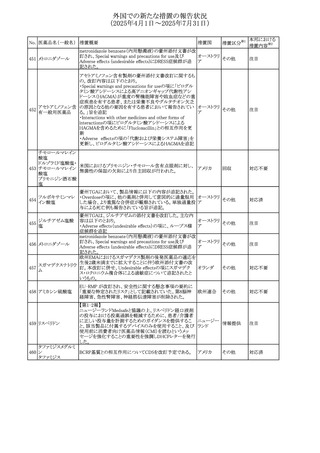
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
豪州添付文書改訂に関するもの。改訂内容は以下の通り。
トラマドール塩酸
・Overdoseの項に「呼吸停止後の死亡率の増加」を追記。 オーストラリ
25 塩・アセトアミノフェ
その他
・Interactions with other medicines and other forms of
ア
ン配合剤
interactionsの項に「抗コリン薬」を追記。
本邦における
措置内容※2
注目
スイス Swissmedicにおいて、バルサルタンとNSAIDsの併用
により高カリウム血症が発現した症例が掲載され、ARBや
NSAIDsなど高カリウム血症を引き起こす可能性のある複数 スイス
の医薬品を併用する場合の高カリウム血症のリスクについて
注意喚起した。
その他
注目
独BfArMより、バルプロ酸含有製品に関して、医薬品の安全
性に関する報告書を入手した。PRACがバルプロ酸の製品
情報に以下を追記するよう結論付けた旨が記載されてい
る。
・Special warnings and precautions for useに重篤な皮膚障
害、血管性浮腫を追記
ドイツ
・Interaction with other medicinal products and other forms
of interactionにクロザピン併用によりクロザピンのADR発生
率が高くなる(相加作用により心筋炎や好中球減少症等のリ
スクが増加)
・Undesirable effectsに胸水(好酸球性)、色素沈着を追記
その他
注目
加HCは、サイクリン依存性キナーゼ阻害剤とHMG-CoA還
元酵素阻害剤(アトルバスタチン、フルバスタチン、プラバス
プラバスタチンナトリ タチン、ロスバスタチン、シンバスタチン含有製品)の薬物相
28
カナダ
ウム
互作用と横紋筋融解症の潜在的リスクとの関連性をレ
ビューした結果、関連がある可能性が判明したため、製品モ
ノグラフ(CPM)の製品安全性情報を更新する予定である。
その他
注目
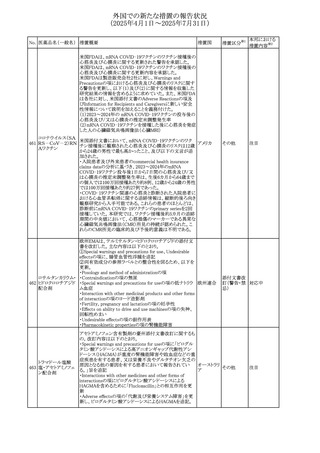
豪州添付文書改訂に関するもの。改訂内容は以下の通り。
トラマドール塩酸
・Overdoseの項に「呼吸停止後の死亡率の増加」を追記。 オーストラリ
29 塩・アセトアミノフェ
その他
・Interactions with other medicines and other forms of
ア
ン配合剤
interactionsの項に「抗コリン薬」を追記。
注目
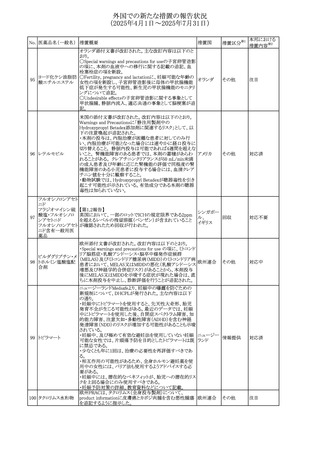
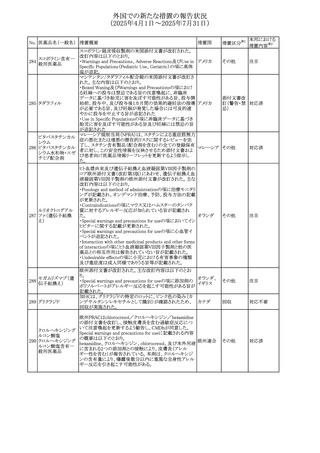
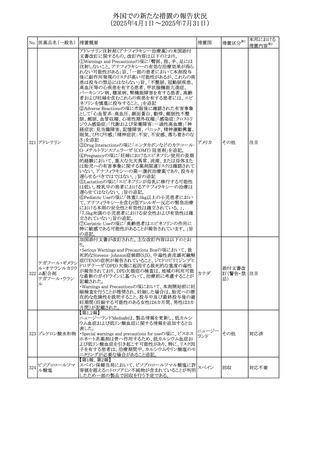
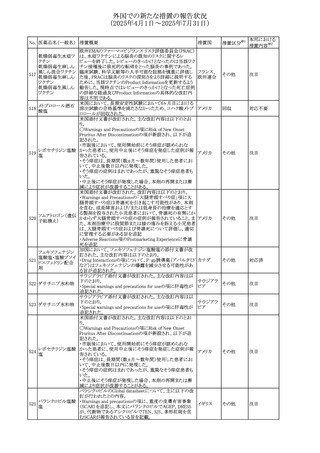
26 バルサルタン
27
バルプロ酸ナトリウ
ム
30 ヘパリンナトリウム
米国FDAは、ヘパリンナトリウム(注射剤)の添付文書を改訂
した。主な内容は以下のとおり。
①Contraindicationsの項に、「適切な血液凝固検査(全血
凝固時間、部分トロンボプラスチン時間など)を適切な間隔
で実施できない患者(この禁忌は最大用量ヘパリンに関す
るものであり、低用量ヘパリンを投与されている患者では通
常、凝固パラメータをモニタリングする必要はない)」を追
記。
②Warnings and Precautionsの凝固テストと監視の項に、
「最大用量のヘパリン療法を使用する場合は、頻繁な血液 アメリカ
凝固検査に基づいてヘパリン用量を調整すること。凝固検
査が過度に長引く場合、または出血が起こった場合は、ヘ
パリンナトリウムを直ちに中止する必要がある。ヘパリン療法
の全過程を通じて、定期的に血小板数、ヘマトクリットを測
定することが推奨される」を追記。
③Adverse Reactionsのその他の項に、「高用量ヘパリンの
長期投与後の骨粗鬆症、アルドステロン合成抑制」を追記。
④Drug Interactionsの ヘパリンを妨げる可能性のある薬の
項に「静脈内ニトログリセリン」を追記。
米国添付文書が改訂された。また、本改訂内容に関する
DHCPレターが発出された。
・Warnings and Precautions項の好中球減少症の記載にお
いて、重篤な好中球減少症は初回投与時、UGT1A1遺伝子
活性の低い患者で起こりやすいことが追記された。また発症
サシツズマブ ゴビ リスクの高い患者には初回からG-CSF製剤を予防投与し、
31 テカン(遺伝子組換 投与中は好中球数の変化をモニタリングすること、次回クー アメリカ
え)
ルから減量等の適切な予防措置を行うことが追記された。
・Warnings and Precautions項の悪心・嘔吐の記載に、重篤
な吐き気、嘔吐をもたらす可能性があると追記された。
・Use in Specific Populations項において、65歳以上の患者
では致死的な好中球減少症の発生率が高い旨が記載され
た。
4
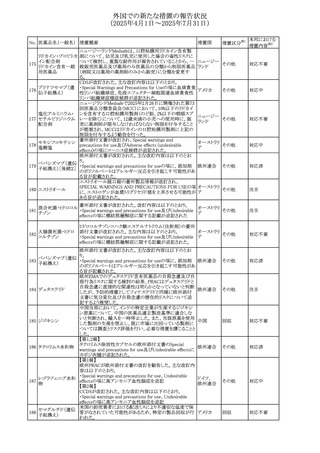
添付文書改
訂(警告・禁 注目
忌)
情報提供
対応中
(2025年4月1日~2025年7月31日)
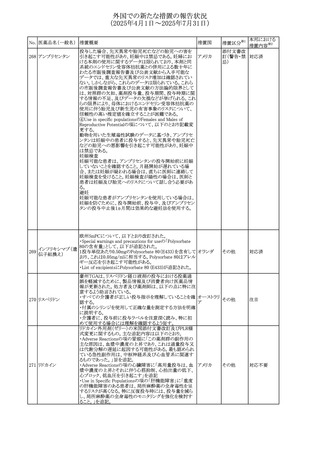
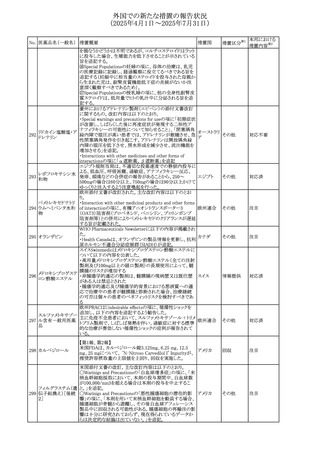
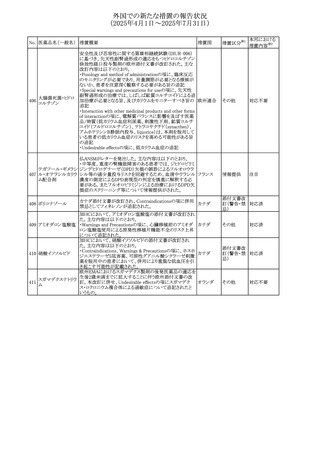
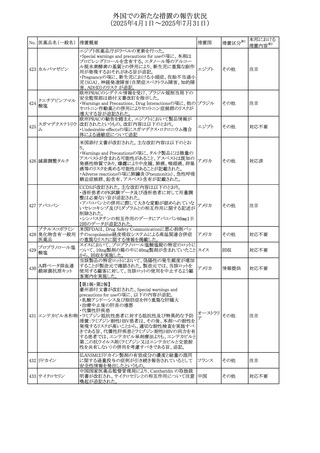
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
豪州添付文書改訂に関するもの。改訂内容は以下の通り。
トラマドール塩酸
・Overdoseの項に「呼吸停止後の死亡率の増加」を追記。 オーストラリ
25 塩・アセトアミノフェ
その他
・Interactions with other medicines and other forms of
ア
ン配合剤
interactionsの項に「抗コリン薬」を追記。
本邦における
措置内容※2
注目
スイス Swissmedicにおいて、バルサルタンとNSAIDsの併用
により高カリウム血症が発現した症例が掲載され、ARBや
NSAIDsなど高カリウム血症を引き起こす可能性のある複数 スイス
の医薬品を併用する場合の高カリウム血症のリスクについて
注意喚起した。
その他
注目
独BfArMより、バルプロ酸含有製品に関して、医薬品の安全
性に関する報告書を入手した。PRACがバルプロ酸の製品
情報に以下を追記するよう結論付けた旨が記載されてい
る。
・Special warnings and precautions for useに重篤な皮膚障
害、血管性浮腫を追記
ドイツ
・Interaction with other medicinal products and other forms
of interactionにクロザピン併用によりクロザピンのADR発生
率が高くなる(相加作用により心筋炎や好中球減少症等のリ
スクが増加)
・Undesirable effectsに胸水(好酸球性)、色素沈着を追記
その他
注目
加HCは、サイクリン依存性キナーゼ阻害剤とHMG-CoA還
元酵素阻害剤(アトルバスタチン、フルバスタチン、プラバス
プラバスタチンナトリ タチン、ロスバスタチン、シンバスタチン含有製品)の薬物相
28
カナダ
ウム
互作用と横紋筋融解症の潜在的リスクとの関連性をレ
ビューした結果、関連がある可能性が判明したため、製品モ
ノグラフ(CPM)の製品安全性情報を更新する予定である。
その他
注目
豪州添付文書改訂に関するもの。改訂内容は以下の通り。
トラマドール塩酸
・Overdoseの項に「呼吸停止後の死亡率の増加」を追記。 オーストラリ
29 塩・アセトアミノフェ
その他
・Interactions with other medicines and other forms of
ア
ン配合剤
interactionsの項に「抗コリン薬」を追記。
注目
26 バルサルタン
27
バルプロ酸ナトリウ
ム
30 ヘパリンナトリウム
米国FDAは、ヘパリンナトリウム(注射剤)の添付文書を改訂
した。主な内容は以下のとおり。
①Contraindicationsの項に、「適切な血液凝固検査(全血
凝固時間、部分トロンボプラスチン時間など)を適切な間隔
で実施できない患者(この禁忌は最大用量ヘパリンに関す
るものであり、低用量ヘパリンを投与されている患者では通
常、凝固パラメータをモニタリングする必要はない)」を追
記。
②Warnings and Precautionsの凝固テストと監視の項に、
「最大用量のヘパリン療法を使用する場合は、頻繁な血液 アメリカ
凝固検査に基づいてヘパリン用量を調整すること。凝固検
査が過度に長引く場合、または出血が起こった場合は、ヘ
パリンナトリウムを直ちに中止する必要がある。ヘパリン療法
の全過程を通じて、定期的に血小板数、ヘマトクリットを測
定することが推奨される」を追記。
③Adverse Reactionsのその他の項に、「高用量ヘパリンの
長期投与後の骨粗鬆症、アルドステロン合成抑制」を追記。
④Drug Interactionsの ヘパリンを妨げる可能性のある薬の
項に「静脈内ニトログリセリン」を追記。
米国添付文書が改訂された。また、本改訂内容に関する
DHCPレターが発出された。
・Warnings and Precautions項の好中球減少症の記載にお
いて、重篤な好中球減少症は初回投与時、UGT1A1遺伝子
活性の低い患者で起こりやすいことが追記された。また発症
サシツズマブ ゴビ リスクの高い患者には初回からG-CSF製剤を予防投与し、
31 テカン(遺伝子組換 投与中は好中球数の変化をモニタリングすること、次回クー アメリカ
え)
ルから減量等の適切な予防措置を行うことが追記された。
・Warnings and Precautions項の悪心・嘔吐の記載に、重篤
な吐き気、嘔吐をもたらす可能性があると追記された。
・Use in Specific Populations項において、65歳以上の患者
では致死的な好中球減少症の発生率が高い旨が記載され
た。
4
添付文書改
訂(警告・禁 注目
忌)
情報提供
対応中