よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
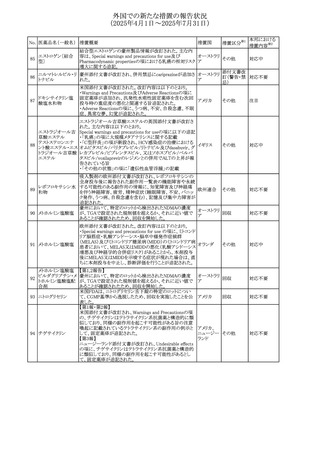
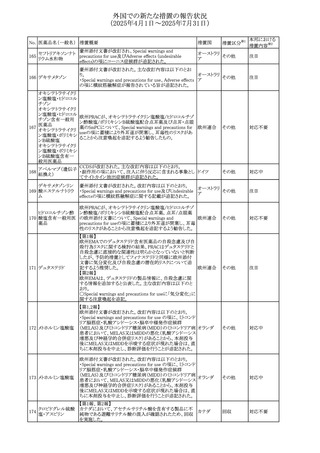
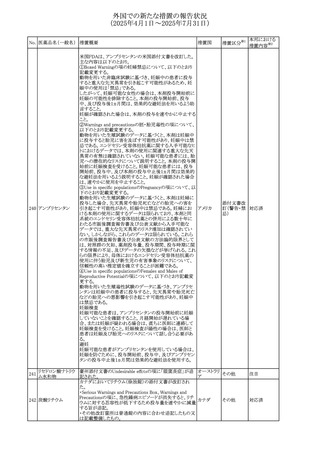
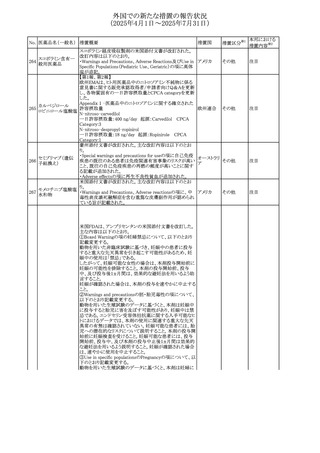
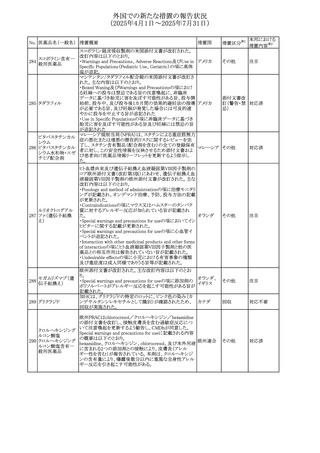
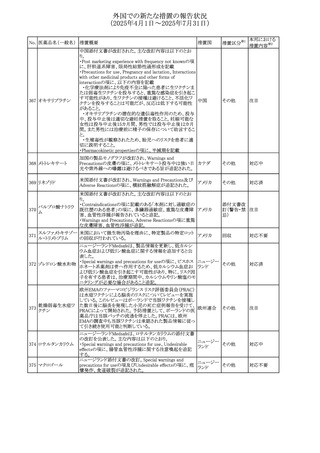
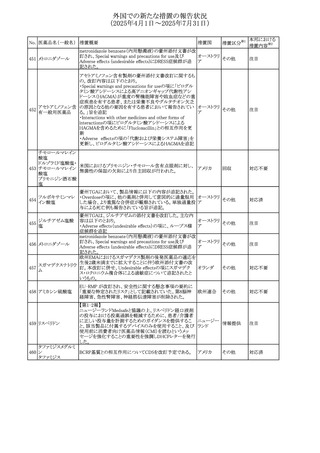
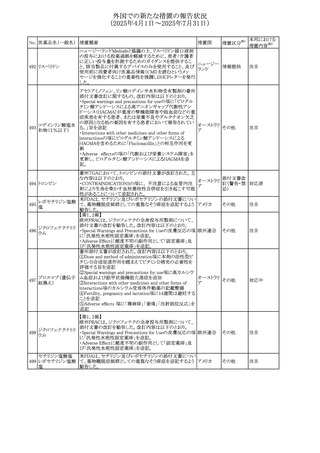
No. 医薬品名(一般名) 措置概要
308 アピキサバン
措置国
米国FDAは、アピキサバンの添付文書を改訂した。主な内
容は以下のとおり。
①WARNINGS AND PRECAUTIONSの出血の項に、アンデ
キサネット アルファによるアピキサバンの薬力学的効果に
対する拮抗について、成人での使用が可能であることが明
記される一方、小児における安全性および有効性は確立さ
れていない旨が追記された。
②WARNINGS AND PRECAUTIONSの脊髄/硬膜外麻酔ま
たは穿刺の項に、アピキサバン投与中の小児患者におい
て、神経軸カテーテルの留置・抜去のタイミングに関する
データは存在しないとされ、アピキサバンの投与を中止し短
時間作用型の注射用抗凝固薬への切り替えが推奨された。
アメリカ
③ADVERSE REACTIONSに、出生時からの小児患者(225
例)を対象とした第3相試験(CV185325)の結果が追加され
た。
④DRUG INTERACTIONS に、P-gpおよび強力なCYP3A4
阻害剤、またP-gpおよび強力なCYP3A4誘導剤との併用に
ついて、小児においても同様の注意が必要である旨が明記
された。
⑤USE IN SPECIFIC POPULATIONSに、アピキサバンの小
児患者におけるVTE治療および再発リスク低減に対する有
効性と安全性が、臨床試験の結果に基づいて支持されてい
る旨が追加された。 また、腎機能障害患者の項および肝機
能障害患者の項に、小児患者に関する内容が追加された。
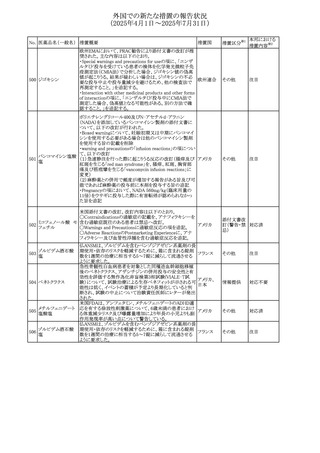
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
309 アナストロゾール
欧州連合
・Undesirable effectsの項にドライアイ、腱炎、腱断裂、記憶
障害、苔癬様皮疹を追記
欧州SmPCに関して、以下の改訂が行われた。
・Special warnings and precautions for useに以下の内容が
追記された。
インフリキシマブ(遺
インフリキシマブ投与中の患者で、手術が必要な場合は、
310 伝子組換え)[後続
オランダ
感染性および非感染性の合併症について注意深く監視し、
3]
適切な処置を行うこと。
・Undesirable effectsの「傷害、中毒および施術による合併
症」に術後合併症が追記された。
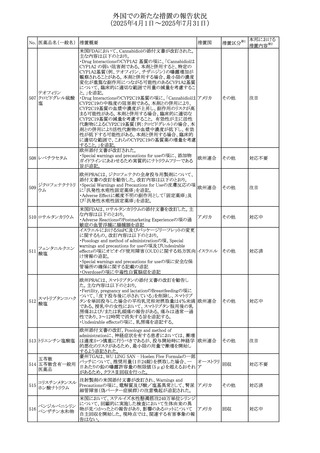
米国添付文書が改訂された。
・Warnings and Precautions、Adverse Reactionsの項に投与
中止後に自殺行動・自殺念慮を含む離脱症状が報告され
311 プレガバリン
アメリカ
ている旨が追記。
・Pregnant Womenの項に、新生児離脱症候群が追記され
た。
米国添付文書が改訂された。
・Warnings and Precautions、Adverse Reactionsの項に投与
中止後に自殺行動・自殺念慮を含む離脱症状が報告され
312 プレガバリン
アメリカ
ている旨が追記。
・Pregnant Womenの項に、新生児離脱症候群が追記され
た。
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Contraindicationsの項に記載のある「本剤に対し過敏症の
バルプロ酸ナトリウ
313
既往歴のある患者」の項に、多臓器過敏症、重篤な皮膚障 アメリカ
ム
害、血管性浮腫が報告されていると追記。
・Warnings and Precautions、Adverse Reactionsの項に重篤
な皮膚障害、血管性浮腫が追記。
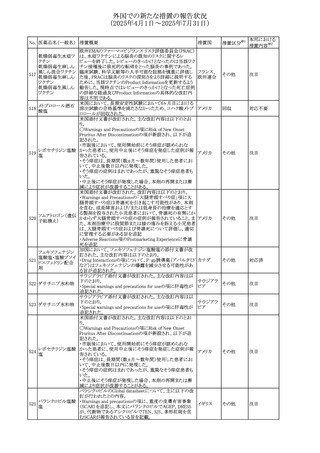
米国添付文書の改訂。主な改訂内容は以下のとおり。
〇Warinings and Precautionsの胚・胎児毒性の項につい
て、避妊期間に関する記載を「妊娠中や生殖可能な女性に
314 デクスラゾキサン
は、胎児へのリスクを説明し、治療中および最後の投与から アメリカ
6ヶ月間の避妊を行う様、助言すること。男性患者も治療中
および最後の投与から3ヶ月間、避妊を行うように助言するこ
と。」へ変更。
エジプト規制当局は、本剤の不適切な投薬速度による静脈
内投与による、低血圧、呼吸困難、過敏症、アナフィラキ
レボフロキサシン水
315
シー反応、発疹、頭痛などの合併症の報告があることから、 エジプト
和物
250~500mgの場合は60分以上、750mgの場合は90分以上
かけてゆっくりと注入注意喚起を行った。
39
措置区分※1
本邦における
措置内容※2
その他
注目
その他
対応中
その他
注目
その他
注目
その他
注目
添付文書改
訂(警告・禁 注目
忌)
その他
対応済
その他
対応済
(2025年4月1日~2025年7月31日)
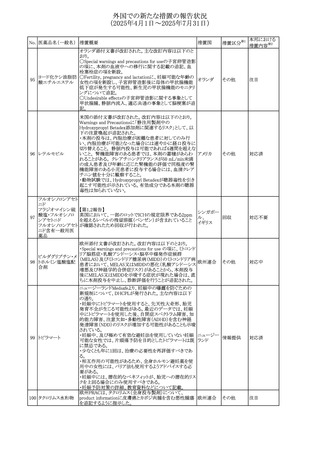
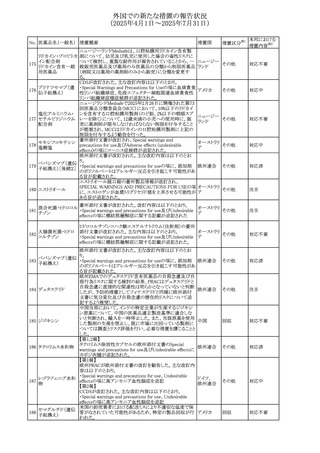
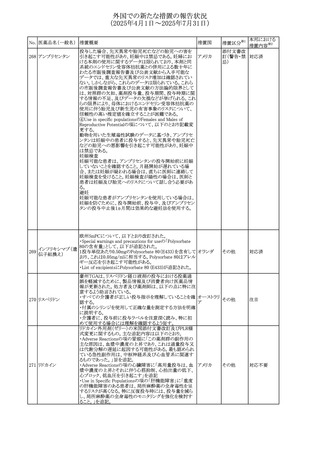
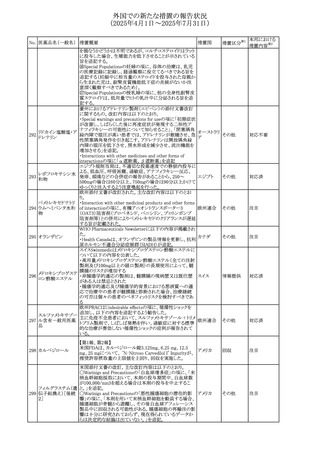
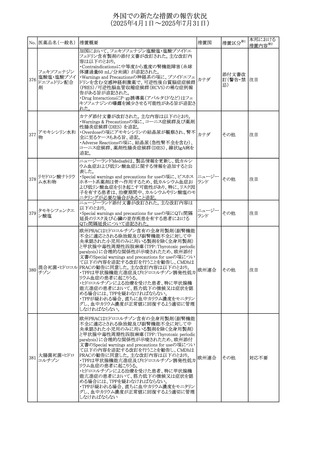
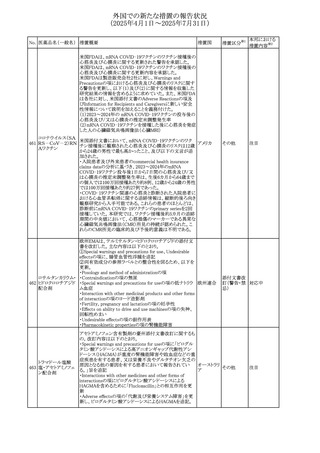
No. 医薬品名(一般名) 措置概要
308 アピキサバン
措置国
米国FDAは、アピキサバンの添付文書を改訂した。主な内
容は以下のとおり。
①WARNINGS AND PRECAUTIONSの出血の項に、アンデ
キサネット アルファによるアピキサバンの薬力学的効果に
対する拮抗について、成人での使用が可能であることが明
記される一方、小児における安全性および有効性は確立さ
れていない旨が追記された。
②WARNINGS AND PRECAUTIONSの脊髄/硬膜外麻酔ま
たは穿刺の項に、アピキサバン投与中の小児患者におい
て、神経軸カテーテルの留置・抜去のタイミングに関する
データは存在しないとされ、アピキサバンの投与を中止し短
時間作用型の注射用抗凝固薬への切り替えが推奨された。
アメリカ
③ADVERSE REACTIONSに、出生時からの小児患者(225
例)を対象とした第3相試験(CV185325)の結果が追加され
た。
④DRUG INTERACTIONS に、P-gpおよび強力なCYP3A4
阻害剤、またP-gpおよび強力なCYP3A4誘導剤との併用に
ついて、小児においても同様の注意が必要である旨が明記
された。
⑤USE IN SPECIFIC POPULATIONSに、アピキサバンの小
児患者におけるVTE治療および再発リスク低減に対する有
効性と安全性が、臨床試験の結果に基づいて支持されてい
る旨が追加された。 また、腎機能障害患者の項および肝機
能障害患者の項に、小児患者に関する内容が追加された。
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
309 アナストロゾール
欧州連合
・Undesirable effectsの項にドライアイ、腱炎、腱断裂、記憶
障害、苔癬様皮疹を追記
欧州SmPCに関して、以下の改訂が行われた。
・Special warnings and precautions for useに以下の内容が
追記された。
インフリキシマブ(遺
インフリキシマブ投与中の患者で、手術が必要な場合は、
310 伝子組換え)[後続
オランダ
感染性および非感染性の合併症について注意深く監視し、
3]
適切な処置を行うこと。
・Undesirable effectsの「傷害、中毒および施術による合併
症」に術後合併症が追記された。
米国添付文書が改訂された。
・Warnings and Precautions、Adverse Reactionsの項に投与
中止後に自殺行動・自殺念慮を含む離脱症状が報告され
311 プレガバリン
アメリカ
ている旨が追記。
・Pregnant Womenの項に、新生児離脱症候群が追記され
た。
米国添付文書が改訂された。
・Warnings and Precautions、Adverse Reactionsの項に投与
中止後に自殺行動・自殺念慮を含む離脱症状が報告され
312 プレガバリン
アメリカ
ている旨が追記。
・Pregnant Womenの項に、新生児離脱症候群が追記され
た。
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Contraindicationsの項に記載のある「本剤に対し過敏症の
バルプロ酸ナトリウ
313
既往歴のある患者」の項に、多臓器過敏症、重篤な皮膚障 アメリカ
ム
害、血管性浮腫が報告されていると追記。
・Warnings and Precautions、Adverse Reactionsの項に重篤
な皮膚障害、血管性浮腫が追記。
米国添付文書の改訂。主な改訂内容は以下のとおり。
〇Warinings and Precautionsの胚・胎児毒性の項につい
て、避妊期間に関する記載を「妊娠中や生殖可能な女性に
314 デクスラゾキサン
は、胎児へのリスクを説明し、治療中および最後の投与から アメリカ
6ヶ月間の避妊を行う様、助言すること。男性患者も治療中
および最後の投与から3ヶ月間、避妊を行うように助言するこ
と。」へ変更。
エジプト規制当局は、本剤の不適切な投薬速度による静脈
内投与による、低血圧、呼吸困難、過敏症、アナフィラキ
レボフロキサシン水
315
シー反応、発疹、頭痛などの合併症の報告があることから、 エジプト
和物
250~500mgの場合は60分以上、750mgの場合は90分以上
かけてゆっくりと注入注意喚起を行った。
39
措置区分※1
本邦における
措置内容※2
その他
注目
その他
対応中
その他
注目
その他
注目
その他
注目
添付文書改
訂(警告・禁 注目
忌)
その他
対応済
その他
対応済