よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
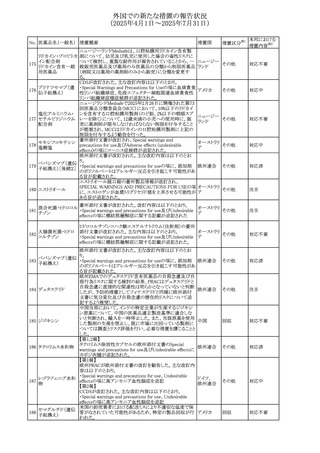
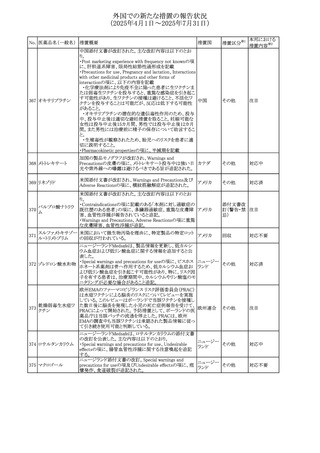
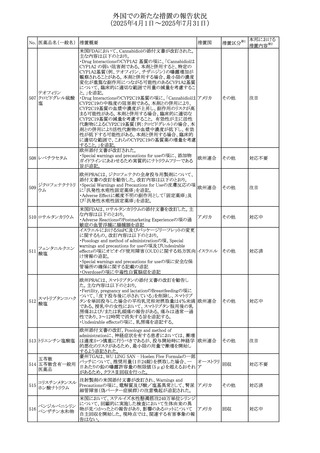
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
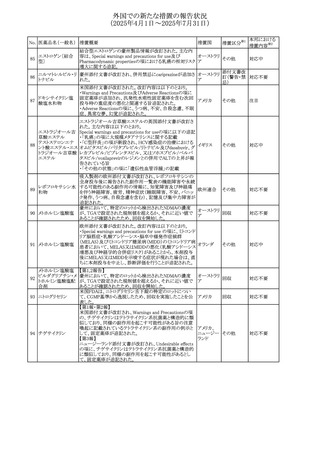
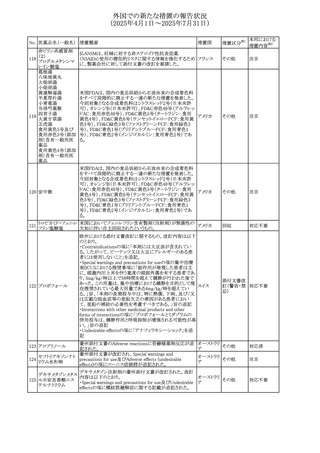
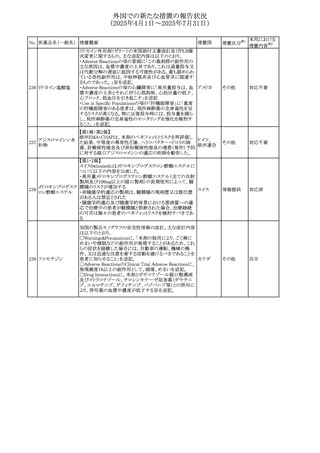
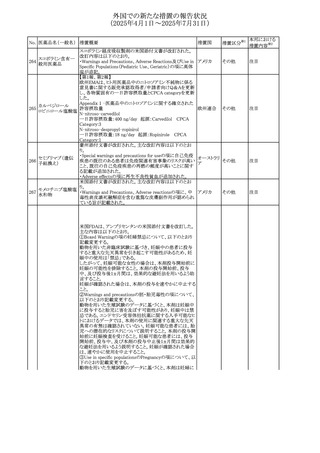
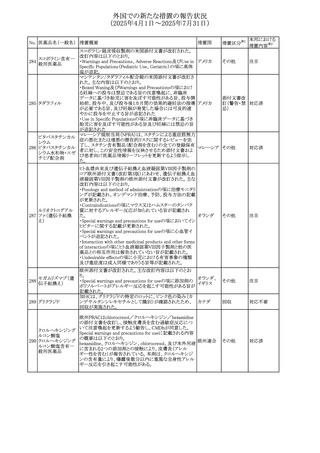
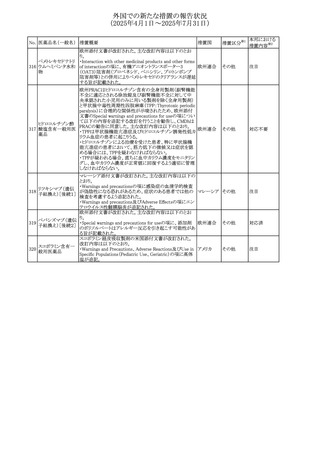
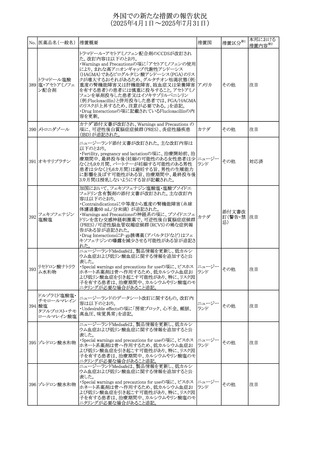
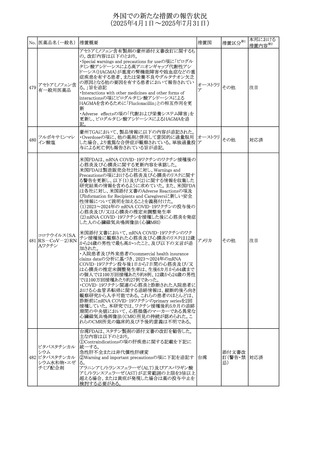
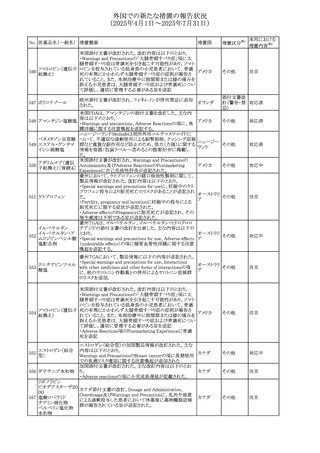
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
フレマネズマブの米国添付文書が改訂された。主な内容は
フレマネズマブ(遺 以下のとおり。
41
アメリカ
その他
伝子組換え)
Warnings and Precautions、Adverse Reactionsの項に、高血
圧、レイノー現象を追記する。
米国添付文書が改訂され、Adverse Reactionsの項に、急性
42 ミノサイクリン塩酸塩 熱性好中球性皮膚症(Sweet症候群)、特発性頭蓋内圧亢 アメリカ
その他
進症が追記された。
米国FDAは、ヘパリンナトリウム(注射剤)の添付文書を改訂
した。主な内容は以下のとおり。
①Contraindicationsの項に、「適切な血液凝固検査(全血
凝固時間、部分トロンボプラスチン時間など)を適切な間隔
で実施できない患者(この禁忌は最大用量ヘパリンに関す
るものであり、低用量ヘパリンを投与されている患者では通
常、凝固パラメータをモニタリングする必要はない)」を追
添付文書改
43 ヘパリンナトリウム 記。
アメリカ
訂(警告・禁
②Warnings and Precautionsの凝固テストと監視の項に、
忌)
「最大用量のヘパリン療法を使用する場合は、頻繁な血液
凝固検査に基づいてヘパリン用量を調整すること。凝固検
査が過度に長引く場合、または出血が起こった場合は、ヘ
パリンナトリウムを直ちに中止する必要がある。ヘパリン療法
の全過程を通じて、定期的に血小板数、ヘマトクリットを測
定することが推奨される」を追記。
豪州添付文書が改訂され、Special warnings and
セファゾリンナトリウ
オーストラリ
44
precautions for use及びAdverse effects (undesirable
その他
ム
ア
effects)の項にコーニス症候群が追記された。
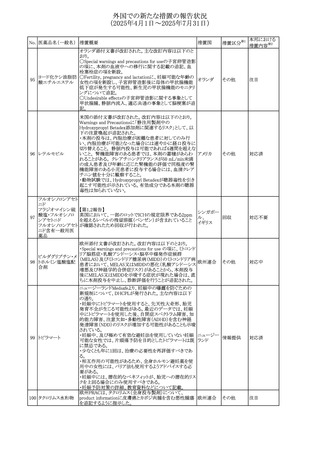
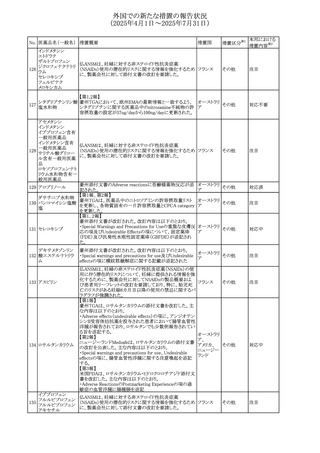
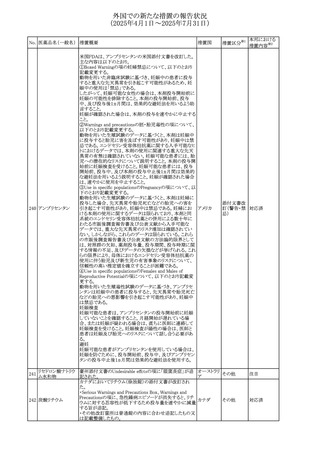
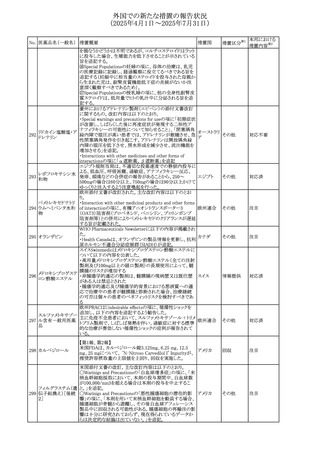
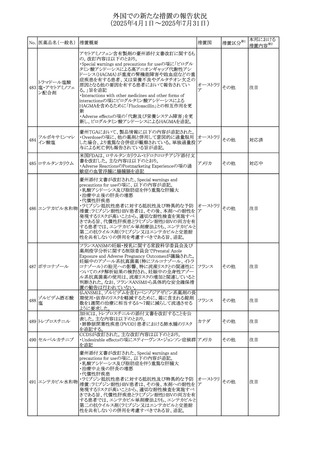
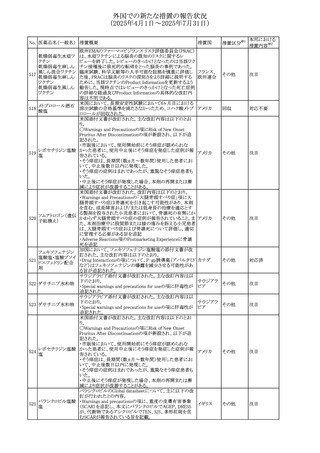
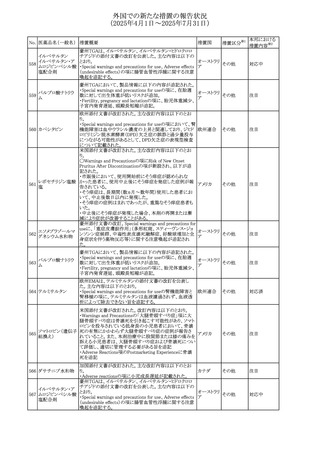
45
フルオロウラシル
カペシタビン
【第1報、第2報】
加国HCは、ジヒドロピリミジン脱水素酵素(DPD)欠損患者
におけるフルオロウラシル及びカペシタビンの使用リスクに
関して医療関係者に情報提供した。
・医療従事者はDPD欠損に関連するリスクを認識し、重篤な
副作用の可能性について、治療前に患者に知らせること。
重篤な副作用が発現した場合は、カペシタビン錠の服用を
中止し、直ちに医師の診察を受けるよう助言すること。重篤
な副作用の徴候が見られた場合には中止すること。
・DPD欠損の検査は、カペシタビン、フルオロウラシル注射
液による治療を行う前に、現在のガイドラインに基づいて検
カナダ
討すること。
・DPD欠損の遺伝子型検査のほとんどは、特定の変異体を
検出する標的アッセイを用いている。非ヨーロッパ系血統の
患者のように、標的遺伝学的検査に通常含まれないDPYD
変異体を持っている場合があること。
・DPD欠損が認識されていない患者、検査で陰性である患
者は、急性過量投与となり生命を脅かす毒性が発生する可
能性がある。グレード2から4の急性毒性が発現した場合は、
直ちに治療を中止すること。観察された毒性の発現、持続
時間、重症度の臨床的評価に基づいて、恒久的な中止を
検討する必要がある。
情報提供
台湾食品医薬品局は、本剤による腱炎、腱断裂、末梢神経
レボフロキサシン水 障害、中枢神経系への影響(精神神経系及び神経系副作
46
台湾
その他
和物
用など)など長期間にわたる不可逆的な副作用についての
注意喚起を追記するよう勧告した。
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Contraindicationsの項にコケイン症候群の患者を追記。
添付文書改
・Contraindications及びAdverse effects (undesirable
オーストラリ
47 メトロニダゾール
訂(警告・禁
effects)の項に、コケイン症候群患者へのメトロニダゾールの ア
忌)
全身使用において、急速に発症し致死的転帰を伴う症例を
含む、重度の不可逆的肝毒性、急性肝不全の症例が報告
されている旨を追記。
豪州においてメドロキシプロゲステロン酢酸エステルの添付
文書が改訂された。主な内容は以下のとおり。
メドロキシプロゲステ ・WARNINGS AND PRECAUTIONSのBreast Cancerの項
オーストラリ
48
その他
ロン酢酸エステル に、「メタ解析の結果、エストロゲン及び黄体ホルモン併用 ア
療法を5年以上行った場合、乳癌のリスク上昇は治療中止
後10年以上継続する可能性がある」旨を追記
欧州において、イバンドロン酸ナトリウムの後発品のRMPに
イバンドロン酸ナトリ ついて、先発品と同様に「長骨の非定型骨折」を重要な特
49
欧州連合 その他
ウム水和物
定されたリスクに追加し、「大腿骨の非定型骨折」を重要な
潜在的リスクから削除された。
6
本邦における
措置内容※2
注目
対応済
注目
対応済
注目
対応済
注目
注目
対応済
(2025年4月1日~2025年7月31日)
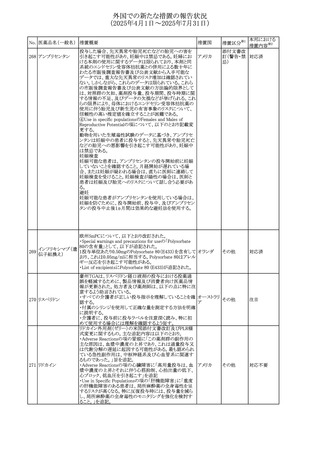
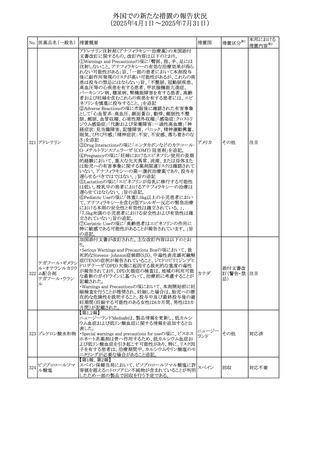
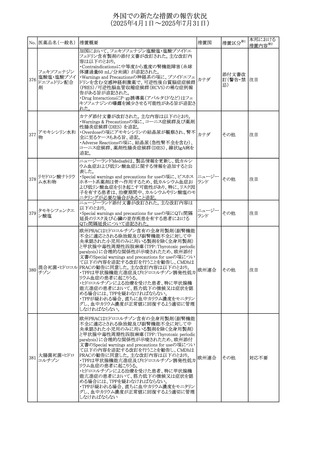
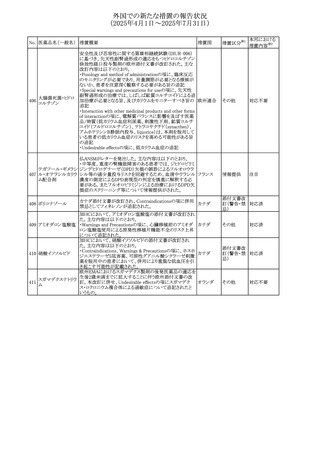
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
フレマネズマブの米国添付文書が改訂された。主な内容は
フレマネズマブ(遺 以下のとおり。
41
アメリカ
その他
伝子組換え)
Warnings and Precautions、Adverse Reactionsの項に、高血
圧、レイノー現象を追記する。
米国添付文書が改訂され、Adverse Reactionsの項に、急性
42 ミノサイクリン塩酸塩 熱性好中球性皮膚症(Sweet症候群)、特発性頭蓋内圧亢 アメリカ
その他
進症が追記された。
米国FDAは、ヘパリンナトリウム(注射剤)の添付文書を改訂
した。主な内容は以下のとおり。
①Contraindicationsの項に、「適切な血液凝固検査(全血
凝固時間、部分トロンボプラスチン時間など)を適切な間隔
で実施できない患者(この禁忌は最大用量ヘパリンに関す
るものであり、低用量ヘパリンを投与されている患者では通
常、凝固パラメータをモニタリングする必要はない)」を追
添付文書改
43 ヘパリンナトリウム 記。
アメリカ
訂(警告・禁
②Warnings and Precautionsの凝固テストと監視の項に、
忌)
「最大用量のヘパリン療法を使用する場合は、頻繁な血液
凝固検査に基づいてヘパリン用量を調整すること。凝固検
査が過度に長引く場合、または出血が起こった場合は、ヘ
パリンナトリウムを直ちに中止する必要がある。ヘパリン療法
の全過程を通じて、定期的に血小板数、ヘマトクリットを測
定することが推奨される」を追記。
豪州添付文書が改訂され、Special warnings and
セファゾリンナトリウ
オーストラリ
44
precautions for use及びAdverse effects (undesirable
その他
ム
ア
effects)の項にコーニス症候群が追記された。
45
フルオロウラシル
カペシタビン
【第1報、第2報】
加国HCは、ジヒドロピリミジン脱水素酵素(DPD)欠損患者
におけるフルオロウラシル及びカペシタビンの使用リスクに
関して医療関係者に情報提供した。
・医療従事者はDPD欠損に関連するリスクを認識し、重篤な
副作用の可能性について、治療前に患者に知らせること。
重篤な副作用が発現した場合は、カペシタビン錠の服用を
中止し、直ちに医師の診察を受けるよう助言すること。重篤
な副作用の徴候が見られた場合には中止すること。
・DPD欠損の検査は、カペシタビン、フルオロウラシル注射
液による治療を行う前に、現在のガイドラインに基づいて検
カナダ
討すること。
・DPD欠損の遺伝子型検査のほとんどは、特定の変異体を
検出する標的アッセイを用いている。非ヨーロッパ系血統の
患者のように、標的遺伝学的検査に通常含まれないDPYD
変異体を持っている場合があること。
・DPD欠損が認識されていない患者、検査で陰性である患
者は、急性過量投与となり生命を脅かす毒性が発生する可
能性がある。グレード2から4の急性毒性が発現した場合は、
直ちに治療を中止すること。観察された毒性の発現、持続
時間、重症度の臨床的評価に基づいて、恒久的な中止を
検討する必要がある。
情報提供
台湾食品医薬品局は、本剤による腱炎、腱断裂、末梢神経
レボフロキサシン水 障害、中枢神経系への影響(精神神経系及び神経系副作
46
台湾
その他
和物
用など)など長期間にわたる不可逆的な副作用についての
注意喚起を追記するよう勧告した。
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Contraindicationsの項にコケイン症候群の患者を追記。
添付文書改
・Contraindications及びAdverse effects (undesirable
オーストラリ
47 メトロニダゾール
訂(警告・禁
effects)の項に、コケイン症候群患者へのメトロニダゾールの ア
忌)
全身使用において、急速に発症し致死的転帰を伴う症例を
含む、重度の不可逆的肝毒性、急性肝不全の症例が報告
されている旨を追記。
豪州においてメドロキシプロゲステロン酢酸エステルの添付
文書が改訂された。主な内容は以下のとおり。
メドロキシプロゲステ ・WARNINGS AND PRECAUTIONSのBreast Cancerの項
オーストラリ
48
その他
ロン酢酸エステル に、「メタ解析の結果、エストロゲン及び黄体ホルモン併用 ア
療法を5年以上行った場合、乳癌のリスク上昇は治療中止
後10年以上継続する可能性がある」旨を追記
欧州において、イバンドロン酸ナトリウムの後発品のRMPに
イバンドロン酸ナトリ ついて、先発品と同様に「長骨の非定型骨折」を重要な特
49
欧州連合 その他
ウム水和物
定されたリスクに追加し、「大腿骨の非定型骨折」を重要な
潜在的リスクから削除された。
6
本邦における
措置内容※2
注目
対応済
注目
対応済
注目
対応済
注目
注目
対応済