よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
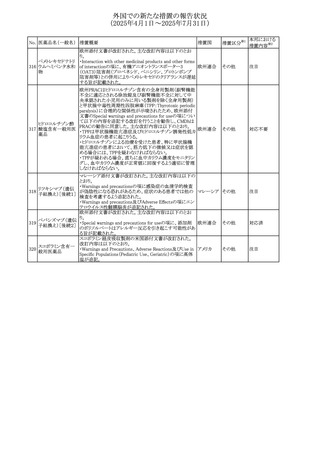
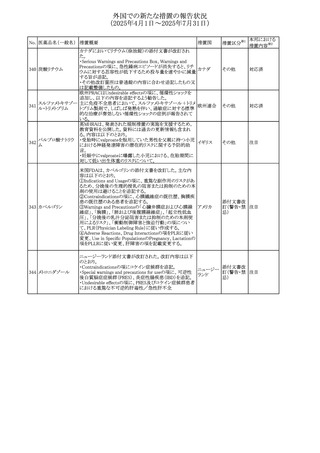
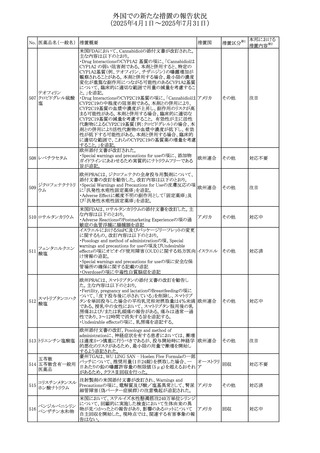
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
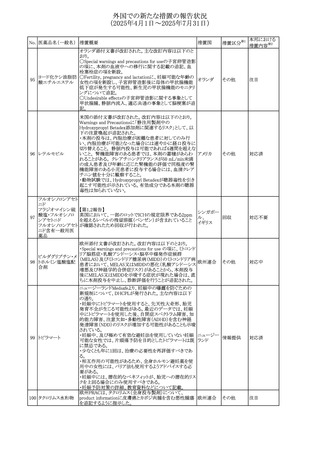
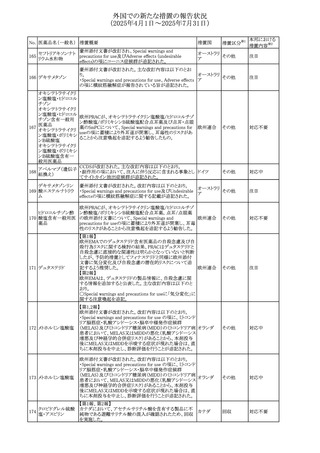
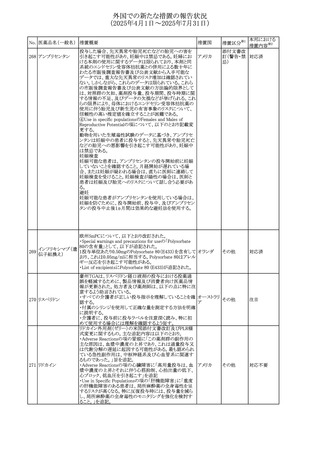
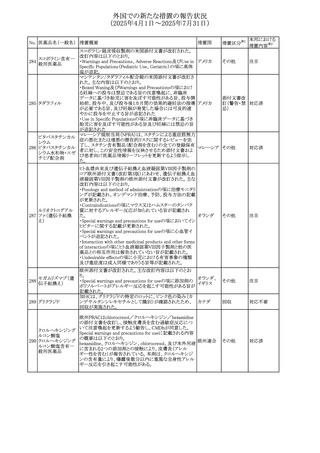
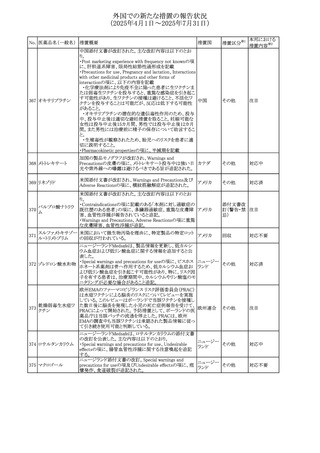
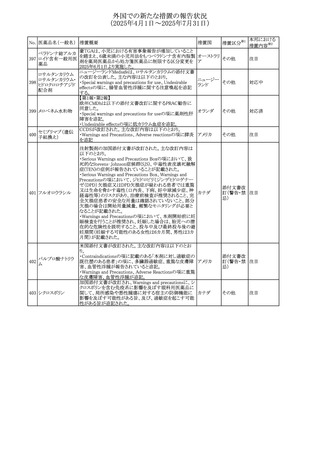
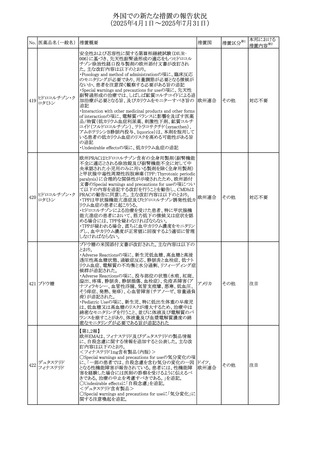
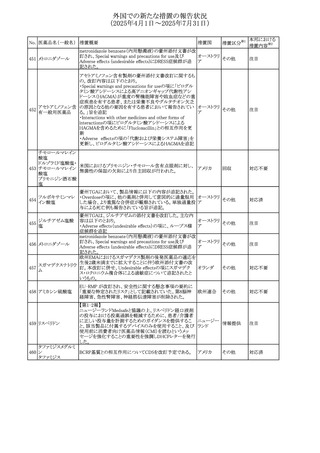
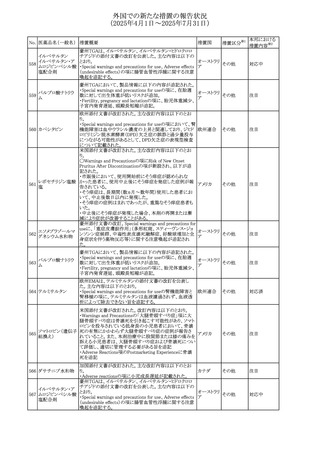
No. 医薬品名(一般名) 措置概要
240 アンブリセンタン
措置国
米国FDAは、アンブリセンタンの米国添付文書を改訂した。
主な内容は以下のとおり。
①Boxed Warningの項の妊婦禁忌について、以下のとおり
記載変更する。
動物を用いた非臨床試験に基づき、妊娠中の患者に投与
すると重大な先天異常を引き起こす可能性があるため、妊
娠中の使用は「禁忌」である。
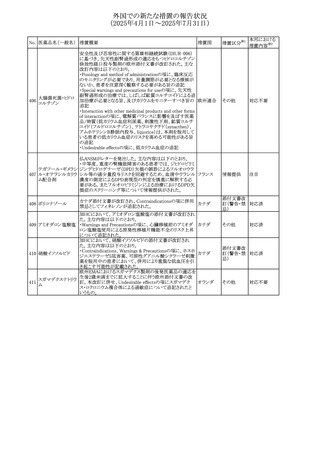
したがって、妊娠可能な女性の場合は、本剤投与開始前に
妊娠の可能性を排除すること。本剤の投与開始前、投与
中、及び投与後1ヵ月間は、効果的な避妊法を用いるよう助
言すること。
妊娠が確認された場合は、本剤の投与を速やかに中止する
こと。
②Warnings and precautionsの胚・胎児毒性の項について、
以下のとおり記載変更する。
動物を用いた生殖試験のデータに基づくと、本剤は妊娠中
に投与すると胎児に害を及ぼす可能性があり、妊娠中は禁
忌である。エンドセリン受容体拮抗薬に関する入手可能なヒ
トにおけるデータでは、本剤の使用に関連する重大な先天
異常の有無は確認されていない。妊娠可能な患者には、胎
児への潜在的なリスクについて説明すること。本剤の投与開
始前に妊娠検査を受けること。妊娠可能な患者には、投与
開始前、投与中、及び本剤の投与中止後1ヵ月間は効果的
な避妊法を用いるよう説明すること。妊娠が確認された場合
は、速やかに使用を中止すること。
③Use in specific populationsのPregnancyの項について、以
下のとおり記載変更する。
動物を用いた生殖試験のデータに基づくと、本剤は妊婦に
投与した場合、先天異常や胎児死亡などの胎児への害を
引き起こす可能性があり、妊娠中は禁忌である。妊婦にお アメリカ
ける本剤の使用に関するデータは限られており、本剤と同
系統のエンドセリン受容体拮抗薬との併用による数十年に
わたる市販後調査報告書及び公表文献から入手可能な
データでは、重大な先天異常のリスク増加は確認されてい
ない。しかしながら、これらのデータは限られている。これら
の市販後調査報告書及び公表文献の方法論的限界として
は、対照群の欠如、薬剤投与量、投与期間、投与時期に関
する情報の不足、及びデータの欠損などが挙げられる。これ
らの限界により、母体におけるエンドセリン受容体拮抗薬の
使用に伴う胎児及び新生児の有害事象のリスクについて、
信頼性の高い推定値を確立することが困難である。
④Use in specific populationsのFemales and Males of
Reproductive Potentialの項について、以下のとおり記載変
更する。
動物を用いた生殖毒性試験のデータに基づき、アンブリセ
ンタンは妊娠中の患者に投与すると、先天異常や胎児死亡
などの胎児への悪影響を引き起こす可能性があり、妊娠中
は禁忌である。
妊娠検査
妊娠可能な患者は、アンブリセンタンの投与開始前に妊娠
していないことを確認すること。月経開始が遅れている場
合、または妊娠が疑われる場合は、直ちに医師に連絡して
妊娠検査を受けること。妊娠検査が陽性の場合は、医師と
患者は妊娠及び胎児へのリスクについて話し合う必要があ
る。
避妊
妊娠可能な患者がアンブリセンタンを使用している場合は、
妊娠を防ぐために、投与開始前、投与中、及びアンブリセン
タンの投与中止後1ヵ月間は効果的な避妊法を使用する。
措置区分※1
添付文書改
訂(警告・禁 対応済
忌)
リセドロン酸ナトリウ 豪州添付文書のUndesirable effctsの項に「眼窩炎症」が追 オーストラリ
その他
ム水和物
記された。
ア
カナダにおいてリチウム(徐放錠)の添付文書が改訂され
た。
・Serious Warnings and Precautions Box、Warnings and
Precautionsの項に、急性躁病エピソードが消失すると、リチ
242 炭酸リチウム
カナダ
その他
ウムに対する忍容性が低下するため投与量を速やかに減量
する旨が追記。
・その他改訂箇所は普通錠の内容に合わせ追記したもの又
は記載整備したもの。
241
28
本邦における
措置内容※2
注目
対応済
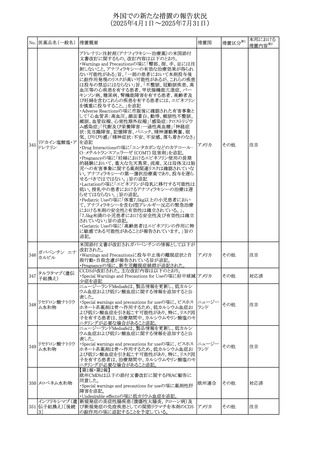
(2025年4月1日~2025年7月31日)
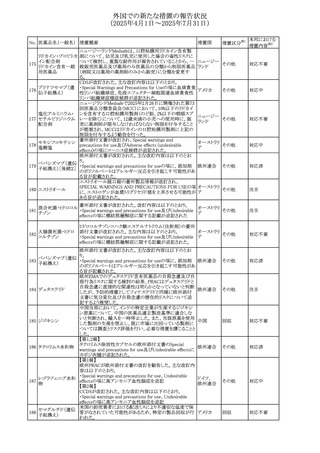
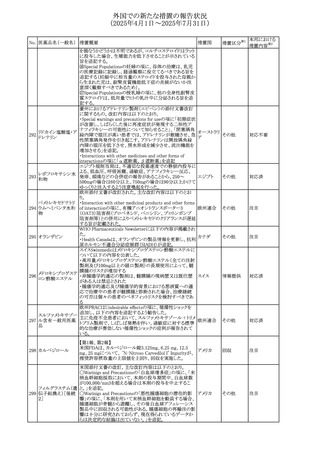
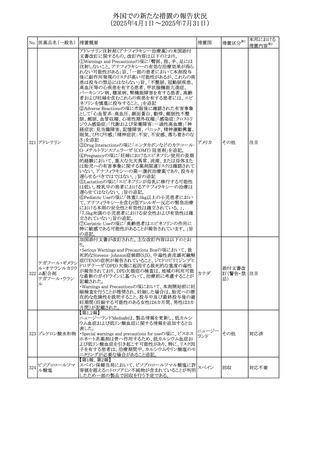
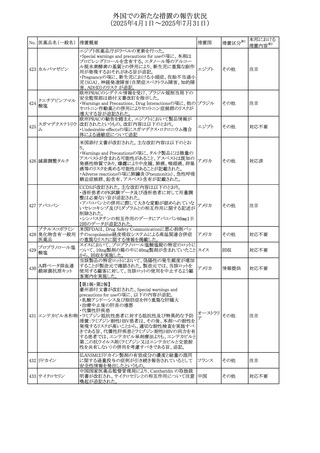
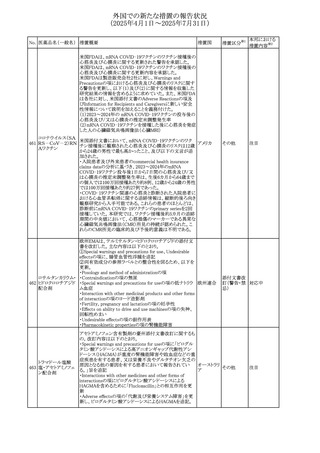
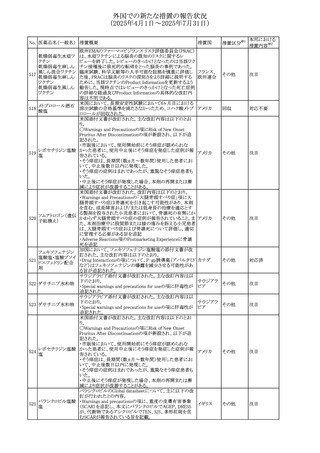
No. 医薬品名(一般名) 措置概要
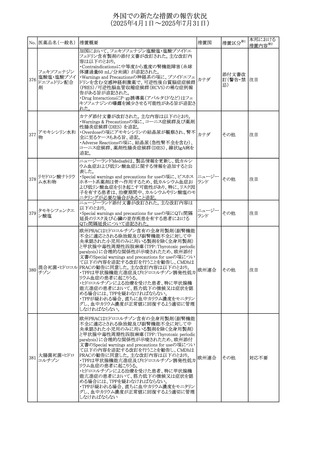
240 アンブリセンタン
措置国
米国FDAは、アンブリセンタンの米国添付文書を改訂した。
主な内容は以下のとおり。
①Boxed Warningの項の妊婦禁忌について、以下のとおり
記載変更する。
動物を用いた非臨床試験に基づき、妊娠中の患者に投与
すると重大な先天異常を引き起こす可能性があるため、妊
娠中の使用は「禁忌」である。
したがって、妊娠可能な女性の場合は、本剤投与開始前に
妊娠の可能性を排除すること。本剤の投与開始前、投与
中、及び投与後1ヵ月間は、効果的な避妊法を用いるよう助
言すること。
妊娠が確認された場合は、本剤の投与を速やかに中止する
こと。
②Warnings and precautionsの胚・胎児毒性の項について、
以下のとおり記載変更する。
動物を用いた生殖試験のデータに基づくと、本剤は妊娠中
に投与すると胎児に害を及ぼす可能性があり、妊娠中は禁
忌である。エンドセリン受容体拮抗薬に関する入手可能なヒ
トにおけるデータでは、本剤の使用に関連する重大な先天
異常の有無は確認されていない。妊娠可能な患者には、胎
児への潜在的なリスクについて説明すること。本剤の投与開
始前に妊娠検査を受けること。妊娠可能な患者には、投与
開始前、投与中、及び本剤の投与中止後1ヵ月間は効果的
な避妊法を用いるよう説明すること。妊娠が確認された場合
は、速やかに使用を中止すること。
③Use in specific populationsのPregnancyの項について、以
下のとおり記載変更する。
動物を用いた生殖試験のデータに基づくと、本剤は妊婦に
投与した場合、先天異常や胎児死亡などの胎児への害を
引き起こす可能性があり、妊娠中は禁忌である。妊婦にお アメリカ
ける本剤の使用に関するデータは限られており、本剤と同
系統のエンドセリン受容体拮抗薬との併用による数十年に
わたる市販後調査報告書及び公表文献から入手可能な
データでは、重大な先天異常のリスク増加は確認されてい
ない。しかしながら、これらのデータは限られている。これら
の市販後調査報告書及び公表文献の方法論的限界として
は、対照群の欠如、薬剤投与量、投与期間、投与時期に関
する情報の不足、及びデータの欠損などが挙げられる。これ
らの限界により、母体におけるエンドセリン受容体拮抗薬の
使用に伴う胎児及び新生児の有害事象のリスクについて、
信頼性の高い推定値を確立することが困難である。
④Use in specific populationsのFemales and Males of
Reproductive Potentialの項について、以下のとおり記載変
更する。
動物を用いた生殖毒性試験のデータに基づき、アンブリセ
ンタンは妊娠中の患者に投与すると、先天異常や胎児死亡
などの胎児への悪影響を引き起こす可能性があり、妊娠中
は禁忌である。
妊娠検査
妊娠可能な患者は、アンブリセンタンの投与開始前に妊娠
していないことを確認すること。月経開始が遅れている場
合、または妊娠が疑われる場合は、直ちに医師に連絡して
妊娠検査を受けること。妊娠検査が陽性の場合は、医師と
患者は妊娠及び胎児へのリスクについて話し合う必要があ
る。
避妊
妊娠可能な患者がアンブリセンタンを使用している場合は、
妊娠を防ぐために、投与開始前、投与中、及びアンブリセン
タンの投与中止後1ヵ月間は効果的な避妊法を使用する。
措置区分※1
添付文書改
訂(警告・禁 対応済
忌)
リセドロン酸ナトリウ 豪州添付文書のUndesirable effctsの項に「眼窩炎症」が追 オーストラリ
その他
ム水和物
記された。
ア
カナダにおいてリチウム(徐放錠)の添付文書が改訂され
た。
・Serious Warnings and Precautions Box、Warnings and
Precautionsの項に、急性躁病エピソードが消失すると、リチ
242 炭酸リチウム
カナダ
その他
ウムに対する忍容性が低下するため投与量を速やかに減量
する旨が追記。
・その他改訂箇所は普通錠の内容に合わせ追記したもの又
は記載整備したもの。
241
28
本邦における
措置内容※2
注目
対応済