よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (73 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
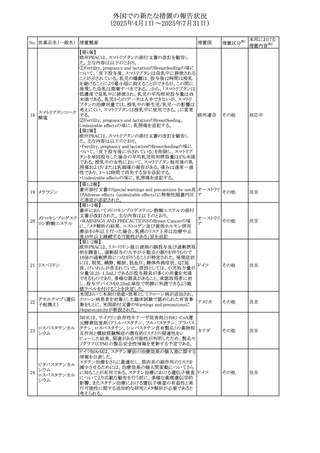
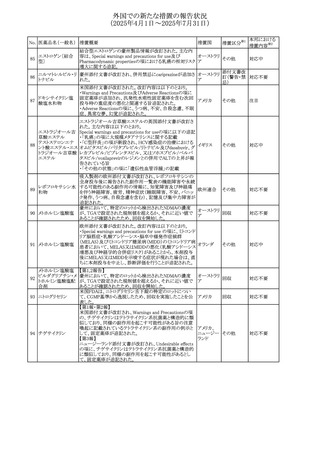
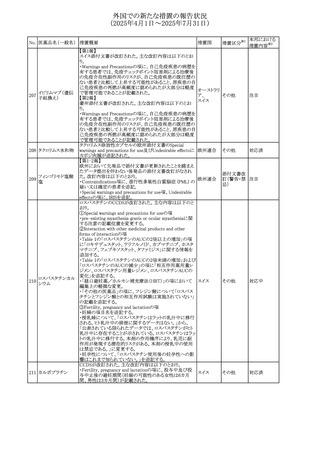
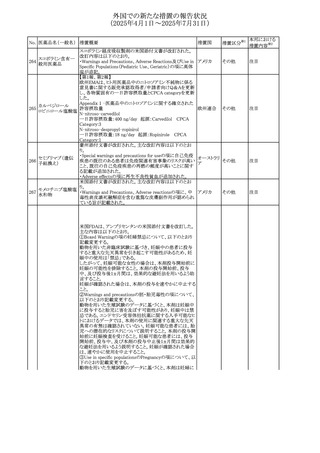
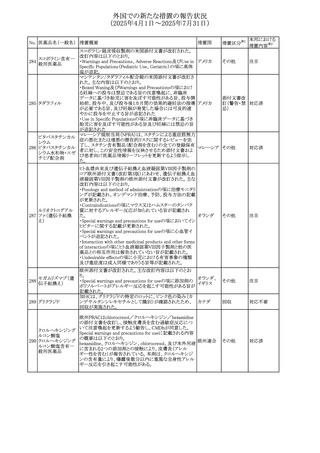
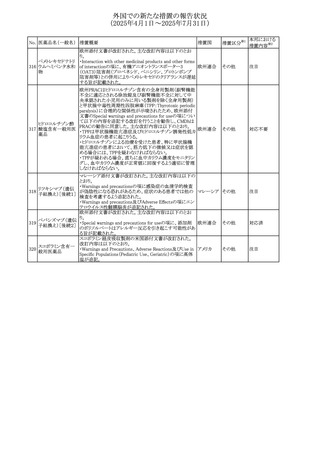
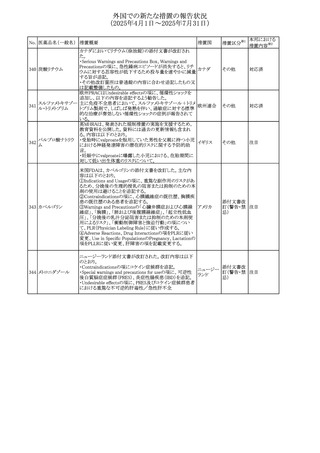
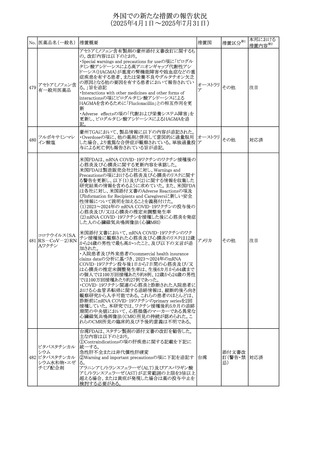
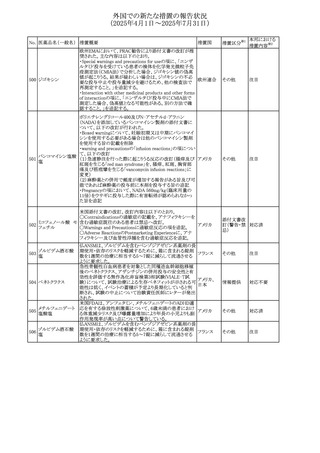
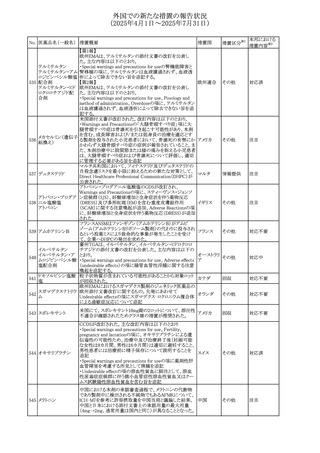
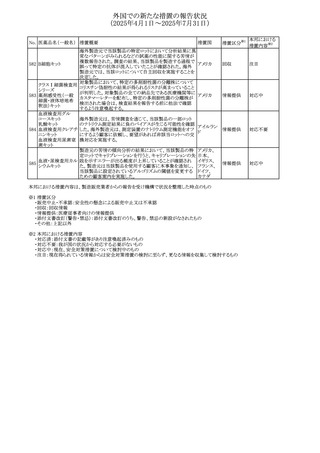
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
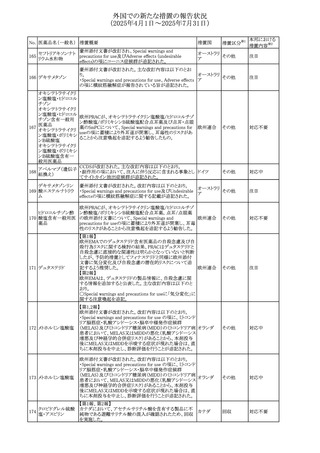
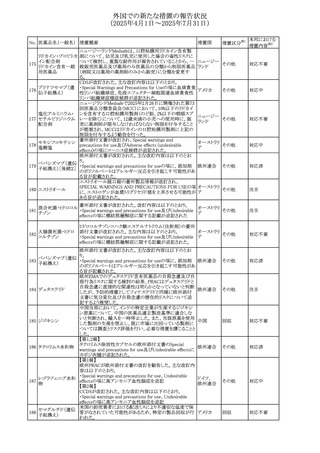
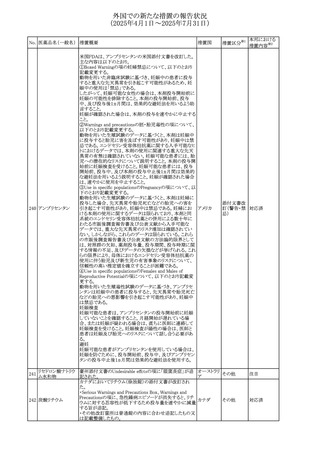
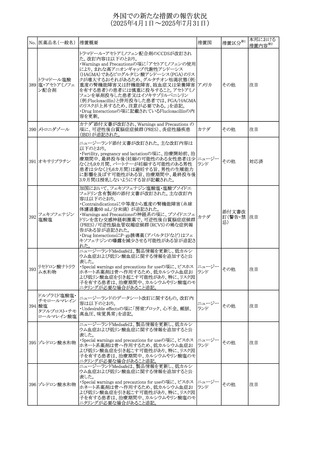
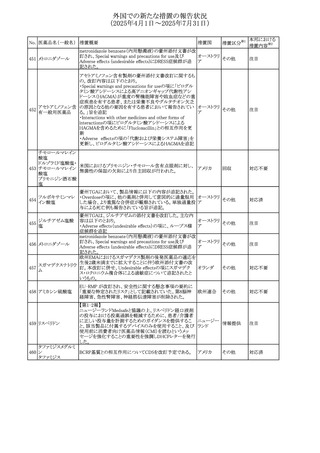
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
【第1報】
欧州EMAは、テルミサルタンの添付文書の改訂を公表し
た。主な内容は以下のとおり。
テルミサルタン
・Special warnings and precautions for useの腎機能障害と
テルミサルタン・アム 腎移植の項に、テルミサルタンは血液濾過されず、血液透
ロジピンベシル酸塩 析によって除去できない旨を追記する。
535 配合剤
【第2報】
欧州連合 その他
テルミサルタン・ヒド 欧州EMAは、テルミサルタンの添付文書の改訂を公表し
ロクロロチアジド配 た。主な内容は以下のとおり。
合剤
・Special warnings and precautions for use、Posology and
method of administration、Overdoseの項に、テルミサルタン
は血液濾過されず、血液透析によって除去できない旨を追
記する。
米国添付文書が改訂された。改訂内容は以下のとおり。
・Warnings and Precautionsの「大腿骨頭すべり症」項に大
腿骨頭すべり症は骨壊死を引き起こす可能性があり、本剤
を含む、成長障害および/または低身長の治療を適応とす
メカセルミン(遺伝子
536
る製剤を投与された小児患者において、骨壊死の有無にか アメリカ
その他
組換え)
かわらず大腿骨頭すべり症の症例が報告されていること。ま
た、本剤治療中に股関節または膝の痛みを訴える小児患者
は、大腿骨頭すべり症および骨壊死について評価し、適切
に管理する必要がある旨を追記
マルタ共和国において、フィナステリド及びデュタステリドの
自殺念慮リスクを最小限に抑えるための新たな対策として、
537 デュタステリド
マルタ
情報提供
Direct Healthcare Professional Communication(DHPC)が
公表された。
アトバコン・プログアニル塩酸塩のGDSが改訂され、
Warnings and Precautionsの項に、スティーヴンス・ジョンソ
アトバコン・プログア ン症候群(SJS)、好酸球増加と全身症状を伴う薬物反応
538 ニル塩酸塩
(DRESS)及び多形紅斑(EM)を含む重度皮膚副作用
イギリス
その他
アトバコン
(SCAR)に関する注意喚起が追加、Adverse Reactionsの項
に、好酸球増加と全身症状を伴う薬物反応(DRESS)が追加
された。
フランスANSMはファンギゾン(アムホテリシンB)がアムビ
ゾーム(アムホテリシンBリポソーム製剤)の代わりに投与され
539 アムホテリシンB
フランス
その他
るという投薬ミスにより致命的な事象が発生したことを受け
て、企業へDHPCの発出を求めた。
豪州TGAは、イルベサルタン、イルベサルタン・ヒドロクロロ
イルベサルタン
チアジドの添付文書の改訂を公表した。主な内容は以下の
イルベサルタン・ア とおり。
オーストラリ
540
その他
ムロジピンベシル酸 ・Special warnings and precautions for use、Adverse effects ア
塩配合剤
(undesirable effects)の項に腸管血管性浮腫に関する注意
喚起を追記する。
ドキソルビシン塩酸 粒子状物質が含まれている可能性があることから対象ロット
541
カナダ
回収
塩
が回収された。
欧州EMAにおけるスガマデクス製剤のジェネリック医薬品の
スガマデクスナトリウ 欧州添付文書改訂に関するもの。先発にあわせて
542
オランダ
その他
ム
Undesirable effectsの項にスガマデクス‐ロクロニウム複合体
による過敏症反応について追記
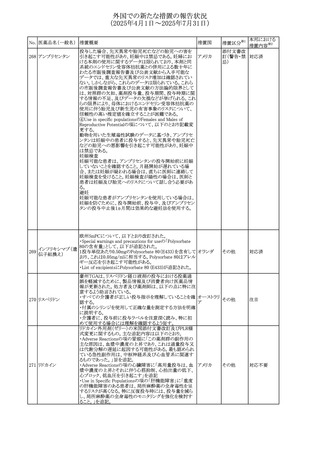
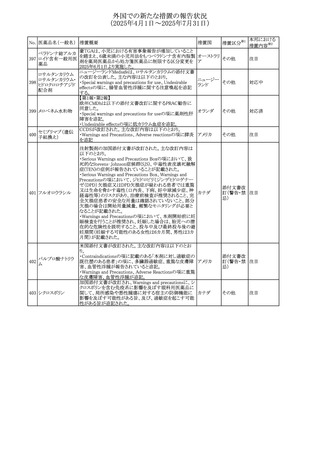
本邦における
措置内容※2
対応済
注目
注目
注目
対応不要
対応中
対応不要
対応不要
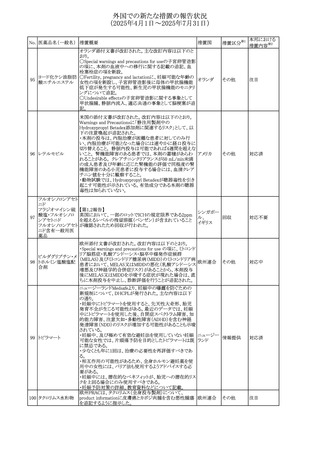
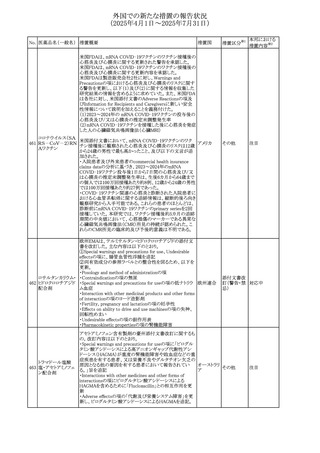
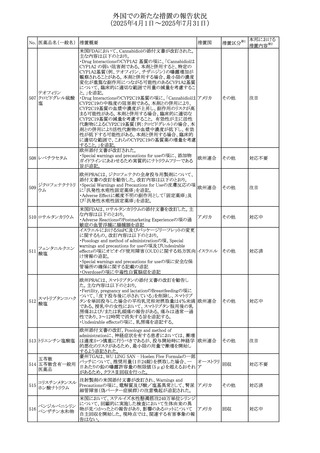
543 スボレキサント
米国にて、スボレキサント10mg錠の2ロットについて、溶出性
アメリカ
不適合が確認されたためクラスⅢの措置が推奨された。
回収
対応不要
544 オキサリプラチン
CCDSが改訂された。主な改訂内容は以下のとおり
・Special warnings and precautions for use、Fertility,
pregnancy and lactationの項に、オキサリプラチンによる遺
伝毒性の可能性ため、治療中及び治療終了後(妊娠可能
な女性は9カ月間、男性は6カ月間)は適切に避妊すること、
男性患者には治療前に精子保存について説明することを
スイス
追記
・Special warnings and precautions for useの項に薬剤性肝
血管障害を考慮する所見として脾腫を追記
・Undesirable effectの項の溶血性貧血に脚注として、溶血
性尿毒症症候群に伴う微小血管症性溶血性貧血又はクー
ムス試験陽性溶血性貧血を含む旨を追記
その他
対応済
545 メラトニン
中国における本剤の承認審査過程で、メラトニンの代謝物
であり製剤中に検出される不純物でもあるAFMKについて、
ICH-M7を参考に許容摂取量を中国当局と議論した結果、 中国
中国と日本における添付文書上の承認用量の最大用量
(4mg→2mg、通常用量は国内と同じ)が異なることとなった。
その他
注目
73
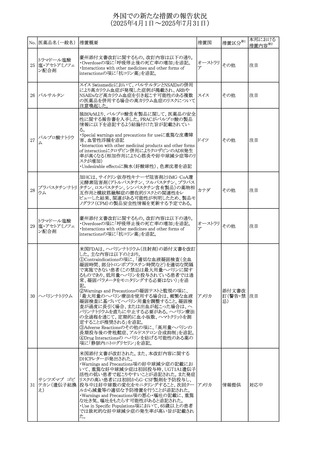
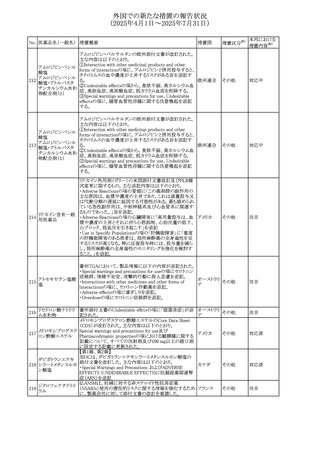
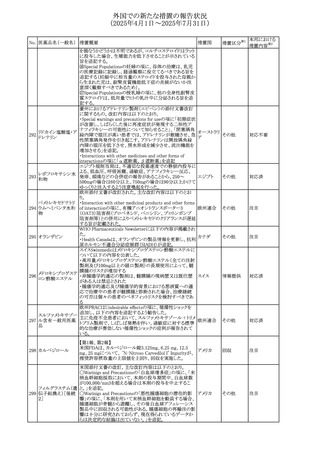
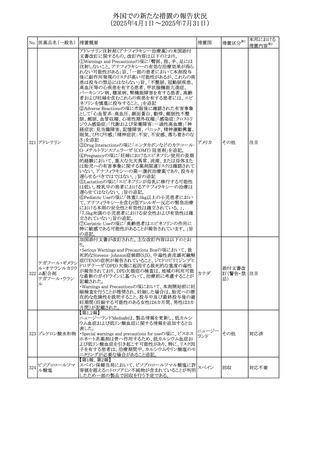
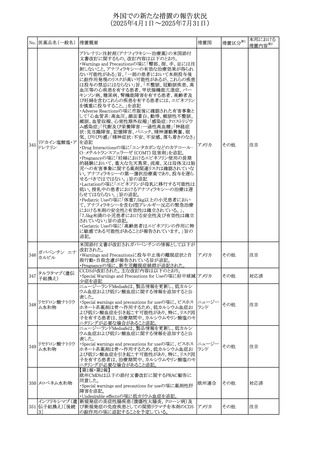
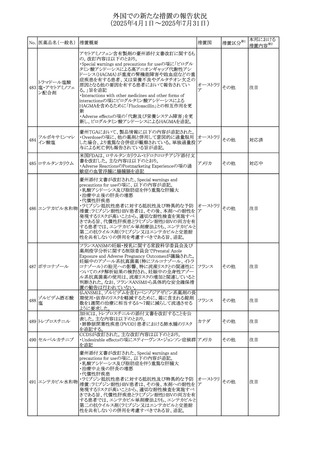
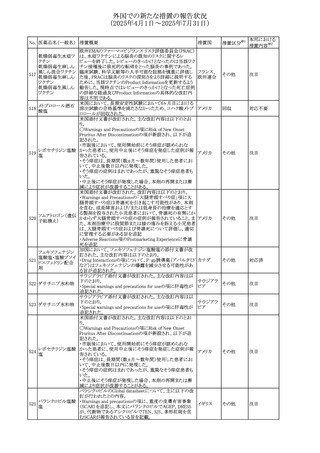
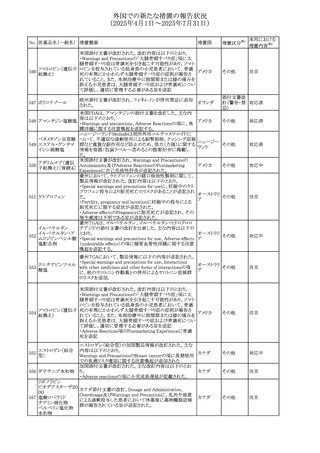
(2025年4月1日~2025年7月31日)
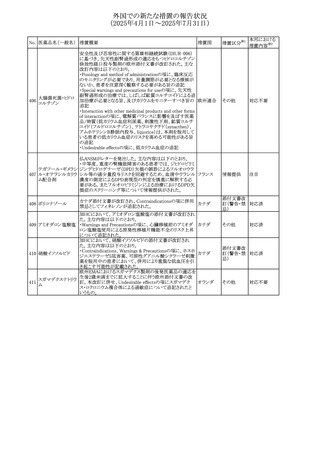
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
【第1報】
欧州EMAは、テルミサルタンの添付文書の改訂を公表し
た。主な内容は以下のとおり。
テルミサルタン
・Special warnings and precautions for useの腎機能障害と
テルミサルタン・アム 腎移植の項に、テルミサルタンは血液濾過されず、血液透
ロジピンベシル酸塩 析によって除去できない旨を追記する。
535 配合剤
【第2報】
欧州連合 その他
テルミサルタン・ヒド 欧州EMAは、テルミサルタンの添付文書の改訂を公表し
ロクロロチアジド配 た。主な内容は以下のとおり。
合剤
・Special warnings and precautions for use、Posology and
method of administration、Overdoseの項に、テルミサルタン
は血液濾過されず、血液透析によって除去できない旨を追
記する。
米国添付文書が改訂された。改訂内容は以下のとおり。
・Warnings and Precautionsの「大腿骨頭すべり症」項に大
腿骨頭すべり症は骨壊死を引き起こす可能性があり、本剤
を含む、成長障害および/または低身長の治療を適応とす
メカセルミン(遺伝子
536
る製剤を投与された小児患者において、骨壊死の有無にか アメリカ
その他
組換え)
かわらず大腿骨頭すべり症の症例が報告されていること。ま
た、本剤治療中に股関節または膝の痛みを訴える小児患者
は、大腿骨頭すべり症および骨壊死について評価し、適切
に管理する必要がある旨を追記
マルタ共和国において、フィナステリド及びデュタステリドの
自殺念慮リスクを最小限に抑えるための新たな対策として、
537 デュタステリド
マルタ
情報提供
Direct Healthcare Professional Communication(DHPC)が
公表された。
アトバコン・プログアニル塩酸塩のGDSが改訂され、
Warnings and Precautionsの項に、スティーヴンス・ジョンソ
アトバコン・プログア ン症候群(SJS)、好酸球増加と全身症状を伴う薬物反応
538 ニル塩酸塩
(DRESS)及び多形紅斑(EM)を含む重度皮膚副作用
イギリス
その他
アトバコン
(SCAR)に関する注意喚起が追加、Adverse Reactionsの項
に、好酸球増加と全身症状を伴う薬物反応(DRESS)が追加
された。
フランスANSMはファンギゾン(アムホテリシンB)がアムビ
ゾーム(アムホテリシンBリポソーム製剤)の代わりに投与され
539 アムホテリシンB
フランス
その他
るという投薬ミスにより致命的な事象が発生したことを受け
て、企業へDHPCの発出を求めた。
豪州TGAは、イルベサルタン、イルベサルタン・ヒドロクロロ
イルベサルタン
チアジドの添付文書の改訂を公表した。主な内容は以下の
イルベサルタン・ア とおり。
オーストラリ
540
その他
ムロジピンベシル酸 ・Special warnings and precautions for use、Adverse effects ア
塩配合剤
(undesirable effects)の項に腸管血管性浮腫に関する注意
喚起を追記する。
ドキソルビシン塩酸 粒子状物質が含まれている可能性があることから対象ロット
541
カナダ
回収
塩
が回収された。
欧州EMAにおけるスガマデクス製剤のジェネリック医薬品の
スガマデクスナトリウ 欧州添付文書改訂に関するもの。先発にあわせて
542
オランダ
その他
ム
Undesirable effectsの項にスガマデクス‐ロクロニウム複合体
による過敏症反応について追記
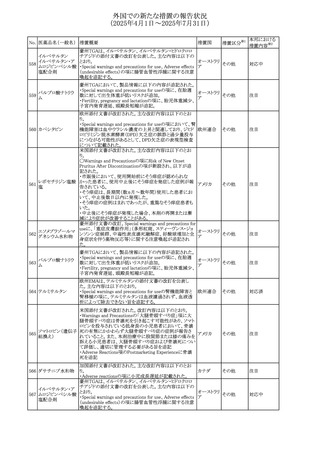
本邦における
措置内容※2
対応済
注目
注目
注目
対応不要
対応中
対応不要
対応不要
543 スボレキサント
米国にて、スボレキサント10mg錠の2ロットについて、溶出性
アメリカ
不適合が確認されたためクラスⅢの措置が推奨された。
回収
対応不要
544 オキサリプラチン
CCDSが改訂された。主な改訂内容は以下のとおり
・Special warnings and precautions for use、Fertility,
pregnancy and lactationの項に、オキサリプラチンによる遺
伝毒性の可能性ため、治療中及び治療終了後(妊娠可能
な女性は9カ月間、男性は6カ月間)は適切に避妊すること、
男性患者には治療前に精子保存について説明することを
スイス
追記
・Special warnings and precautions for useの項に薬剤性肝
血管障害を考慮する所見として脾腫を追記
・Undesirable effectの項の溶血性貧血に脚注として、溶血
性尿毒症症候群に伴う微小血管症性溶血性貧血又はクー
ムス試験陽性溶血性貧血を含む旨を追記
その他
対応済
545 メラトニン
中国における本剤の承認審査過程で、メラトニンの代謝物
であり製剤中に検出される不純物でもあるAFMKについて、
ICH-M7を参考に許容摂取量を中国当局と議論した結果、 中国
中国と日本における添付文書上の承認用量の最大用量
(4mg→2mg、通常用量は国内と同じ)が異なることとなった。
その他
注目
73