よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (76 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
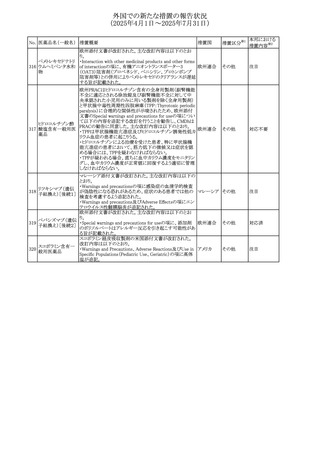
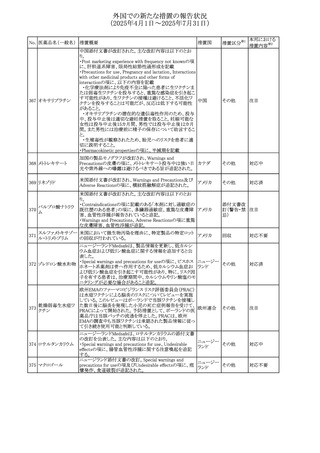
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
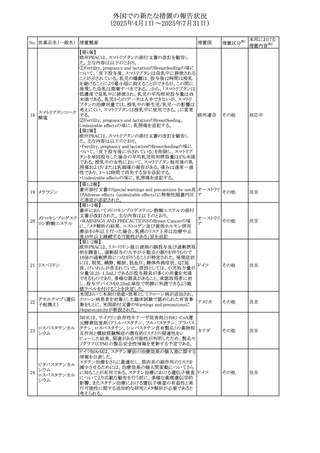
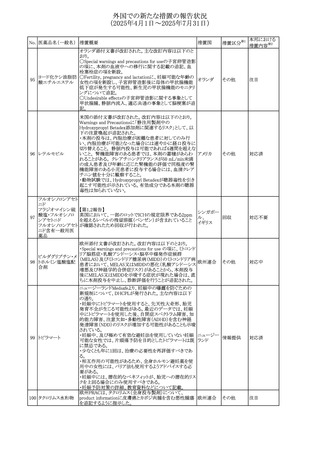
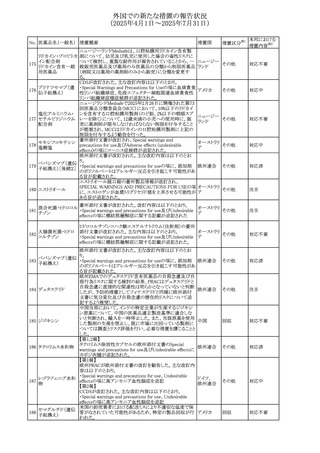
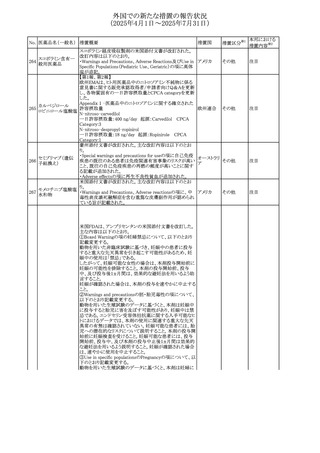
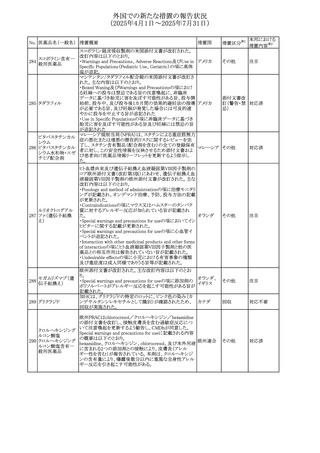
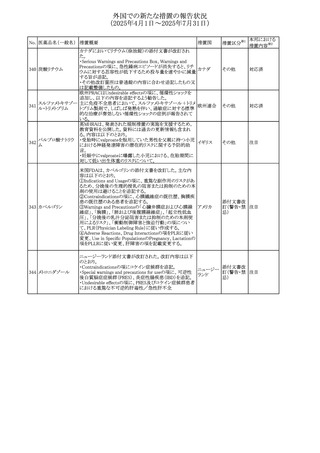
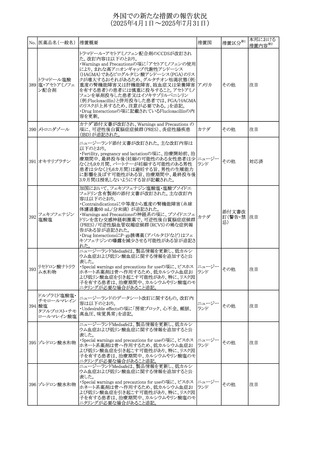
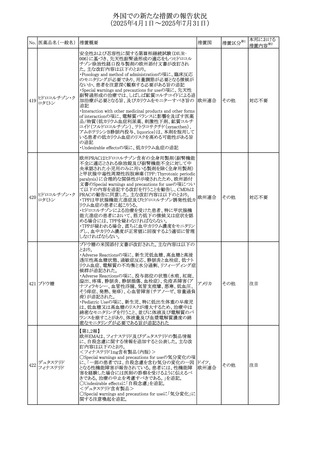
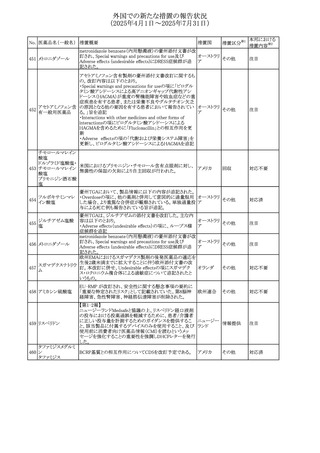
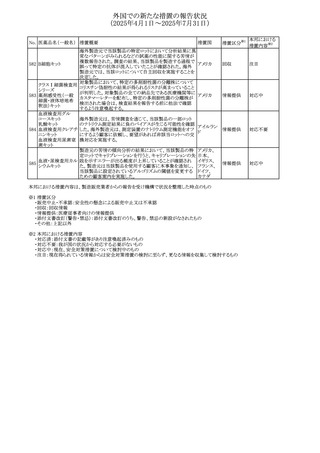
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
ビノレルビン酒石酸
オーストラリ
568
・Fertility, pregnancy and lactationの項に投与中及び投与
その他
塩
ア
後の避妊期間(妊娠の可能性のある女性は7カ月間、男性
は4カ月間)が記載された。
米国添付文書が改訂され、Warnings and Precautionsの
アダリムマブ(遺伝
569
Autoimmunity及びAdverse ReactionsのPostmarketing
アメリカ
その他
子組換え)[後続3]
Experienceに自己免疫性肝炎が追記された。
本邦における
措置内容※2
注目
対応中
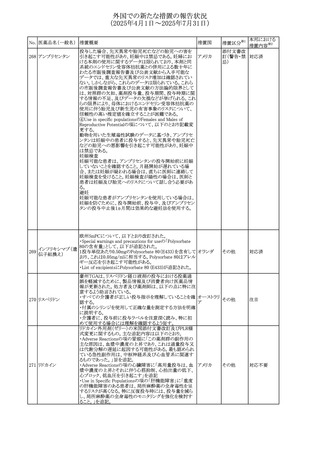
米国FDAは、マバカムテンの添付文書を改訂した。主な内
容は以下のとおり。
①Boxed Warning、Contraindicationsの項について、「中程
度のCYP2C19阻害剤」「強い CYP3A4阻害剤」の併用に関
する記載を削除(強いCYP2C19阻害剤は禁忌のまま)。
Dosage and Administrationの項について、弱い若しくは中
程度のCYP2C19阻害剤または中程度若しくは強いCYP3A4
阻害剤を併用する場合の用法・用量に関する記載を追加。
また、Drug Interactionsの項について、弱い若しくは中程度
のCYP2C19阻害剤、中程度若しくは強いCYP3A4阻害剤
の「短期使用」に対してマバカムテンの使用を中断すること
アメリカ
を推奨する旨の記載を追加。
②Dosage and Administrationの項について、治療を開始ま
たは漸増する場合は、LVEF、運動負荷後LVOT圧較差の
評価、患者の臨床状態を考慮する旨を追記。また、維持期
の患者に対する6ヵ月間隔の心エコー検査の追加。
③Warnings and Precautionsの心不全の項について、重篤
な併発疾患または不整脈がある患者では、収縮機能不全
および心不全を発症するリスクがより高い旨の記載を追加。
④Warnings and Precautionsの胎児毒性の項を追加し、本
剤投与中および最終投与後4カ月間は有効な避妊法を使
用するように助言する旨の記載を追加。
添付文書改
訂(警告・禁 対応済
忌)
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Special warnings and precautions for useの項において、ナ
トリウム制限食を摂取している患者への注意として、本剤が
ナトリウムを含むことを記載していたが、本剤が塩化ナトリウ オランダ
ム溶液で希釈して使用する旨が追記された。
・Special warnings and precautions for useの項に本剤はポリ
ソルベート20を含むため、アレルギーの既往歴を有する患
者については考慮するよう記載された。
その他
注目
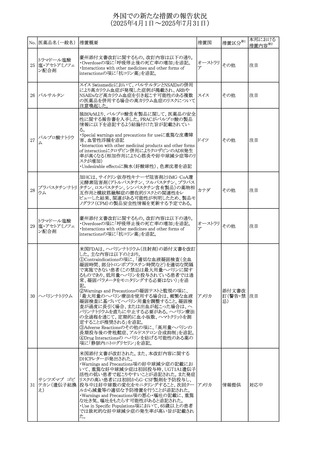
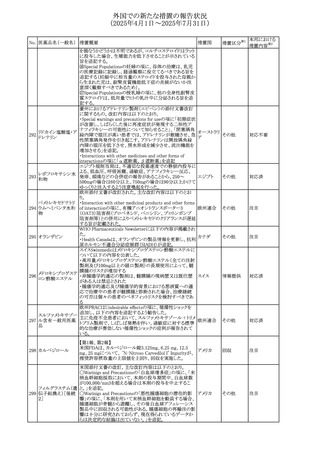
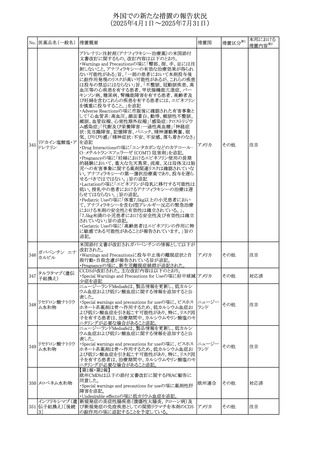
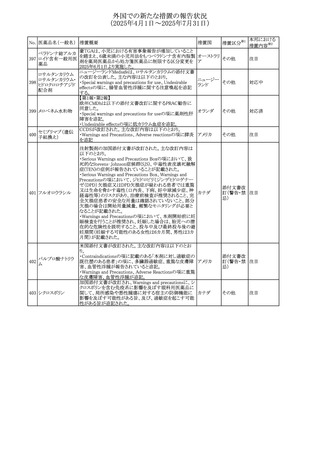
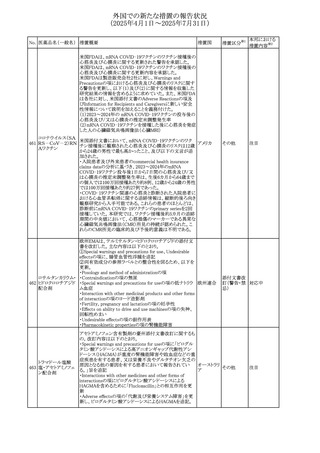
【第1報】
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Fertility, pregnancy and lactationの項に、在胎週数に比し
て小さく児(SGA)リスクが追記。
【第2報】
オーストラリ
欧州PRACは、Pregnancyの項に妊娠期間に比して小さい児
ア、
572 オクスカルバゼピン (SGA)のリスクが増加する可能性について、改訂すべきで
その他
欧州連合、
あると結論づけ、CMDhが合意したというもの。
ドイツ
【第3報】
独BfArMは以下の情報について掲載した。
欧州PRACが、妊娠期間に比して小さい児(SGA)のリスクが
増加する可能性について、改訂すべきであると結論づけ
た。
注目
アメリカ、
製造元の社内調査により、当該製品のIFUに従来から記載
カナダ、
された、特定の構成試薬の溶解後の冷凍保存条件におけ
フィブリノーゲンキッ
欧州連合、
573
る安定性を満たしていないことがわかった。このため、製造
情報提供
ト
日本、
元は全使用者に対し溶解後に冷凍保存しないよう案内する
オーストラリ
ことを決定した。
ア
対応中
570 マバカムテン
571
チスレリズマブ(遺
伝子組換え)
76
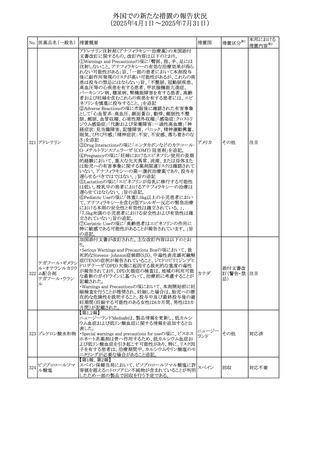
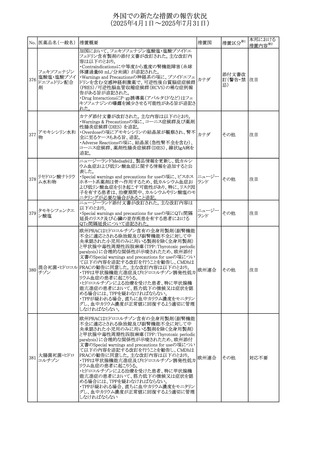
(2025年4月1日~2025年7月31日)
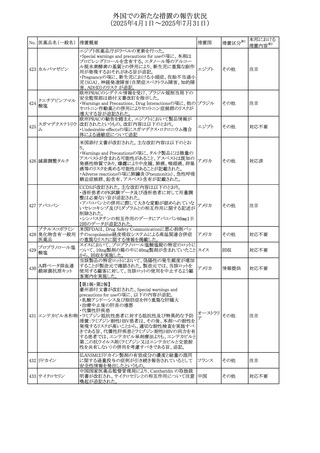
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
ビノレルビン酒石酸
オーストラリ
568
・Fertility, pregnancy and lactationの項に投与中及び投与
その他
塩
ア
後の避妊期間(妊娠の可能性のある女性は7カ月間、男性
は4カ月間)が記載された。
米国添付文書が改訂され、Warnings and Precautionsの
アダリムマブ(遺伝
569
Autoimmunity及びAdverse ReactionsのPostmarketing
アメリカ
その他
子組換え)[後続3]
Experienceに自己免疫性肝炎が追記された。
本邦における
措置内容※2
注目
対応中
米国FDAは、マバカムテンの添付文書を改訂した。主な内
容は以下のとおり。
①Boxed Warning、Contraindicationsの項について、「中程
度のCYP2C19阻害剤」「強い CYP3A4阻害剤」の併用に関
する記載を削除(強いCYP2C19阻害剤は禁忌のまま)。
Dosage and Administrationの項について、弱い若しくは中
程度のCYP2C19阻害剤または中程度若しくは強いCYP3A4
阻害剤を併用する場合の用法・用量に関する記載を追加。
また、Drug Interactionsの項について、弱い若しくは中程度
のCYP2C19阻害剤、中程度若しくは強いCYP3A4阻害剤
の「短期使用」に対してマバカムテンの使用を中断すること
アメリカ
を推奨する旨の記載を追加。
②Dosage and Administrationの項について、治療を開始ま
たは漸増する場合は、LVEF、運動負荷後LVOT圧較差の
評価、患者の臨床状態を考慮する旨を追記。また、維持期
の患者に対する6ヵ月間隔の心エコー検査の追加。
③Warnings and Precautionsの心不全の項について、重篤
な併発疾患または不整脈がある患者では、収縮機能不全
および心不全を発症するリスクがより高い旨の記載を追加。
④Warnings and Precautionsの胎児毒性の項を追加し、本
剤投与中および最終投与後4カ月間は有効な避妊法を使
用するように助言する旨の記載を追加。
添付文書改
訂(警告・禁 対応済
忌)
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Special warnings and precautions for useの項において、ナ
トリウム制限食を摂取している患者への注意として、本剤が
ナトリウムを含むことを記載していたが、本剤が塩化ナトリウ オランダ
ム溶液で希釈して使用する旨が追記された。
・Special warnings and precautions for useの項に本剤はポリ
ソルベート20を含むため、アレルギーの既往歴を有する患
者については考慮するよう記載された。
その他
注目
【第1報】
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Fertility, pregnancy and lactationの項に、在胎週数に比し
て小さく児(SGA)リスクが追記。
【第2報】
オーストラリ
欧州PRACは、Pregnancyの項に妊娠期間に比して小さい児
ア、
572 オクスカルバゼピン (SGA)のリスクが増加する可能性について、改訂すべきで
その他
欧州連合、
あると結論づけ、CMDhが合意したというもの。
ドイツ
【第3報】
独BfArMは以下の情報について掲載した。
欧州PRACが、妊娠期間に比して小さい児(SGA)のリスクが
増加する可能性について、改訂すべきであると結論づけ
た。
注目
アメリカ、
製造元の社内調査により、当該製品のIFUに従来から記載
カナダ、
された、特定の構成試薬の溶解後の冷凍保存条件におけ
フィブリノーゲンキッ
欧州連合、
573
る安定性を満たしていないことがわかった。このため、製造
情報提供
ト
日本、
元は全使用者に対し溶解後に冷凍保存しないよう案内する
オーストラリ
ことを決定した。
ア
対応中
570 マバカムテン
571
チスレリズマブ(遺
伝子組換え)
76