よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (42 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
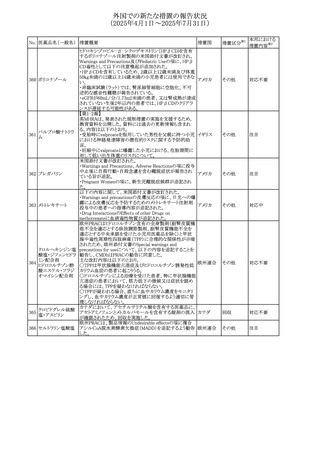
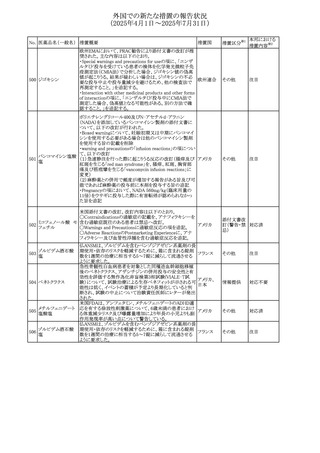
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
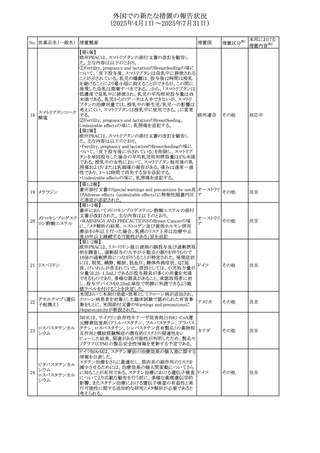
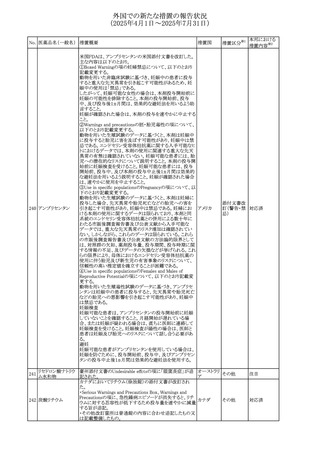
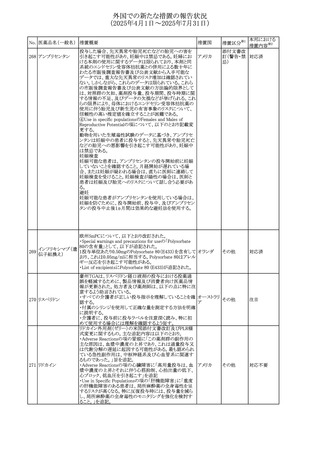
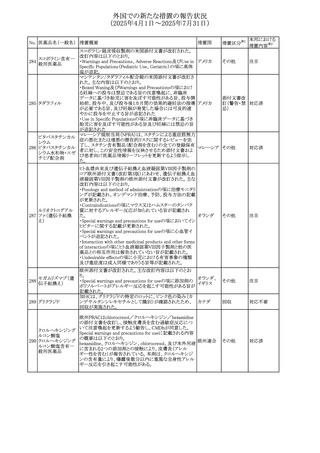
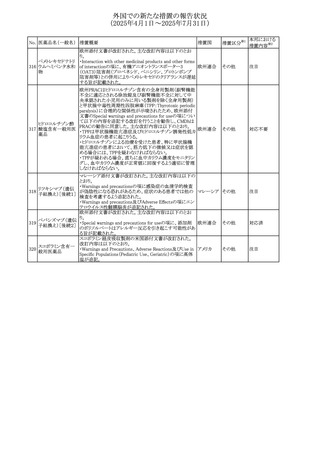
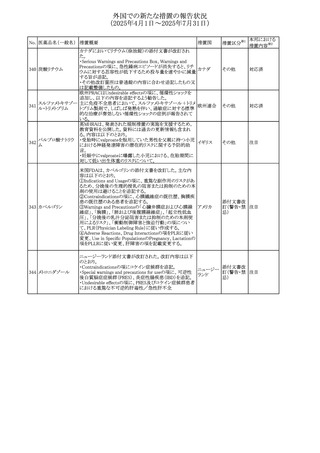
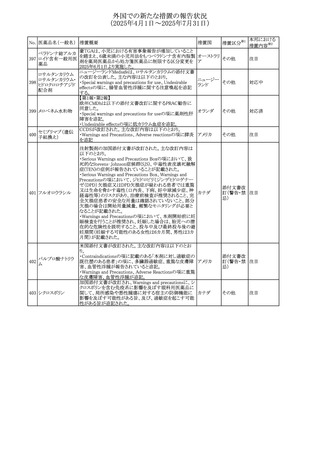
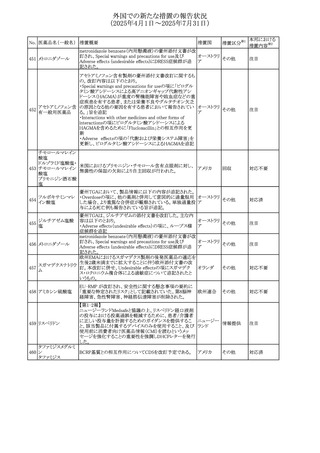
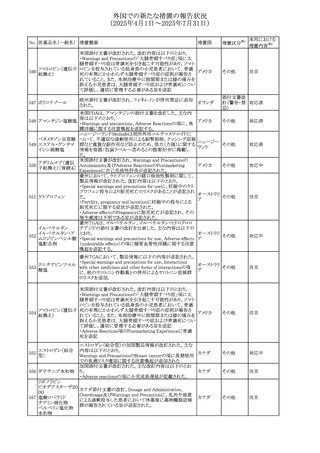
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
【第1報】
ニュージーランドMedsafeは、製品情報を更新し、低カルシ
ウム血症および低リン酸血症に関する情報を追加すると公
表した。
・Special warnings and precautions for useの項に、ビスホス
リセドロン酸ナトリウ
ニュージー
325
ホネート系薬剤は骨へ作用するため、低カルシウム血症お
その他
ム水和物
ランド
よび低リン酸血症を引き起こす可能性があり、特に、リスク因
子を有する患者は、治療期間中、カルシウムやリン酸塩のモ
ニタリングが必要な場合があること追記。
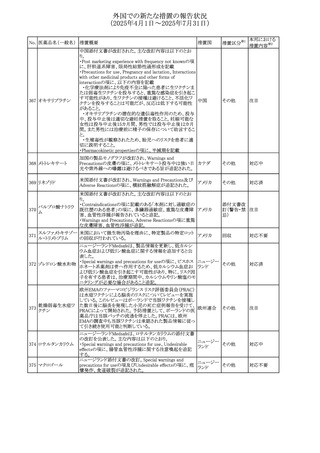
【第2報】
企業見解が追記された。
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Indications and usage、Dosage ang administrationの項に
イピリムマブ(遺伝
326
おいて、CheckMate648(CA209648)試験を踏まえ、切除不 アメリカ
その他
子組換え)
能な進行又は転移性食道扁平上皮癌の一次治療における
ニボルマブとの併用の対象患者は、腫瘍にPD-L1発現を認
める(≧1)患者である旨を記載
327
ペムブロリズマブ
(遺伝子組換え)
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・外科的切除又は根治的化学放射線療法が不適応な進
行・再発食道癌又は食道胃接合部癌患者に対するフッ化ピ
リミジン系及び白金系抗悪性腫瘍剤を含む化学療法との併
用療法、HER2陰性の切除不能な進行・再発の胃又は食道
胃接合部腺癌患者に対するフッ化ピリミジン系及び白金系
抗悪性腫瘍剤を含む化学療法との併用療法の効能につい
て、KEYNOTE-590試験*1及びKEYNOTE-859試験*2の結
果に基づき、PD-L1陽性(CPS≧1)が確認された患者を対
アメリカ
象とすることが記載された。
本邦における
措置内容※2
注目
対応済
その他
対応済
その他
対応不要
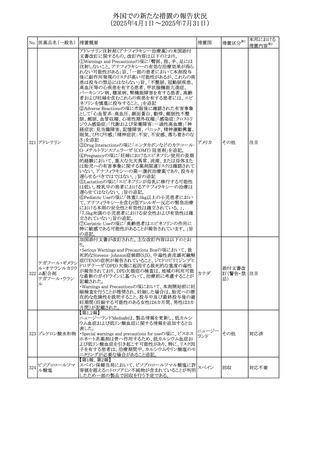
*1:進行性/転移性食道癌患者を対象とした1次治療として
のシスプラチン及び5-フルオロウラシルの併用療法とプラセ
ボ、シスプラチン及び5-フルオロウラシルの併用療法を比較
する二重盲検無作為化プラセボ対照第Ⅲ相試験
*2:HER2陰性の切除不能又は転移性胃腺癌又は食道胃
接合部腺癌患者を対象とした一次治療としての化学療法の
併用療法と、プラセボと化学療法を比較する二重盲検無作
為化第Ⅲ相試験
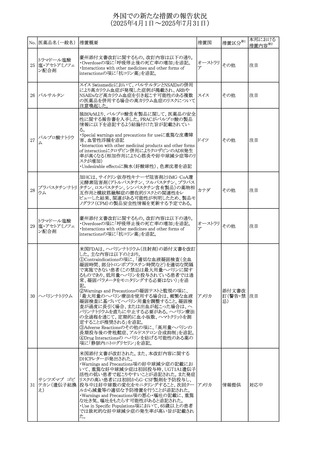
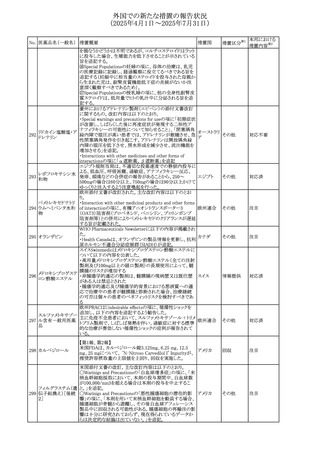
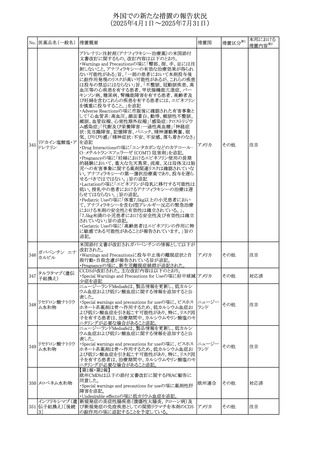
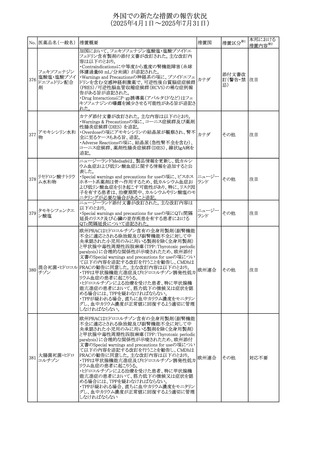
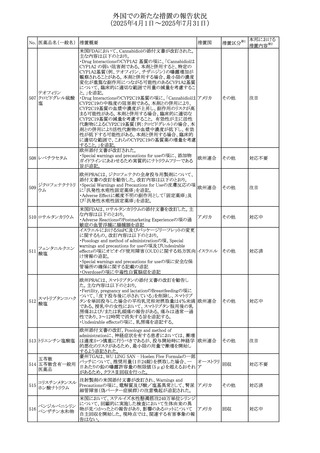
欧州PRACはヒドロコルチゾン含有の全身用製剤(副腎機能
不全に適応とされる徐放錠及び副腎機能不全に対して中
央承認された小児用のみに用いる製剤を除く全身用製剤)
と甲状腺中毒性周期性四肢麻痺(TPP:Thyrotoxic periodic
paralysis)に合理的な関係性が示唆されたため、欧州添付
文書のSpecial warnings and precautions for useの項につい
オキシテトラサイクリ
て以下の内容を追記する改訂を行うことを勧告し、CMDhは
ン塩酸塩・ヒドロコル
PRACの勧告に同意した。主な改訂内容は以下のとおり。
328 チゾン
欧州連合
・TPPは甲状腺機能亢進症及びヒドロコルチゾン誘発性低カ
ヒドロコルチゾン含
リウム血症の患者に起こりうる。
有一般用医薬品
・ヒドロコルチゾンによる治療を受けた患者、特に甲状腺機
能亢進症の患者において、筋力低下の徴候又は症状を認
める場合には、TPPを疑わなければならない。
・TPPが疑われる場合、直ちに血中カリウム濃度をモニタリン
グし、血中カリウム濃度が正常値に回復するよう適切に管理
しなければならない
アイルランドHPRAは、フルコナゾールの製品情報が更新さ
れ、異常妊娠の転帰(自然流産、心奇形、その他の先天異
常)に関する利用可能なデータや、妊娠可能な女性への使
用に関する新たなアドバイスを追加すると公表した。
・妊娠可能な女性において治療開始前に、患者に胎児への
ホスフルコナゾール
アイルラン
329
潜在的なリスクを説明すること。
その他
フルコナゾール
ド
・単回投与後、妊娠前に1週間の投与中止期間を設けること
が推奨される。
・長期投与の場合、妊娠可能な女性において、治療期間中
及び最終投与後1週間は、適切な避妊を検討することが推
奨される。
42
注目
(2025年4月1日~2025年7月31日)
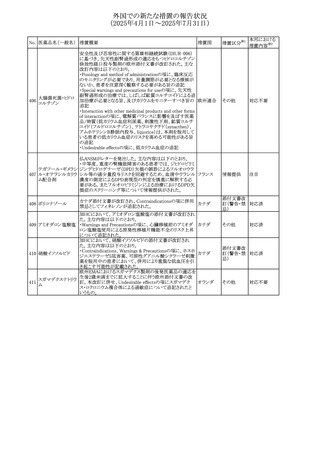
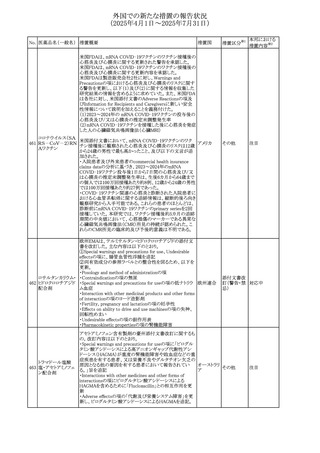
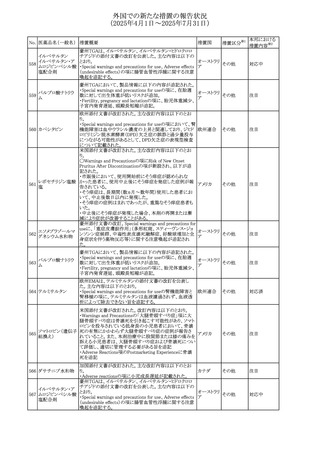
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
【第1報】
ニュージーランドMedsafeは、製品情報を更新し、低カルシ
ウム血症および低リン酸血症に関する情報を追加すると公
表した。
・Special warnings and precautions for useの項に、ビスホス
リセドロン酸ナトリウ
ニュージー
325
ホネート系薬剤は骨へ作用するため、低カルシウム血症お
その他
ム水和物
ランド
よび低リン酸血症を引き起こす可能性があり、特に、リスク因
子を有する患者は、治療期間中、カルシウムやリン酸塩のモ
ニタリングが必要な場合があること追記。
【第2報】
企業見解が追記された。
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Indications and usage、Dosage ang administrationの項に
イピリムマブ(遺伝
326
おいて、CheckMate648(CA209648)試験を踏まえ、切除不 アメリカ
その他
子組換え)
能な進行又は転移性食道扁平上皮癌の一次治療における
ニボルマブとの併用の対象患者は、腫瘍にPD-L1発現を認
める(≧1)患者である旨を記載
327
ペムブロリズマブ
(遺伝子組換え)
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・外科的切除又は根治的化学放射線療法が不適応な進
行・再発食道癌又は食道胃接合部癌患者に対するフッ化ピ
リミジン系及び白金系抗悪性腫瘍剤を含む化学療法との併
用療法、HER2陰性の切除不能な進行・再発の胃又は食道
胃接合部腺癌患者に対するフッ化ピリミジン系及び白金系
抗悪性腫瘍剤を含む化学療法との併用療法の効能につい
て、KEYNOTE-590試験*1及びKEYNOTE-859試験*2の結
果に基づき、PD-L1陽性(CPS≧1)が確認された患者を対
アメリカ
象とすることが記載された。
本邦における
措置内容※2
注目
対応済
その他
対応済
その他
対応不要
*1:進行性/転移性食道癌患者を対象とした1次治療として
のシスプラチン及び5-フルオロウラシルの併用療法とプラセ
ボ、シスプラチン及び5-フルオロウラシルの併用療法を比較
する二重盲検無作為化プラセボ対照第Ⅲ相試験
*2:HER2陰性の切除不能又は転移性胃腺癌又は食道胃
接合部腺癌患者を対象とした一次治療としての化学療法の
併用療法と、プラセボと化学療法を比較する二重盲検無作
為化第Ⅲ相試験
欧州PRACはヒドロコルチゾン含有の全身用製剤(副腎機能
不全に適応とされる徐放錠及び副腎機能不全に対して中
央承認された小児用のみに用いる製剤を除く全身用製剤)
と甲状腺中毒性周期性四肢麻痺(TPP:Thyrotoxic periodic
paralysis)に合理的な関係性が示唆されたため、欧州添付
文書のSpecial warnings and precautions for useの項につい
オキシテトラサイクリ
て以下の内容を追記する改訂を行うことを勧告し、CMDhは
ン塩酸塩・ヒドロコル
PRACの勧告に同意した。主な改訂内容は以下のとおり。
328 チゾン
欧州連合
・TPPは甲状腺機能亢進症及びヒドロコルチゾン誘発性低カ
ヒドロコルチゾン含
リウム血症の患者に起こりうる。
有一般用医薬品
・ヒドロコルチゾンによる治療を受けた患者、特に甲状腺機
能亢進症の患者において、筋力低下の徴候又は症状を認
める場合には、TPPを疑わなければならない。
・TPPが疑われる場合、直ちに血中カリウム濃度をモニタリン
グし、血中カリウム濃度が正常値に回復するよう適切に管理
しなければならない
アイルランドHPRAは、フルコナゾールの製品情報が更新さ
れ、異常妊娠の転帰(自然流産、心奇形、その他の先天異
常)に関する利用可能なデータや、妊娠可能な女性への使
用に関する新たなアドバイスを追加すると公表した。
・妊娠可能な女性において治療開始前に、患者に胎児への
ホスフルコナゾール
アイルラン
329
潜在的なリスクを説明すること。
その他
フルコナゾール
ド
・単回投与後、妊娠前に1週間の投与中止期間を設けること
が推奨される。
・長期投与の場合、妊娠可能な女性において、治療期間中
及び最終投与後1週間は、適切な避妊を検討することが推
奨される。
42
注目