よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
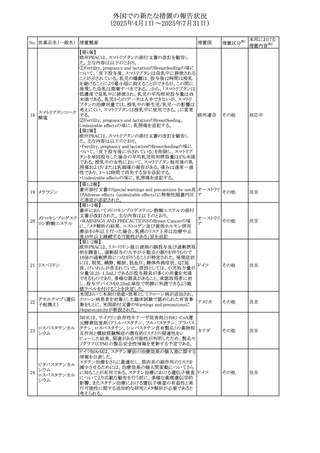
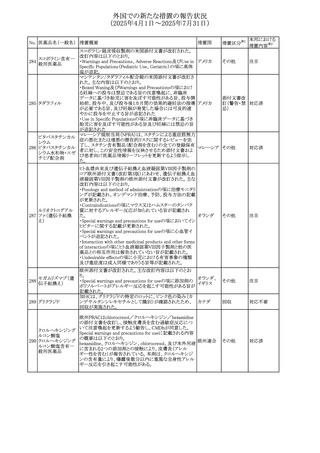
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
措置区分※1
本邦における
措置内容※2
その他
対応不要
【第1報・第2報】
欧州EMA・CHAPは、本剤のベネフィットとリスクを再評価し
アジスロマイシン水
ドイツ、
237
た結果、中等度の尋常性ざ瘡、ヘリコバクター・ピロリの除
和物
欧州連合
菌、好酸球性喘息及び非好酸球性喘息の増悪(発作)予防
に対する経口アジスロマイシンの適応の削除を勧告した。
その他
対応不要
【第1・2報】
スイスSwissmedicはメドロキシプロゲステロン酢酸エステルに
ついて以下の内容を公表した。
・高用量メドロキシプロゲステロン酢酸エステル(全ての注射
製剤及び100mg以上の経口製剤)の長期使用によって、髄
メドロキシプロゲステ 膜腫のリスクが増加する
238
スイス
ロン酢酸エステル ・非腫瘍学的適応の製剤は、髄膜腫の現病歴又は既往歴
がある人は禁忌とされた
・腫瘍学的適応及び腫瘍学的背景における悪液質への適
応で治療中の患者が髄膜腫と診断された場合、治療継続
の可否は個々の患者のベネフィットリスクを検討すべきであ
る
情報提供
対応済
その他
注目
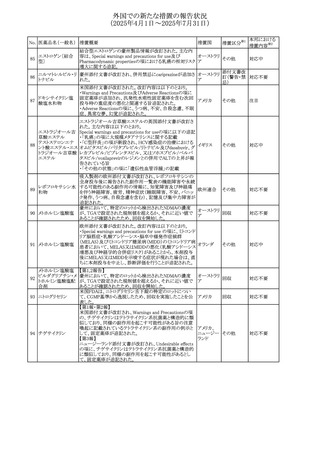
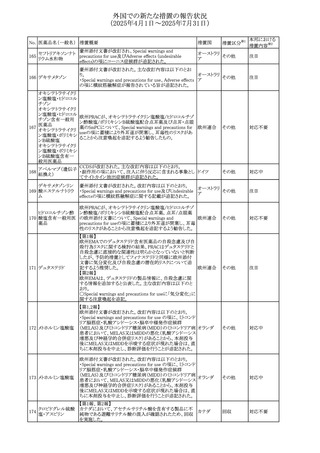
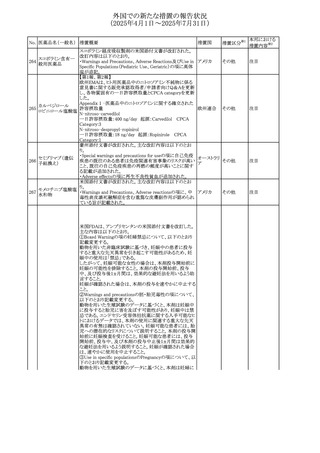
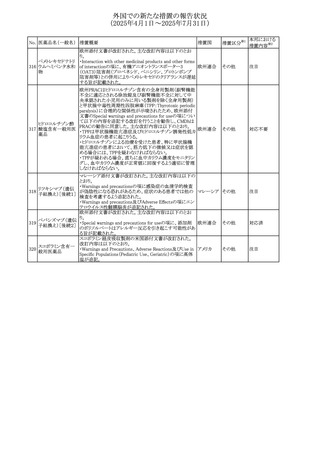
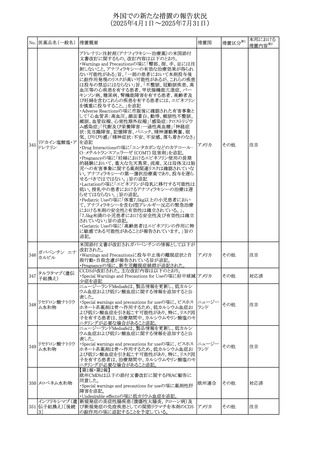
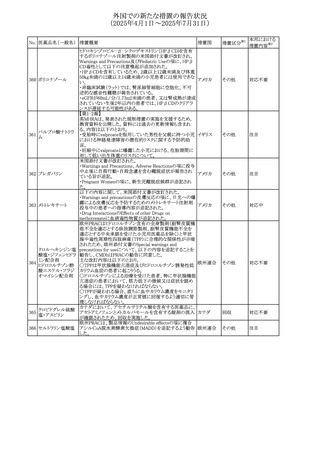
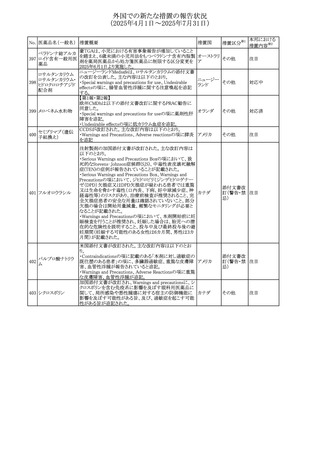
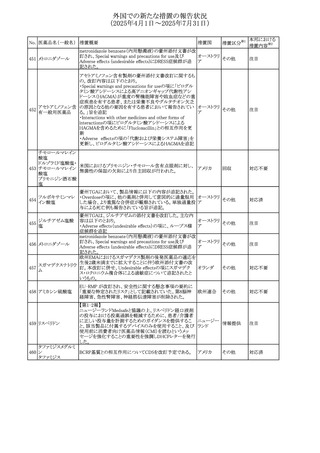
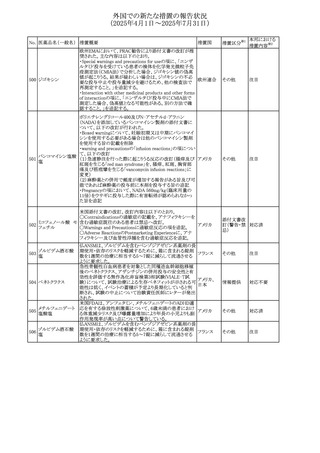
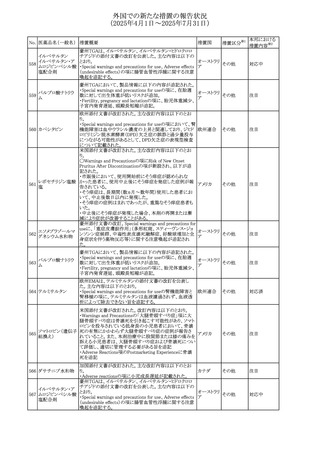
No. 医薬品名(一般名) 措置概要
236 リドカイン塩酸塩
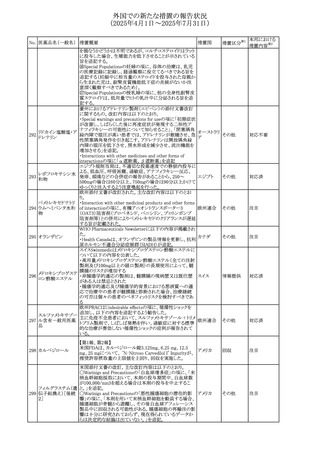
239 ファモチジン
措置国
リドカイン外用剤(ゼリー)の米国添付文書改訂及びPLR様
式変更に関するもの。主な追記内容は以下のとおり。
・Adverse Reactionsの項の冒頭に「この薬剤群の副作用の
主な原因は、血漿中濃度の上昇であり、これは過量投与又
は代謝分解の遅延に起因する可能性がある。最も認められ
ている急性副作用は、中枢神経系及び心血管系に関連す
るものであった。」旨を追記。
・Adverse Reactionsの項の心臓障害に「高用量投与は、血 アメリカ
漿中濃度の上昇とそれに伴う心筋抑制、心拍出量の低下、
心ブロック、低血圧を引き起こす」を追記
・Use in Specific Populationsの項の「肝機能障害」に「重度
の肝機能障害のある患者は、局所麻酔薬の全身毒性を呈
するリスクが高くなる。特に反復投与時には、投与量を減ら
し、局所麻酔薬の全身毒性のモニタリングを強化を検討す
ること。」を追記。
加国の製品モノグラフの安全性情報の改訂。主な改訂内容
は以下のとおり。
〇Warnings&Precausionsに、「本剤の服用により、ごく稀に
めまいや傾眠などの副作用が発現することがあるため、これ
らの症状を経験した場合には、自動車の運転、機械の操
作、又は迅速な注意を要する活動を避けるべきであることを
患者に知らせること」を追記。
カナダ
〇Adverse ReactionsのClinical Trial Adverse Reactionsに、
発現頻度1%以上の副作用として、頭痛、めまいを追記。
〇Drug Interactionsに、本剤とポサコナゾール経口懸濁液
及びイトラコナゾール、チロシンキナーゼ阻害薬(ダサチニ
ブ、エルロチニブ、ゲフィチニブ、パゾパニブ等)との併用に
より、併用薬の血漿中濃度が低下する旨を追記。
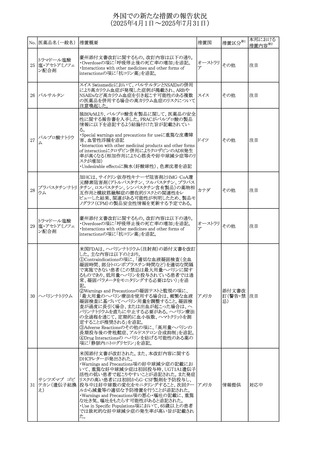
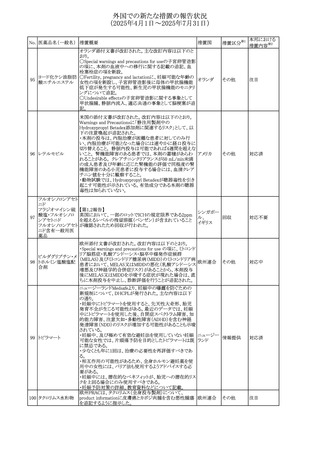
27
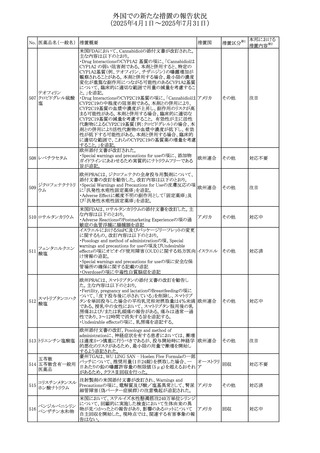
(2025年4月1日~2025年7月31日)
措置区分※1
本邦における
措置内容※2
その他
対応不要
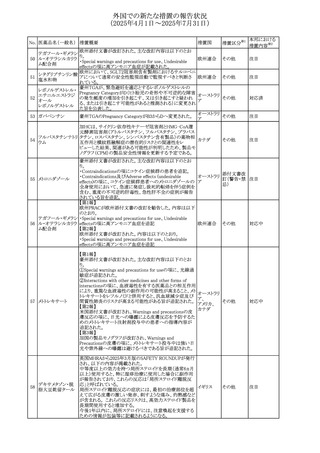
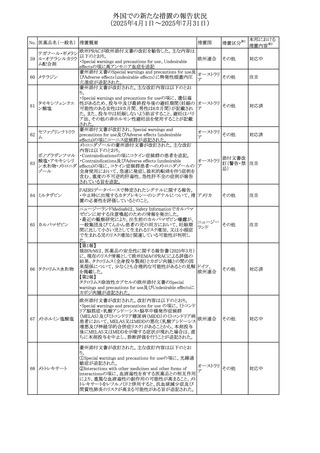
【第1報・第2報】
欧州EMA・CHAPは、本剤のベネフィットとリスクを再評価し
アジスロマイシン水
ドイツ、
237
た結果、中等度の尋常性ざ瘡、ヘリコバクター・ピロリの除
和物
欧州連合
菌、好酸球性喘息及び非好酸球性喘息の増悪(発作)予防
に対する経口アジスロマイシンの適応の削除を勧告した。
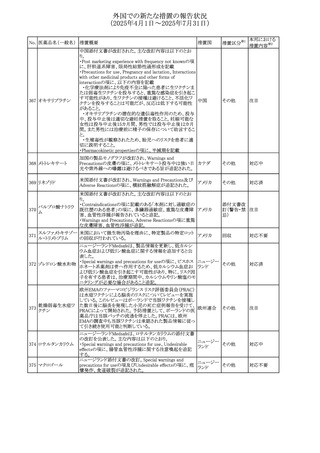
その他
対応不要
【第1・2報】
スイスSwissmedicはメドロキシプロゲステロン酢酸エステルに
ついて以下の内容を公表した。
・高用量メドロキシプロゲステロン酢酸エステル(全ての注射
製剤及び100mg以上の経口製剤)の長期使用によって、髄
メドロキシプロゲステ 膜腫のリスクが増加する
238
スイス
ロン酢酸エステル ・非腫瘍学的適応の製剤は、髄膜腫の現病歴又は既往歴
がある人は禁忌とされた
・腫瘍学的適応及び腫瘍学的背景における悪液質への適
応で治療中の患者が髄膜腫と診断された場合、治療継続
の可否は個々の患者のベネフィットリスクを検討すべきであ
る
情報提供
対応済
その他
注目
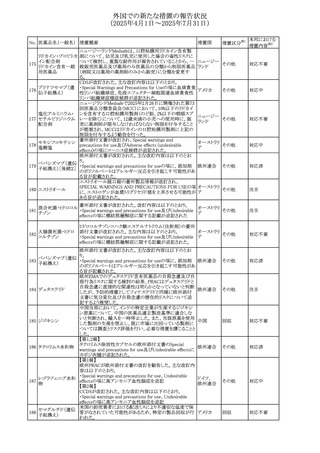
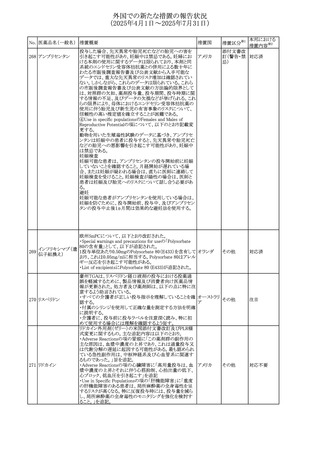
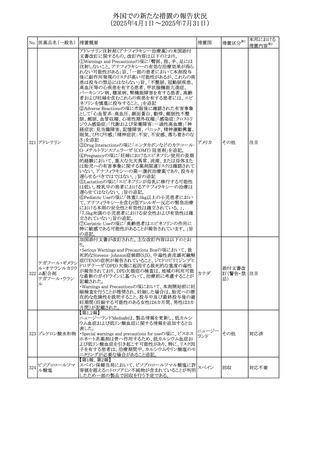
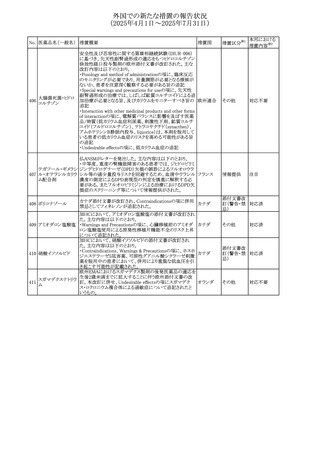
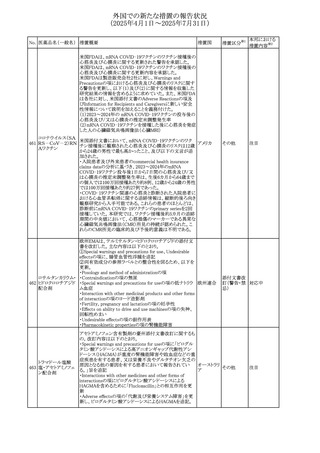
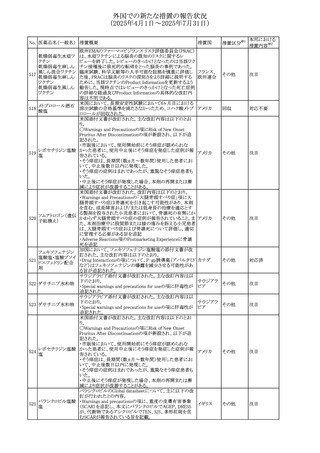
No. 医薬品名(一般名) 措置概要
236 リドカイン塩酸塩
239 ファモチジン
措置国
リドカイン外用剤(ゼリー)の米国添付文書改訂及びPLR様
式変更に関するもの。主な追記内容は以下のとおり。
・Adverse Reactionsの項の冒頭に「この薬剤群の副作用の
主な原因は、血漿中濃度の上昇であり、これは過量投与又
は代謝分解の遅延に起因する可能性がある。最も認められ
ている急性副作用は、中枢神経系及び心血管系に関連す
るものであった。」旨を追記。
・Adverse Reactionsの項の心臓障害に「高用量投与は、血 アメリカ
漿中濃度の上昇とそれに伴う心筋抑制、心拍出量の低下、
心ブロック、低血圧を引き起こす」を追記
・Use in Specific Populationsの項の「肝機能障害」に「重度
の肝機能障害のある患者は、局所麻酔薬の全身毒性を呈
するリスクが高くなる。特に反復投与時には、投与量を減ら
し、局所麻酔薬の全身毒性のモニタリングを強化を検討す
ること。」を追記。
加国の製品モノグラフの安全性情報の改訂。主な改訂内容
は以下のとおり。
〇Warnings&Precausionsに、「本剤の服用により、ごく稀に
めまいや傾眠などの副作用が発現することがあるため、これ
らの症状を経験した場合には、自動車の運転、機械の操
作、又は迅速な注意を要する活動を避けるべきであることを
患者に知らせること」を追記。
カナダ
〇Adverse ReactionsのClinical Trial Adverse Reactionsに、
発現頻度1%以上の副作用として、頭痛、めまいを追記。
〇Drug Interactionsに、本剤とポサコナゾール経口懸濁液
及びイトラコナゾール、チロシンキナーゼ阻害薬(ダサチニ
ブ、エルロチニブ、ゲフィチニブ、パゾパニブ等)との併用に
より、併用薬の血漿中濃度が低下する旨を追記。
27