よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
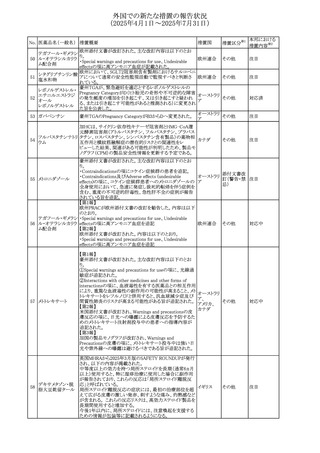
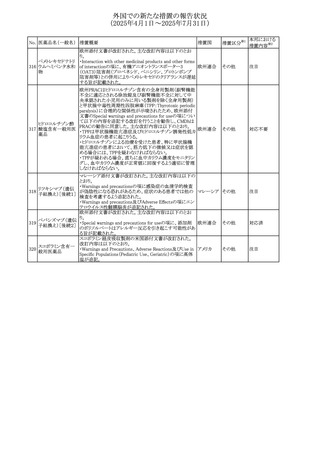
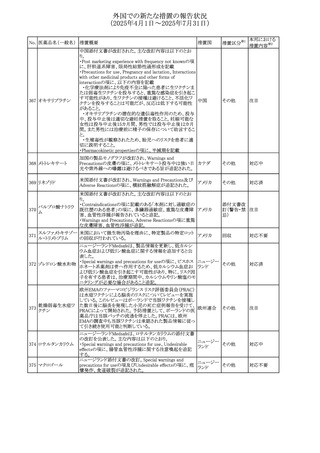
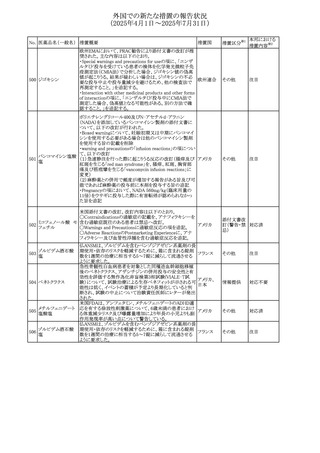
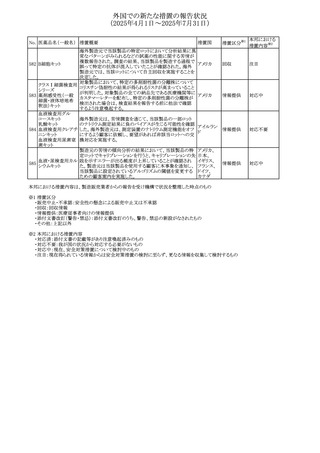
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
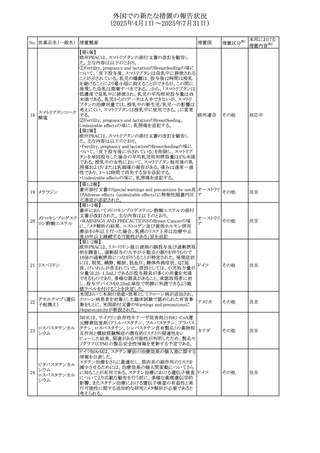
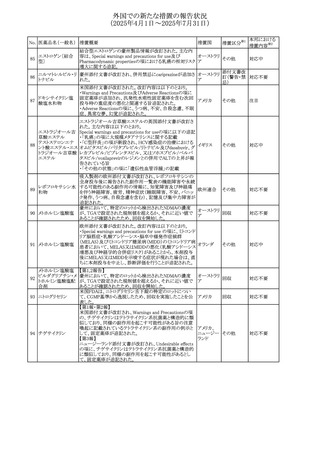
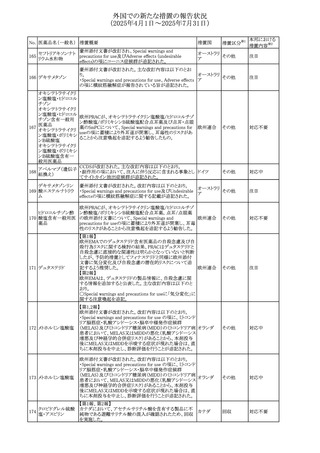
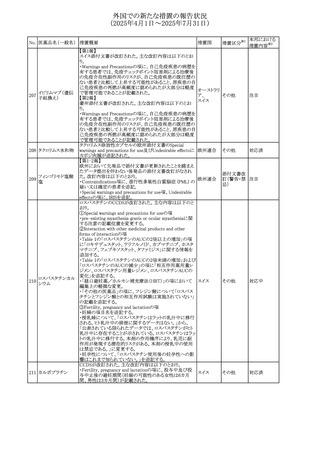
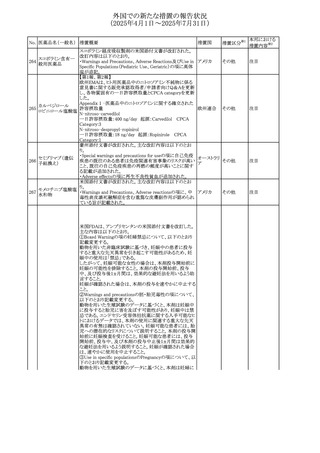
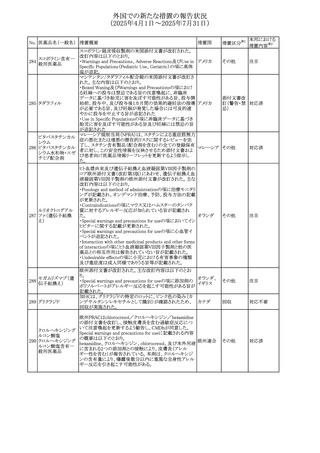
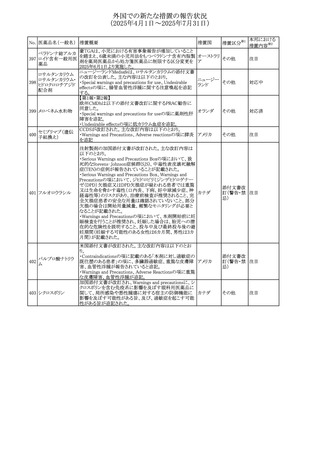
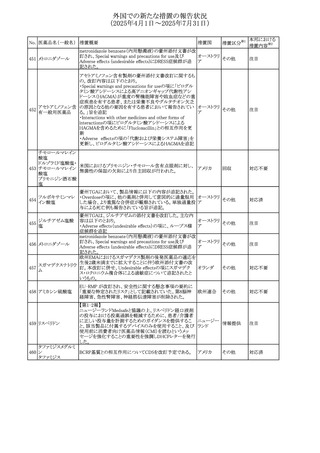
No. 医薬品名(一般名) 措置概要
272 フルコナゾール
措置国
措置区分※1
【第1報・第2報】
アイルランドHPRAは、フルコナゾールの製品情報が更新さ
れ、異常妊娠の転帰(自然流産、心奇形、その他の先天異
常)に関する利用可能なデータや、妊娠可能な女性への使
用に関する新たなアドバイスを追加すると公表した。
・妊娠可能な女性において治療開始前に、患者に胎児への アイルラン
その他
潜在的なリスクを説明すること。
ド
・単回投与後、妊娠前に1週間の投与中止期間を設けること
が推奨される。
・長期投与の場合、妊娠可能な女性において、治療期間中
及び最終投与後1週間は、適切な避妊を検討することが推
奨される。
リセドロン酸ナトリウ 豪州添付文書のUndesirable effctsの項に「眼窩炎症」が追 オーストラリ
その他
ム水和物
記された。
ア
米国添付文書が改訂され、Adverse Reactionsの
274 ダプトマイシン
Postmarketing Experienceの項に、高カリウム血症が追記さ アメリカ
その他
れた。
273
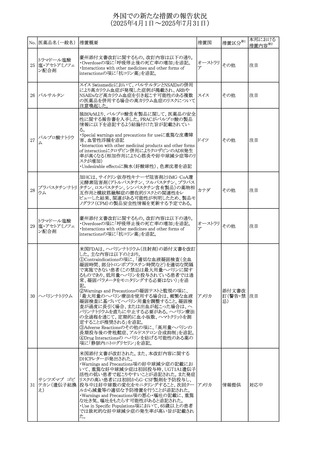
本邦における
措置内容※2
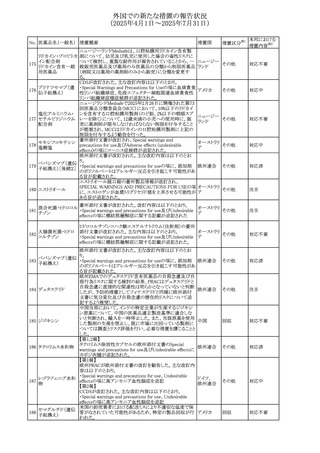
注目
注目
注目
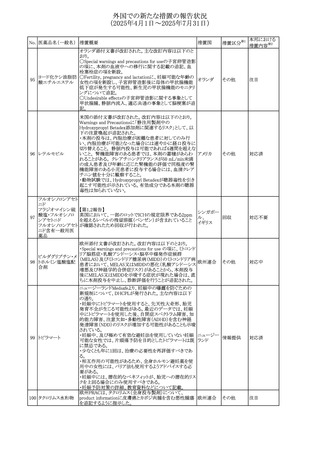
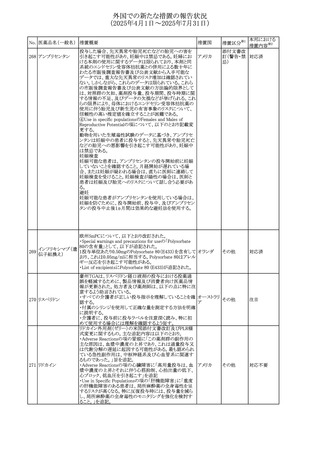
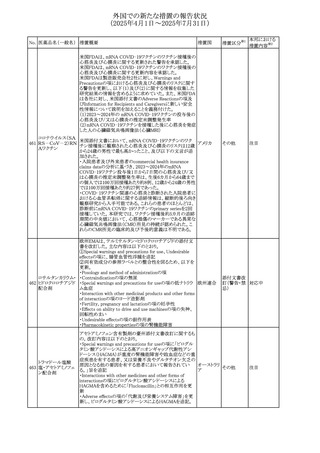
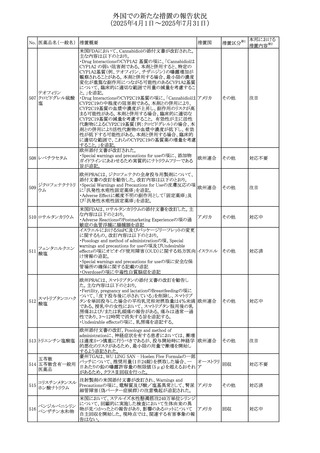
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Special warnings and precautions for useの項にセロトニン
症候群、情緒不安定、攻撃的行動に殺人念慮を追記。
アトモキセチン塩酸
オーストラリ
275
・Interactions with other medicines and other forms of
その他
塩
ア
interactionsの項に、セロトニン作動薬を追記。
・Adverse effectsの項に歯ぎしりを追記。
・Overdoseの項にセロトニン症候群を追記。
注目
マレーシアのRMPが改訂された。
バルベナジントシル ・重要な潜在的リスクに「悪性症候群」が追加され、「うつ病
276
マレーシア その他
酸塩
及び自殺念慮」は「遅発性ジスキネジア患者におけるうつ病
又は自殺念慮及び自殺行動」へ変更された。
対応済
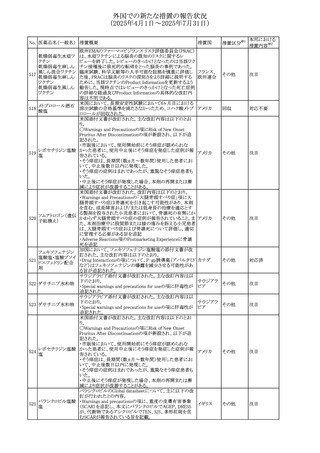
277 ファモチジン
加国の製品モノグラフの安全性情報の改訂。主な改訂内容
は以下のとおり。
〇Warnings&Precausionsに、「本剤の服用により、ごく稀に
めまいや傾眠などの副作用が発現することがあるため、これ
らの症状を経験した場合には、自動車の運転、機械の操
作、又は迅速な注意を要する活動を避けるべきであることを
患者に知らせること」を追記。
カナダ
〇Adverse ReactionsのClinical Trial Adverse Reactionsに、
発現頻度1%以上の副作用として、頭痛、めまいを追記。
〇Drug Interactionsに、本剤とポサコナゾール経口懸濁液
及びイトラコナゾール、チロシンキナーゼ阻害薬(ダサチニ
ブ、エルロチニブ、ゲフィチニブ、パゾパニブ等)との併用に
より、併用薬の血漿中濃度が低下する旨を追記。
278 アセトアミノフェン
ニュージーランドにおいて、コデイン及びアセトアミノフェン
含有製剤のデータシートが更新され、Over Doseにアセトア
ニュージー
ミノフェンによる急性毒性に関する情報(アセトアミノフェンを
その他
ランド
15g以上摂取した成人では、急性毒性の症状が現れる可能
性があるとの報告があった旨)が追記された。
33
その他
注目
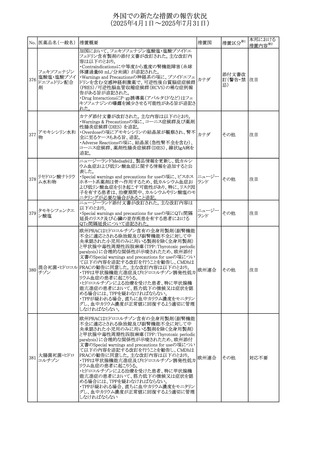
対応済
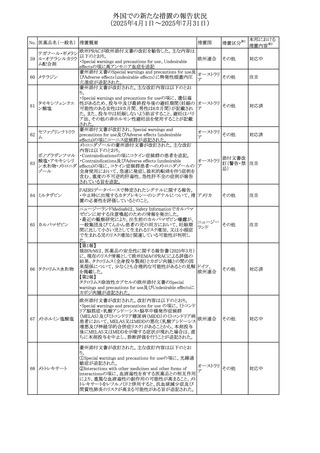
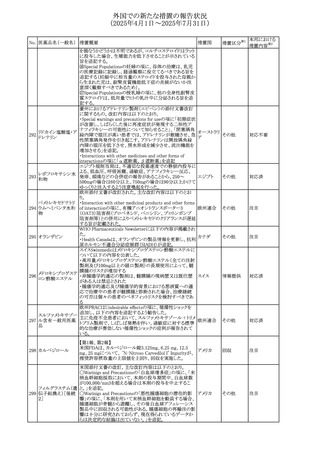
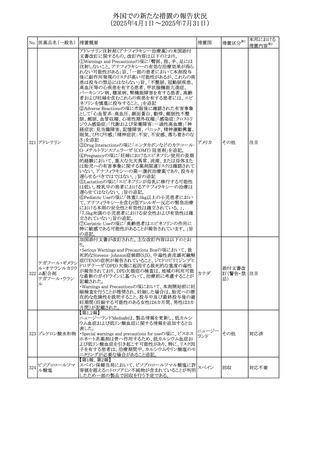
(2025年4月1日~2025年7月31日)
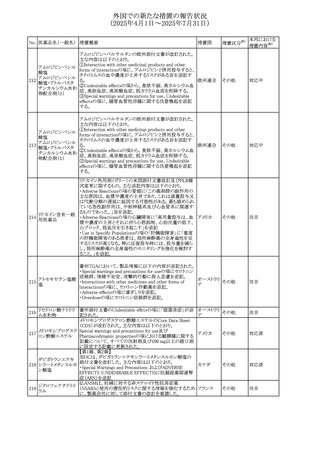
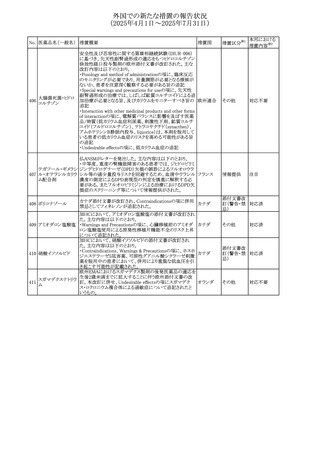
No. 医薬品名(一般名) 措置概要
272 フルコナゾール
措置国
措置区分※1
【第1報・第2報】
アイルランドHPRAは、フルコナゾールの製品情報が更新さ
れ、異常妊娠の転帰(自然流産、心奇形、その他の先天異
常)に関する利用可能なデータや、妊娠可能な女性への使
用に関する新たなアドバイスを追加すると公表した。
・妊娠可能な女性において治療開始前に、患者に胎児への アイルラン
その他
潜在的なリスクを説明すること。
ド
・単回投与後、妊娠前に1週間の投与中止期間を設けること
が推奨される。
・長期投与の場合、妊娠可能な女性において、治療期間中
及び最終投与後1週間は、適切な避妊を検討することが推
奨される。
リセドロン酸ナトリウ 豪州添付文書のUndesirable effctsの項に「眼窩炎症」が追 オーストラリ
その他
ム水和物
記された。
ア
米国添付文書が改訂され、Adverse Reactionsの
274 ダプトマイシン
Postmarketing Experienceの項に、高カリウム血症が追記さ アメリカ
その他
れた。
273
本邦における
措置内容※2
注目
注目
注目
豪州TGAにおいて、製品情報に以下の内容が追記された。
・Special warnings and precautions for useの項にセロトニン
症候群、情緒不安定、攻撃的行動に殺人念慮を追記。
アトモキセチン塩酸
オーストラリ
275
・Interactions with other medicines and other forms of
その他
塩
ア
interactionsの項に、セロトニン作動薬を追記。
・Adverse effectsの項に歯ぎしりを追記。
・Overdoseの項にセロトニン症候群を追記。
注目
マレーシアのRMPが改訂された。
バルベナジントシル ・重要な潜在的リスクに「悪性症候群」が追加され、「うつ病
276
マレーシア その他
酸塩
及び自殺念慮」は「遅発性ジスキネジア患者におけるうつ病
又は自殺念慮及び自殺行動」へ変更された。
対応済
277 ファモチジン
加国の製品モノグラフの安全性情報の改訂。主な改訂内容
は以下のとおり。
〇Warnings&Precausionsに、「本剤の服用により、ごく稀に
めまいや傾眠などの副作用が発現することがあるため、これ
らの症状を経験した場合には、自動車の運転、機械の操
作、又は迅速な注意を要する活動を避けるべきであることを
患者に知らせること」を追記。
カナダ
〇Adverse ReactionsのClinical Trial Adverse Reactionsに、
発現頻度1%以上の副作用として、頭痛、めまいを追記。
〇Drug Interactionsに、本剤とポサコナゾール経口懸濁液
及びイトラコナゾール、チロシンキナーゼ阻害薬(ダサチニ
ブ、エルロチニブ、ゲフィチニブ、パゾパニブ等)との併用に
より、併用薬の血漿中濃度が低下する旨を追記。
278 アセトアミノフェン
ニュージーランドにおいて、コデイン及びアセトアミノフェン
含有製剤のデータシートが更新され、Over Doseにアセトア
ニュージー
ミノフェンによる急性毒性に関する情報(アセトアミノフェンを
その他
ランド
15g以上摂取した成人では、急性毒性の症状が現れる可能
性があるとの報告があった旨)が追記された。
33
その他
注目
対応済