よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
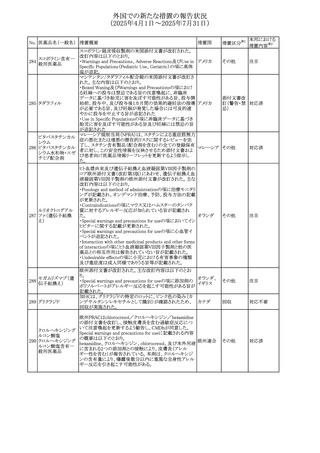
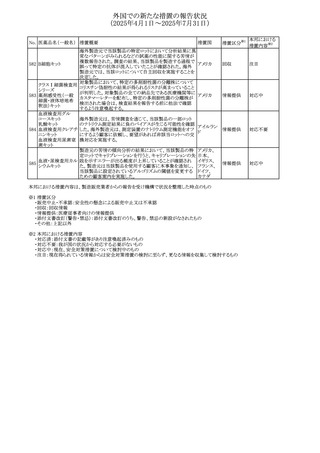
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
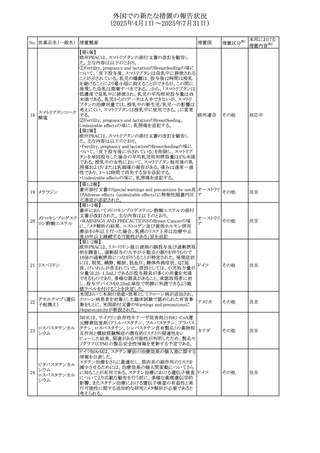
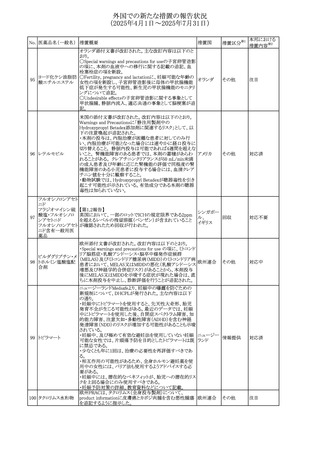
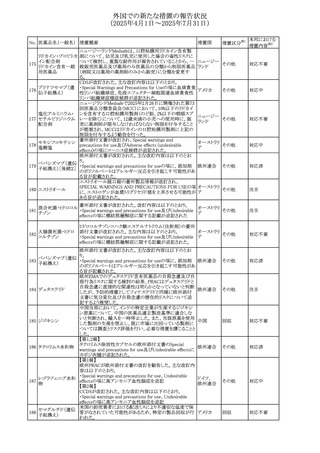
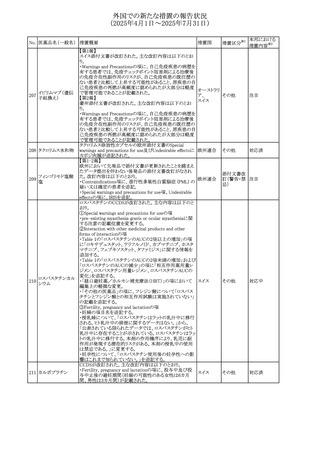
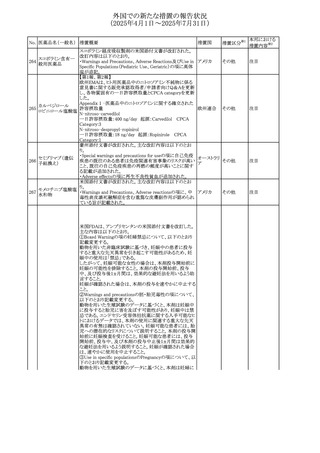
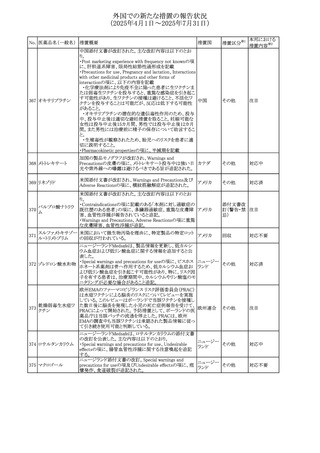
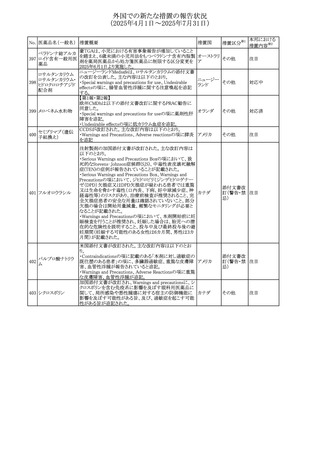
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
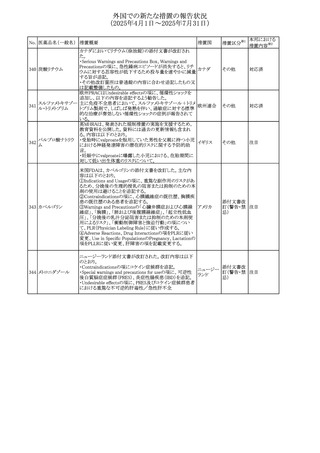
措置内容※2
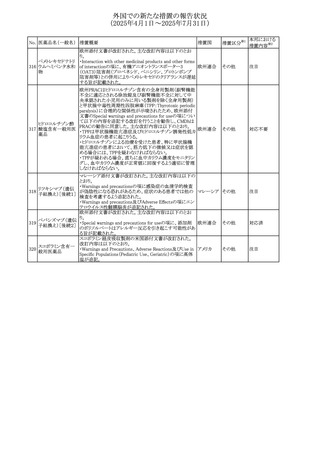
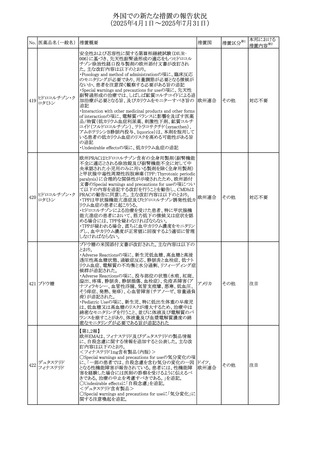
カナダにおけるチモロール含有製剤(経口剤)の製品モノグ
ラフの改訂に関するもの。改訂内容は以下のとおり。
・Contraindicationsの項に「洞不全症候群(洞房ブロックを含
む)」「モノアミン酸化酵素阻害剤を投与中の患者」「妊婦」
「重度の末梢血管疾患又はレイノー病」「異型狭心症」「未
治療の褐色細胞腫」「代謝性アシドーシス」「低血圧」の患者
を追記。
・Serious Warnings and Precautions
虚血性心疾患の患者には、本剤をを突然中止しないよう
警告すること。β-アドレナリン受容体遮断薬による治療を突
然中止し、狭心症の増悪の有無にかかわらず、心筋梗塞、
心室性不整脈、又は突然死が報告されている。
・Warnings and Precautions
第1度心ブロックの患者、末梢循環障害(レイノー症候群、
間欠性跛行)のある患者、肝機能障害患者(部分的肝代謝
チモロールマレイン のため)、脳血管不全のある患者、乾癬の既往歴のある患
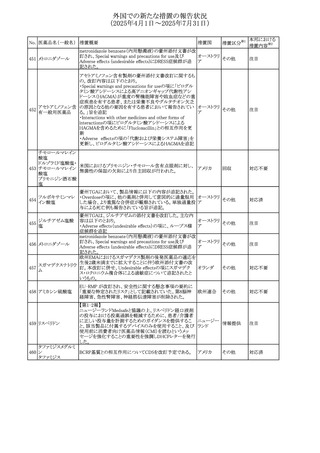
404
カナダ
酸塩
者(発疹の報告があるため)では、慎重に投与すること。
運転及び機械操作に関する注意喚起:屈折異常、複視、
眼瞼下垂、軽度かつ一過性の霧視の頻繁な発現、めまい
や疲労感などの視覚障害が生じることを考慮すべきである。
乳糖が含まれているため、ガラクトース不耐性、グルコース
-ガラクトース吸収不良、又はLappラクターゼ欠損症のまれ
な遺伝性疾患を有する患者は本剤を服用すべきではない。
β遮断薬を投与されている患者では、エピネフリンはアナ
フィラキシーの治療において通常の効果を示さないことがあ
り、アレルギー型反応の治療が困難になる可能性もある。
β遮断薬は、筋無力症状(複視、眼瞼下垂、全身性脱力
など)と一致する筋力低下を増強することが報告されている。
軽度または中等度の慢性閉塞性肺疾患(慢性気管支炎、
肺気腫など)、気管支けいれん性疾患、気管支けいれん性
疾患の既往(気管支喘息又は気管支喘息の既往)のある患
者は、一般にβ遮断薬を投与してはならない。
添付文書改
訂(警告・禁 注目
忌)
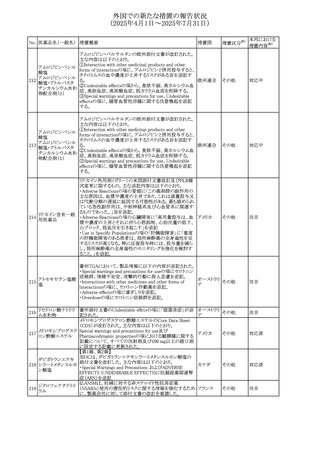
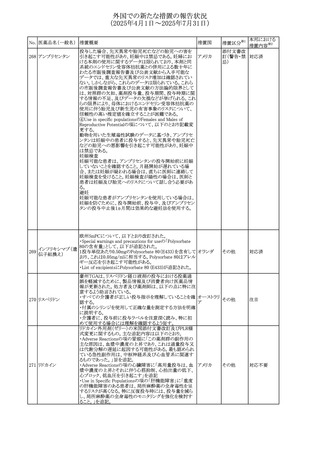
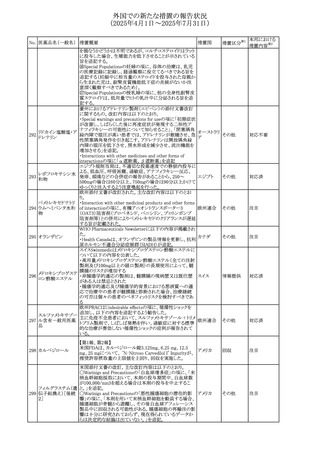
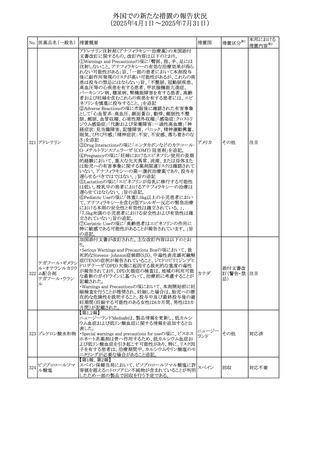
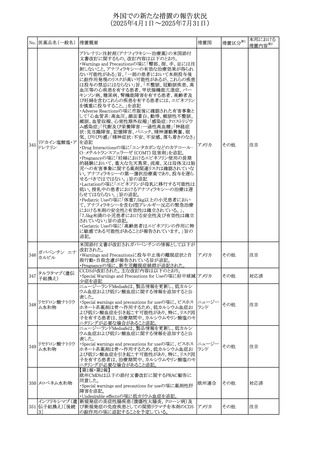
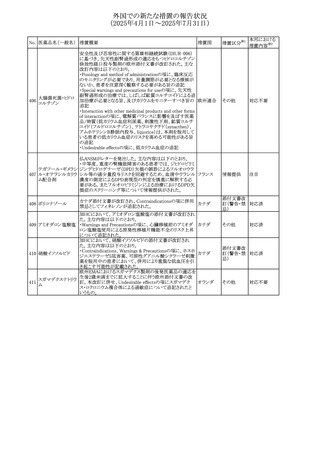
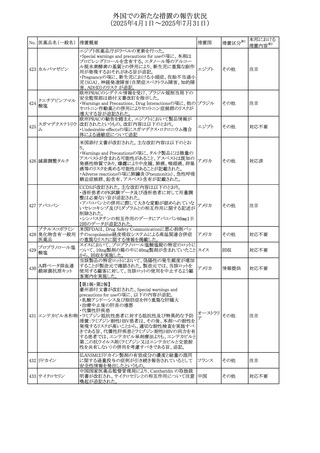
安全性および忍容性に関する第Ⅲ相継続試験(DIUR006)に基づき、先天性副腎過形成の適応をもつヒドロコル
チゾン徐放性経口投与製剤の欧州添付文書が改訂され
た。主な改訂内容は以下のとおり。
・Posology and method of administrationの項に、臨床反応
のモニタリングが必要であり、用量調節が必要となる徴候が
ないか、患者を注意深く観察する必要がある旨の追記
・Special warnings and precautions for useの項に、先天性
副腎過形成の治療では、しばしば鉱質コルチコイドによる追
混合死菌・ヒドロコル
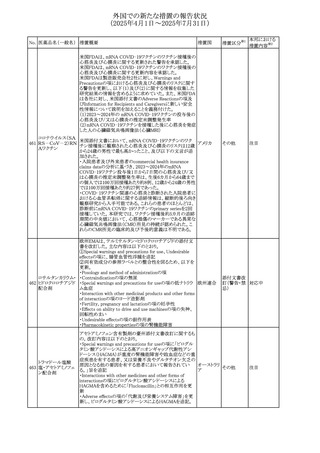
405
加治療が必要となる旨、及びカリウムをモニターすべき旨の 欧州連合
チゾン
追記
・Interaction with other medicinal products and other forms
of interactionの項に、電解質バランスに影響を及ぼす医薬
品/物質(低カリウム血症利尿薬、刺激性下剤、鉱質コルチ
コイド(フルドロコルチゾン)、テトラコサクチド(synacthen)、
アムホテリシンB静脈内投与、liquorice)は、本剤を服用して
いる患者の低カリウム血症のリスクを高める可能性がある旨
の追記
・Undesirable effectsの項に、低カリウム血症の追記
その他
53
注目
(2025年4月1日~2025年7月31日)
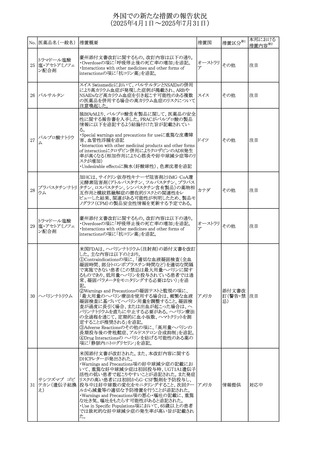
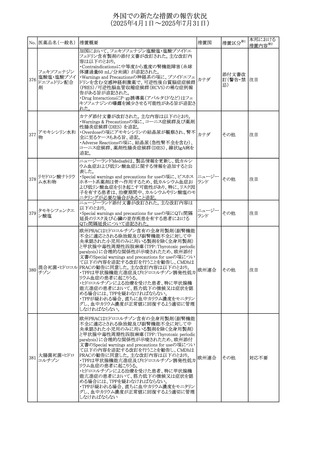
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
カナダにおけるチモロール含有製剤(経口剤)の製品モノグ
ラフの改訂に関するもの。改訂内容は以下のとおり。
・Contraindicationsの項に「洞不全症候群(洞房ブロックを含
む)」「モノアミン酸化酵素阻害剤を投与中の患者」「妊婦」
「重度の末梢血管疾患又はレイノー病」「異型狭心症」「未
治療の褐色細胞腫」「代謝性アシドーシス」「低血圧」の患者
を追記。
・Serious Warnings and Precautions
虚血性心疾患の患者には、本剤をを突然中止しないよう
警告すること。β-アドレナリン受容体遮断薬による治療を突
然中止し、狭心症の増悪の有無にかかわらず、心筋梗塞、
心室性不整脈、又は突然死が報告されている。
・Warnings and Precautions
第1度心ブロックの患者、末梢循環障害(レイノー症候群、
間欠性跛行)のある患者、肝機能障害患者(部分的肝代謝
チモロールマレイン のため)、脳血管不全のある患者、乾癬の既往歴のある患
404
カナダ
酸塩
者(発疹の報告があるため)では、慎重に投与すること。
運転及び機械操作に関する注意喚起:屈折異常、複視、
眼瞼下垂、軽度かつ一過性の霧視の頻繁な発現、めまい
や疲労感などの視覚障害が生じることを考慮すべきである。
乳糖が含まれているため、ガラクトース不耐性、グルコース
-ガラクトース吸収不良、又はLappラクターゼ欠損症のまれ
な遺伝性疾患を有する患者は本剤を服用すべきではない。
β遮断薬を投与されている患者では、エピネフリンはアナ
フィラキシーの治療において通常の効果を示さないことがあ
り、アレルギー型反応の治療が困難になる可能性もある。
β遮断薬は、筋無力症状(複視、眼瞼下垂、全身性脱力
など)と一致する筋力低下を増強することが報告されている。
軽度または中等度の慢性閉塞性肺疾患(慢性気管支炎、
肺気腫など)、気管支けいれん性疾患、気管支けいれん性
疾患の既往(気管支喘息又は気管支喘息の既往)のある患
者は、一般にβ遮断薬を投与してはならない。
添付文書改
訂(警告・禁 注目
忌)
安全性および忍容性に関する第Ⅲ相継続試験(DIUR006)に基づき、先天性副腎過形成の適応をもつヒドロコル
チゾン徐放性経口投与製剤の欧州添付文書が改訂され
た。主な改訂内容は以下のとおり。
・Posology and method of administrationの項に、臨床反応
のモニタリングが必要であり、用量調節が必要となる徴候が
ないか、患者を注意深く観察する必要がある旨の追記
・Special warnings and precautions for useの項に、先天性
副腎過形成の治療では、しばしば鉱質コルチコイドによる追
混合死菌・ヒドロコル
405
加治療が必要となる旨、及びカリウムをモニターすべき旨の 欧州連合
チゾン
追記
・Interaction with other medicinal products and other forms
of interactionの項に、電解質バランスに影響を及ぼす医薬
品/物質(低カリウム血症利尿薬、刺激性下剤、鉱質コルチ
コイド(フルドロコルチゾン)、テトラコサクチド(synacthen)、
アムホテリシンB静脈内投与、liquorice)は、本剤を服用して
いる患者の低カリウム血症のリスクを高める可能性がある旨
の追記
・Undesirable effectsの項に、低カリウム血症の追記
その他
53
注目