よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (65 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
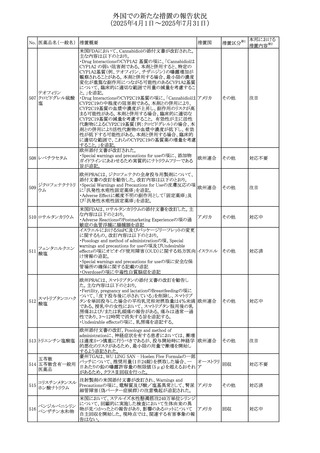
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
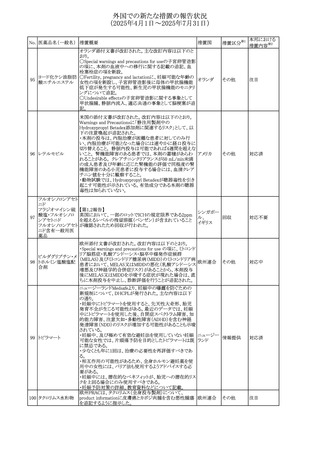
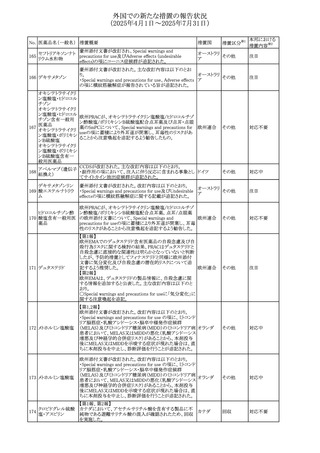
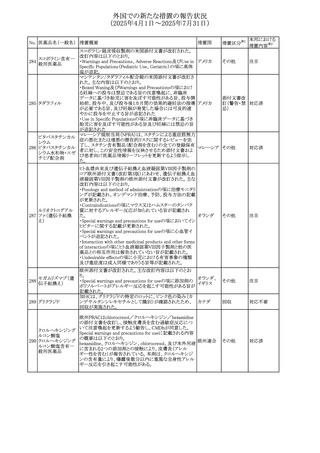
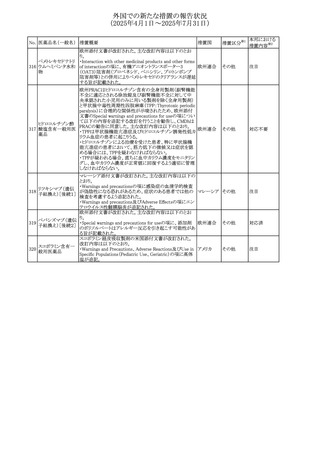
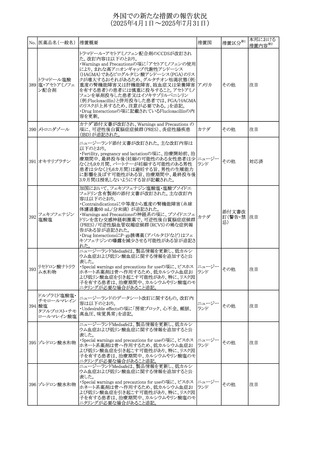
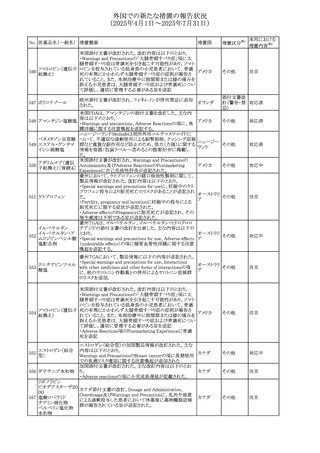
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
アセトアミノフェン含有製剤の豪州添付文書改訂に関するも
の。改訂内容は以下のとおり。
・Special warnings and precautions for useの項に「ピログル
タミン酸アシドーシスによる高アニオンギャップ代謝性アシ
ジプロフィリン・ジヒド ドーシス(HAGMA)が重度の腎機能障害や敗血症などの重
ロコデイン配合剤
症疾患を有する患者、又は栄養不良やグルタチオン欠乏の
トラマドール塩酸
原因となる他の要因を有する患者において報告されてい
オーストラリ
470
その他
塩・アセトアミノフェ る。」旨を追記
ア
ン配合剤
・Interactions with other medicines and other forms of
アセトアミノフェン
interactionsの項にピログルタミン酸アシドーシスによる
HAGMAを含めるために「Flucloxacillin」との相互作用を更
新
・Adverse effectsの項の「代謝及び栄養システム障害」を更
新し、ピログルタミン酸アシドーシスによるHAGMAを追記。
アセトアミノフェン含有製剤の豪州添付文書改訂に関するも
の。改訂内容は以下のとおり。
・Special warnings and precautions for useの項に「ピログル
タミン酸アシドーシスによる高アニオンギャップ代謝性アシ
ドーシス(HAGMA)が重度の腎機能障害や敗血症などの重
アセトアミノフェン
症疾患を有する患者、または栄養不良やグルタチオン欠乏
ジプロフィリン・ジヒド
の原因となる他の要因を有する患者において報告されてい
ロコデイン配合剤
オーストラリ
471
る。」旨を追記
その他
トラマドール塩酸
ア
・Interactions with other medicines and other forms of
塩・アセトアミノフェ
interactionsの項にピログルタミン酸アシドーシスによる
ン配合剤
HAGMAを含めるために「Flucloxacillin」との相互作用を更
新
・Adverse effectsの項の「代謝および栄養システム障害」を
更新し、ピログルタミン酸アシドーシスによるHAGMAを追
記。
豪TGAにおいて、フィブリンシーラント製剤の製品情報が更
フィブリノゲン加第1 新され、Contraindicationsの項に「不注意による血管内注射 オーストラリ
472
その他
3因子(3)
が致死的な血栓塞栓性合併症を引き起こす可能性がある」 ア
旨が追記された。
【第1報】
米国FDAより本剤とSuzetrigineの相互作用に関するシグナ
ルl情報を入手し、併用禁忌とすることを支持した。
ニルマトレルビル・リ
473
【第2報】
アメリカ
その他
トナビル
CDSを改訂し、Contraindications及び Interaction with
other medicinal products and other forms of interactionの
項に、Suzetrigineを追記した。
アトバコンのGDSが改訂され、Warnings and Precautionsの
項に、スティーヴンス・ジョンソン症候群(SJS)、好酸球増加
アトバコン
と全身症状を伴う薬物反応(DRESS)及び多形紅斑(EM)を
474 アトバコン・プログア
イギリス
その他
含む重度皮膚副作用(SCAR)に関する注意喚起が追加、
ニル塩酸塩
Adverse Reactionsの項に、好酸球増加と全身症状を伴う薬
物反応(DRESS)が追加された。
アミトリプチリン/クロルジアゼポキシド配合剤の米国添付文
クロルジアゼポキシ 書が改訂された。
475
アメリカ
その他
ド
・Warnings and Precautions及びAdverse Reactionsの項に、
低ナトリウム血症が追記。
豪州において、インフルエンザワクチンの添付文書が改訂さ
れた。
インフルエンザHA 改訂内容は以下のとおり。
オーストラリ
476
その他
ワクチン
・Adverse effectsの項において、発疹が追記された。
ア
・Adverse effectsの項において、一過性の腎障害を伴う、ヘ
ノッホ・シェーンライン紫斑病が追記された。
仏ANSMは、ゾルピデムを含むベンゾジアゼピン系薬剤の長
ゾルピデム酒石酸 期使用・依存のリスクを軽減するために、箱に含まれる錠剤
477
フランス
その他
塩
数を1週間の治療に相当する5~7錠に減らして流通させる
ように要求した。
ボノプラザンフマル metronidazole benzoate(内用懸濁液)の豪州添付文書が改
酸塩・アモキシシリ 訂され、Special warnings and precautions for use及び
オーストラリ
478
その他
ン水和物・メトロニダ Adverse effects (undesirable effects)にDRESS症候群が追 ア
ゾール
記された。
65
本邦における
措置内容※2
注目
注目
対応済
対応不要
注目
注目
対応済
注目
注目
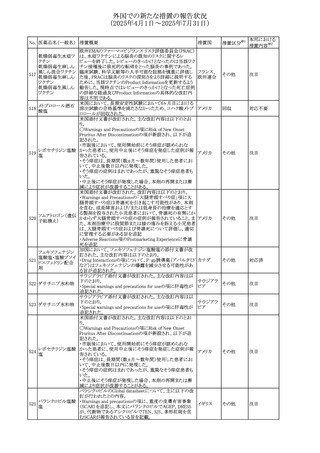
(2025年4月1日~2025年7月31日)
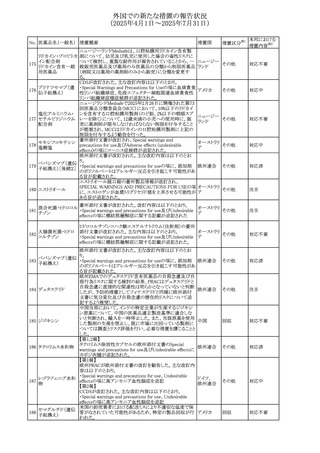
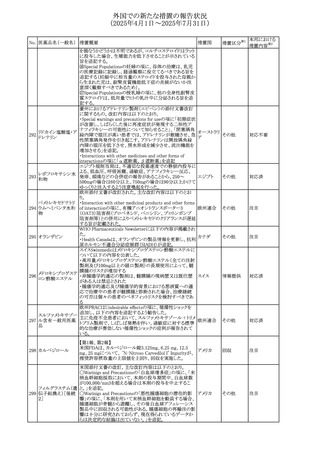
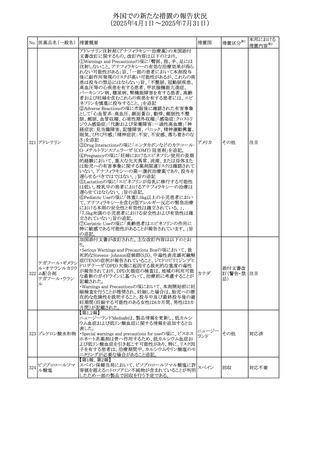
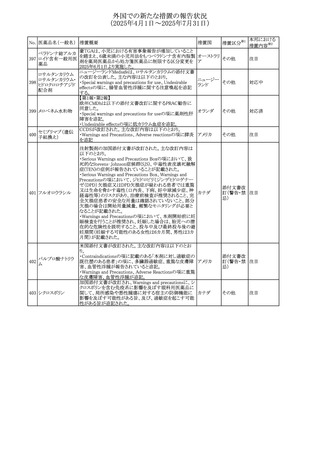
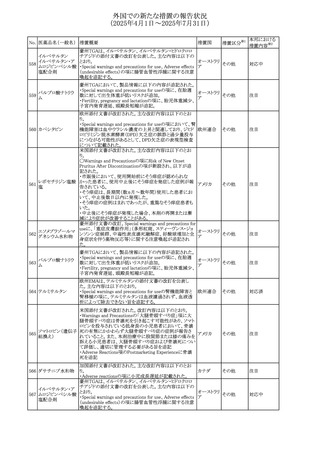
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
アセトアミノフェン含有製剤の豪州添付文書改訂に関するも
の。改訂内容は以下のとおり。
・Special warnings and precautions for useの項に「ピログル
タミン酸アシドーシスによる高アニオンギャップ代謝性アシ
ジプロフィリン・ジヒド ドーシス(HAGMA)が重度の腎機能障害や敗血症などの重
ロコデイン配合剤
症疾患を有する患者、又は栄養不良やグルタチオン欠乏の
トラマドール塩酸
原因となる他の要因を有する患者において報告されてい
オーストラリ
470
その他
塩・アセトアミノフェ る。」旨を追記
ア
ン配合剤
・Interactions with other medicines and other forms of
アセトアミノフェン
interactionsの項にピログルタミン酸アシドーシスによる
HAGMAを含めるために「Flucloxacillin」との相互作用を更
新
・Adverse effectsの項の「代謝及び栄養システム障害」を更
新し、ピログルタミン酸アシドーシスによるHAGMAを追記。
アセトアミノフェン含有製剤の豪州添付文書改訂に関するも
の。改訂内容は以下のとおり。
・Special warnings and precautions for useの項に「ピログル
タミン酸アシドーシスによる高アニオンギャップ代謝性アシ
ドーシス(HAGMA)が重度の腎機能障害や敗血症などの重
アセトアミノフェン
症疾患を有する患者、または栄養不良やグルタチオン欠乏
ジプロフィリン・ジヒド
の原因となる他の要因を有する患者において報告されてい
ロコデイン配合剤
オーストラリ
471
る。」旨を追記
その他
トラマドール塩酸
ア
・Interactions with other medicines and other forms of
塩・アセトアミノフェ
interactionsの項にピログルタミン酸アシドーシスによる
ン配合剤
HAGMAを含めるために「Flucloxacillin」との相互作用を更
新
・Adverse effectsの項の「代謝および栄養システム障害」を
更新し、ピログルタミン酸アシドーシスによるHAGMAを追
記。
豪TGAにおいて、フィブリンシーラント製剤の製品情報が更
フィブリノゲン加第1 新され、Contraindicationsの項に「不注意による血管内注射 オーストラリ
472
その他
3因子(3)
が致死的な血栓塞栓性合併症を引き起こす可能性がある」 ア
旨が追記された。
【第1報】
米国FDAより本剤とSuzetrigineの相互作用に関するシグナ
ルl情報を入手し、併用禁忌とすることを支持した。
ニルマトレルビル・リ
473
【第2報】
アメリカ
その他
トナビル
CDSを改訂し、Contraindications及び Interaction with
other medicinal products and other forms of interactionの
項に、Suzetrigineを追記した。
アトバコンのGDSが改訂され、Warnings and Precautionsの
項に、スティーヴンス・ジョンソン症候群(SJS)、好酸球増加
アトバコン
と全身症状を伴う薬物反応(DRESS)及び多形紅斑(EM)を
474 アトバコン・プログア
イギリス
その他
含む重度皮膚副作用(SCAR)に関する注意喚起が追加、
ニル塩酸塩
Adverse Reactionsの項に、好酸球増加と全身症状を伴う薬
物反応(DRESS)が追加された。
アミトリプチリン/クロルジアゼポキシド配合剤の米国添付文
クロルジアゼポキシ 書が改訂された。
475
アメリカ
その他
ド
・Warnings and Precautions及びAdverse Reactionsの項に、
低ナトリウム血症が追記。
豪州において、インフルエンザワクチンの添付文書が改訂さ
れた。
インフルエンザHA 改訂内容は以下のとおり。
オーストラリ
476
その他
ワクチン
・Adverse effectsの項において、発疹が追記された。
ア
・Adverse effectsの項において、一過性の腎障害を伴う、ヘ
ノッホ・シェーンライン紫斑病が追記された。
仏ANSMは、ゾルピデムを含むベンゾジアゼピン系薬剤の長
ゾルピデム酒石酸 期使用・依存のリスクを軽減するために、箱に含まれる錠剤
477
フランス
その他
塩
数を1週間の治療に相当する5~7錠に減らして流通させる
ように要求した。
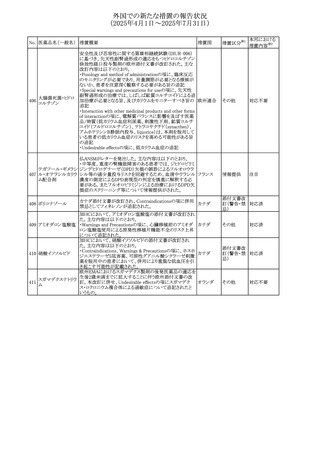
ボノプラザンフマル metronidazole benzoate(内用懸濁液)の豪州添付文書が改
酸塩・アモキシシリ 訂され、Special warnings and precautions for use及び
オーストラリ
478
その他
ン水和物・メトロニダ Adverse effects (undesirable effects)にDRESS症候群が追 ア
ゾール
記された。
65
本邦における
措置内容※2
注目
注目
対応済
対応不要
注目
注目
対応済
注目
注目