よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
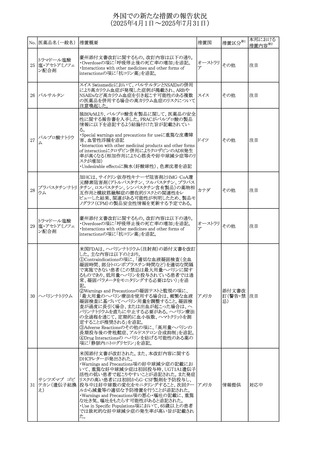
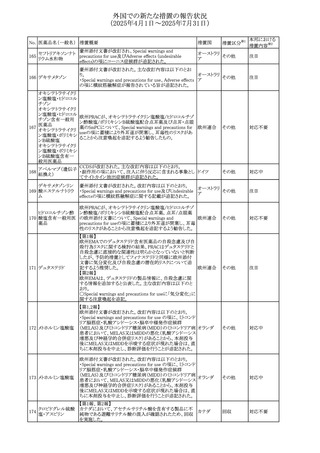
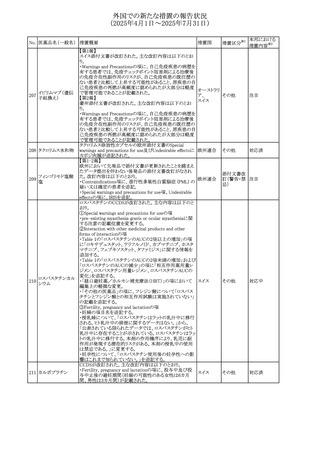
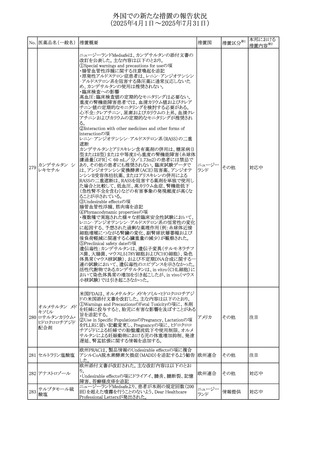
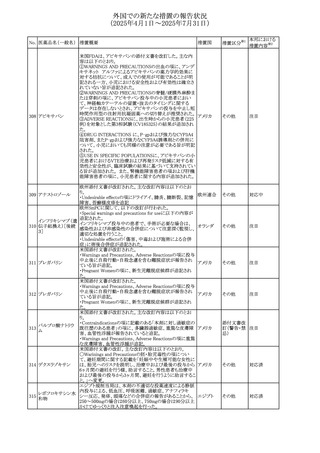
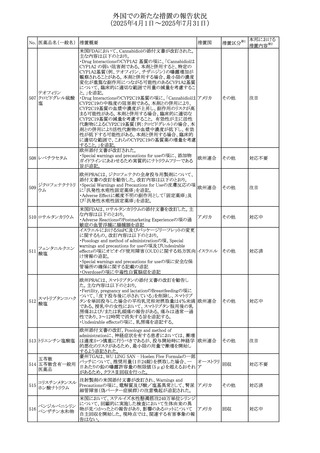
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
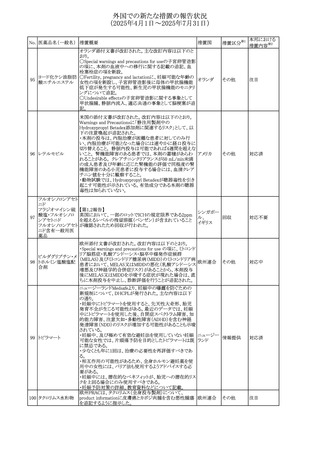
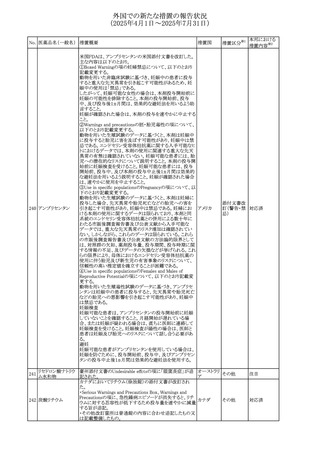
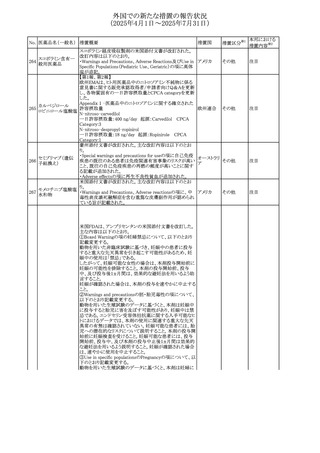
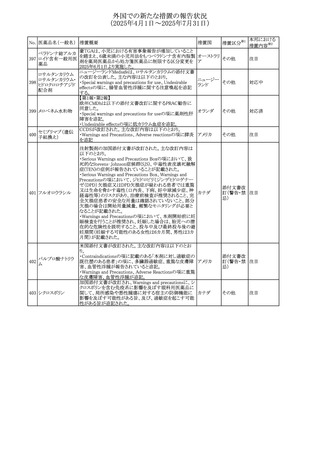
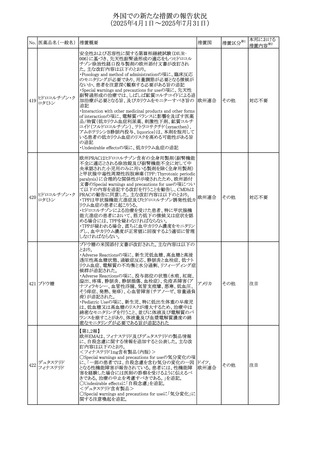
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
テガフール・ギメラシ ・Fertility,pregnancy and lactationの項において、妊娠可能
オーストラリ
136 ル・オテラシルカリウ な年齢の女性は妊娠を避け、本剤投与中及び最終投与後
その他
ア
ム配合剤
少なくとも6カ月間は避妊すること、男性は本剤の投与中及
び投与中止後少なくとも3カ月間は避妊することが追記され
た。
注目
豪州添付文書が改訂された。改訂内容は以下のとおり。
オーストラリ
・Special warnings and precautions for use及びUndesirable
その他
ア
effectsの項に横紋筋融解症に関する記載が追記された
注目
137
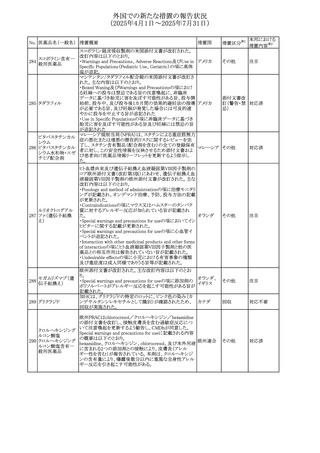
デキサメタゾンプロ
ピオン酸エステル
欧州添付文書が改訂された。改訂内容は以下のとおり。
・Posology and method of administrationの項に、C1-インヒ
ビター(C1-INH)正常の遺伝性血管浮腫(HAE)患者で、
3ヵ月間の投与後に発作の抑制が不十分であった場合は、
投与中止を検討する旨が追記された。
・Special warnings and precautions for useの項に、C1-INH
正常のHAE患者における本剤の臨床データは限られている
ラナデルマブ(遺伝
138
旨(臨床データはないからの変更)、カリクレイン-キニン系 オランダ
その他
子組換え)
(KKS)経路に関連しない変異を有するC1-INH正常のHAE
患者は本剤に反応することが期待できない旨及び可能であ
れば、最新のHAEガイドラインに従って遺伝子検査を実施
し、臨床的改善が認められない場合は投与を中止すること
が推奨される旨が追記された。
・Pharmacodynamic propertiesの項に、CASPIAN試験
(SHP643-303試験)の結果等が追記された。
仏ANSMは、妊婦に対する非ステロイド性抗炎症薬
ジクロフェナクナトリ
139
(NSAIDs)使用の潜在的リスクに関する情報を強化するため フランス
その他
ウム
に、製薬会社に対して添付文書の改訂を要請した。
仏ANSMは、妊婦に対する非ステロイド性抗炎症薬
ロキソプロフェンナト
140
(NSAIDs)使用の潜在的リスクに関する情報を強化するため フランス
その他
リウム水和物
に、製薬会社に対して添付文書の改訂を要請した。
仏ANSMは、妊婦に対する非ステロイド性抗炎症薬
141 ナブメトン
(NSAIDs)使用の潜在的リスクに関する情報を強化するため フランス
その他
に、製薬会社に対して添付文書の改訂を要請した。
クロピドグレル硫酸
塩・アスピリン
仏ANSMは、妊婦に対する非ステロイド性抗炎症薬
142 ケトプロフェン
(NSAIDs)使用の潜在的リスクに関する情報を強化するため フランス
その他
ジクロフェナクナトリ に、製薬会社に対して添付文書の改訂を要請した。
ウム
豪州添付文書が改訂された。改訂内容は以下のとおり。
・Special Warnings and Precautions for Useの重篤な皮膚反
オーストラリ
143 セレコキシブ
応の項及びUndesirable Effectsの項について、固定薬疹
その他
ア
(FDE)及び汎発性水疱性固定薬疹(GBFDE)が追記され
た。
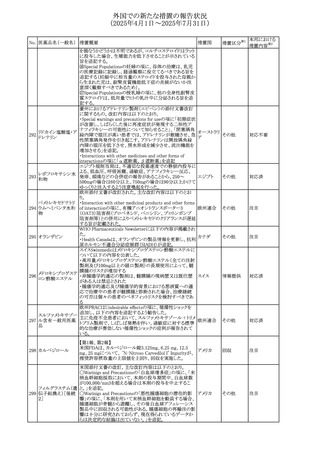
豪州添付文書が改訂され、Special warnings and
セフトリアキソンナト
オーストラリ
144
precautions for use及びAdverse effects (undesirable
その他
リウム水和物
ア
effects)の項にコーニス症候群が追記された。
デキサメタゾン製剤(注射剤)の豪州添付文書が改訂され
デキサメタゾン含有 た。改訂内容は以下のとおり。
オーストラリ
145
その他
一般用医薬品
・Special warnings and precautions for use及びUndesirable ア
effectsの項に横紋筋融解症に関する記載が追記された
韓国添付文書が改訂され、side effectの項に経口剤では睡
レボフロキサシン水
眠障害及び自殺念慮を、注射剤では睡眠障害が追記され 韓国
その他
和物
た。
ニュージランドMedsafeで2025年2月26日に開催された第73
回医薬品分類委員会(MCC)において、10%以下のリドカイ
ンを含有する口腔粘膜用製剤(のど飴、2%以下の咽頭スプ
リドカイン含有一般
ニュージー
147
レーを除く)について、12歳未満の小児への使用時に、販
その他
用医薬品
ランド
売に薬剤師が関与しなければならない制限を付与すること
が提案され、MCCはリドカインの口腔粘膜用製剤に上記の
制限を付与するよう勧告を行った。
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
ベバシズマブ(遺伝
148
・Special warnings and precautions for useの項に、添加剤 欧州連合 その他
子組換え)[後続4]
のポリソルベートはアレルギー反応を引き起こす可能性があ
る旨が記載された。
146
17
注目
注目
注目
注目
注目
対応中
注目
対応不要
注目
対応不要
対応済
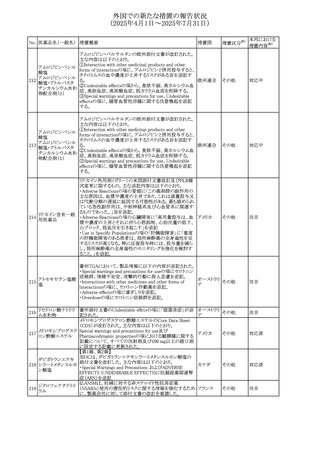
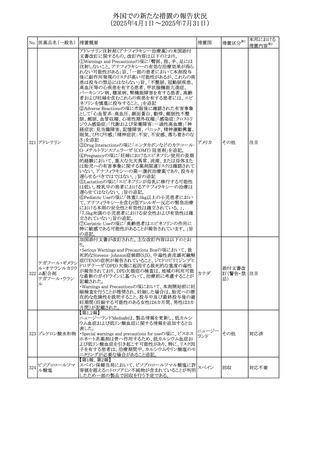
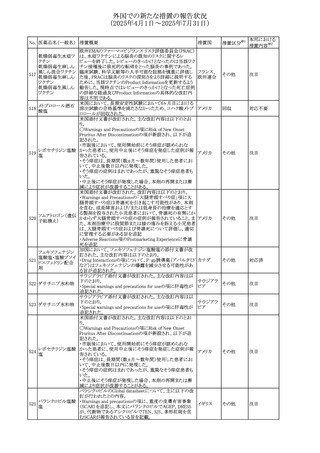
(2025年4月1日~2025年7月31日)
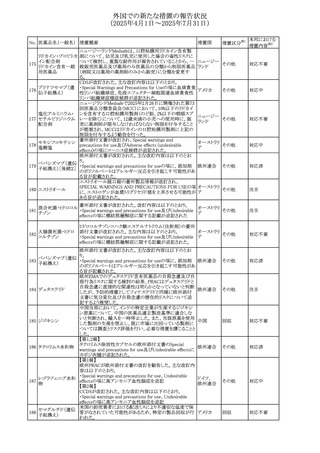
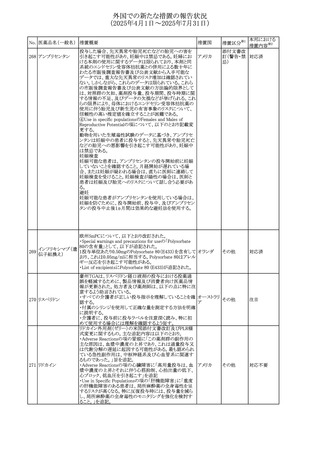
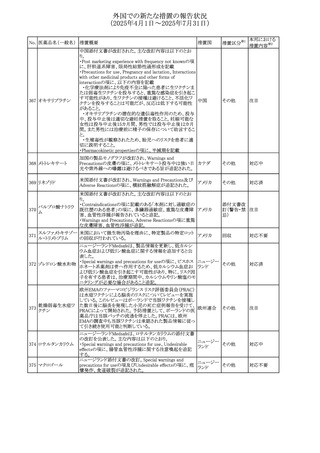
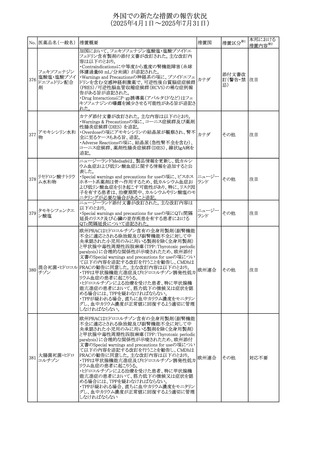
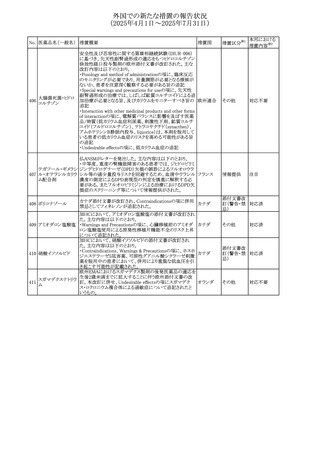
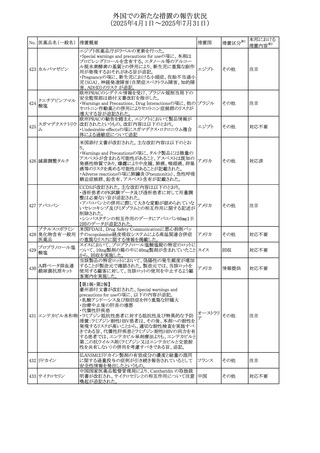
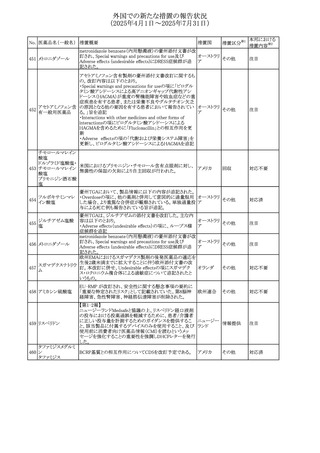
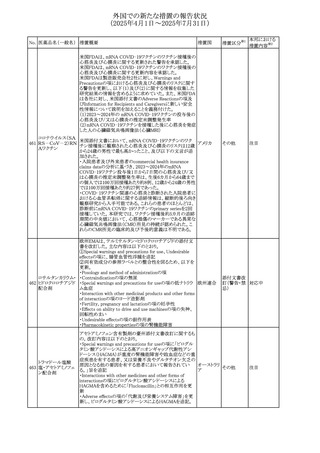
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
テガフール・ギメラシ ・Fertility,pregnancy and lactationの項において、妊娠可能
オーストラリ
136 ル・オテラシルカリウ な年齢の女性は妊娠を避け、本剤投与中及び最終投与後
その他
ア
ム配合剤
少なくとも6カ月間は避妊すること、男性は本剤の投与中及
び投与中止後少なくとも3カ月間は避妊することが追記され
た。
注目
豪州添付文書が改訂された。改訂内容は以下のとおり。
オーストラリ
・Special warnings and precautions for use及びUndesirable
その他
ア
effectsの項に横紋筋融解症に関する記載が追記された
注目
137
デキサメタゾンプロ
ピオン酸エステル
欧州添付文書が改訂された。改訂内容は以下のとおり。
・Posology and method of administrationの項に、C1-インヒ
ビター(C1-INH)正常の遺伝性血管浮腫(HAE)患者で、
3ヵ月間の投与後に発作の抑制が不十分であった場合は、
投与中止を検討する旨が追記された。
・Special warnings and precautions for useの項に、C1-INH
正常のHAE患者における本剤の臨床データは限られている
ラナデルマブ(遺伝
138
旨(臨床データはないからの変更)、カリクレイン-キニン系 オランダ
その他
子組換え)
(KKS)経路に関連しない変異を有するC1-INH正常のHAE
患者は本剤に反応することが期待できない旨及び可能であ
れば、最新のHAEガイドラインに従って遺伝子検査を実施
し、臨床的改善が認められない場合は投与を中止すること
が推奨される旨が追記された。
・Pharmacodynamic propertiesの項に、CASPIAN試験
(SHP643-303試験)の結果等が追記された。
仏ANSMは、妊婦に対する非ステロイド性抗炎症薬
ジクロフェナクナトリ
139
(NSAIDs)使用の潜在的リスクに関する情報を強化するため フランス
その他
ウム
に、製薬会社に対して添付文書の改訂を要請した。
仏ANSMは、妊婦に対する非ステロイド性抗炎症薬
ロキソプロフェンナト
140
(NSAIDs)使用の潜在的リスクに関する情報を強化するため フランス
その他
リウム水和物
に、製薬会社に対して添付文書の改訂を要請した。
仏ANSMは、妊婦に対する非ステロイド性抗炎症薬
141 ナブメトン
(NSAIDs)使用の潜在的リスクに関する情報を強化するため フランス
その他
に、製薬会社に対して添付文書の改訂を要請した。
クロピドグレル硫酸
塩・アスピリン
仏ANSMは、妊婦に対する非ステロイド性抗炎症薬
142 ケトプロフェン
(NSAIDs)使用の潜在的リスクに関する情報を強化するため フランス
その他
ジクロフェナクナトリ に、製薬会社に対して添付文書の改訂を要請した。
ウム
豪州添付文書が改訂された。改訂内容は以下のとおり。
・Special Warnings and Precautions for Useの重篤な皮膚反
オーストラリ
143 セレコキシブ
応の項及びUndesirable Effectsの項について、固定薬疹
その他
ア
(FDE)及び汎発性水疱性固定薬疹(GBFDE)が追記され
た。
豪州添付文書が改訂され、Special warnings and
セフトリアキソンナト
オーストラリ
144
precautions for use及びAdverse effects (undesirable
その他
リウム水和物
ア
effects)の項にコーニス症候群が追記された。
デキサメタゾン製剤(注射剤)の豪州添付文書が改訂され
デキサメタゾン含有 た。改訂内容は以下のとおり。
オーストラリ
145
その他
一般用医薬品
・Special warnings and precautions for use及びUndesirable ア
effectsの項に横紋筋融解症に関する記載が追記された
韓国添付文書が改訂され、side effectの項に経口剤では睡
レボフロキサシン水
眠障害及び自殺念慮を、注射剤では睡眠障害が追記され 韓国
その他
和物
た。
ニュージランドMedsafeで2025年2月26日に開催された第73
回医薬品分類委員会(MCC)において、10%以下のリドカイ
ンを含有する口腔粘膜用製剤(のど飴、2%以下の咽頭スプ
リドカイン含有一般
ニュージー
147
レーを除く)について、12歳未満の小児への使用時に、販
その他
用医薬品
ランド
売に薬剤師が関与しなければならない制限を付与すること
が提案され、MCCはリドカインの口腔粘膜用製剤に上記の
制限を付与するよう勧告を行った。
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
ベバシズマブ(遺伝
148
・Special warnings and precautions for useの項に、添加剤 欧州連合 その他
子組換え)[後続4]
のポリソルベートはアレルギー反応を引き起こす可能性があ
る旨が記載された。
146
17
注目
注目
注目
注目
注目
対応中
注目
対応不要
注目
対応不要
対応済