よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
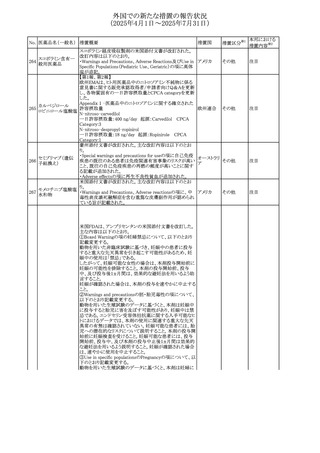
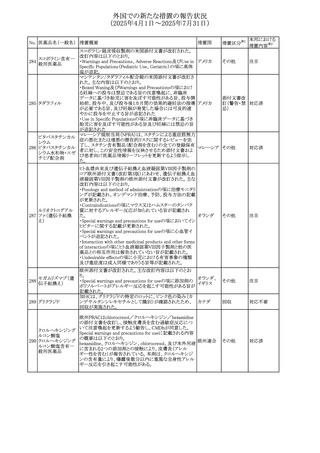
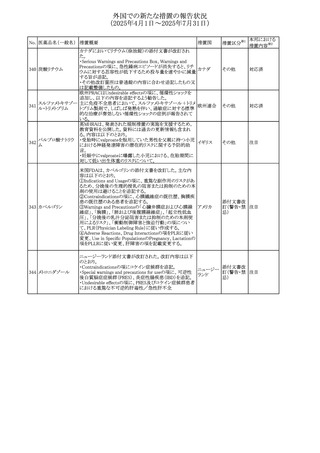
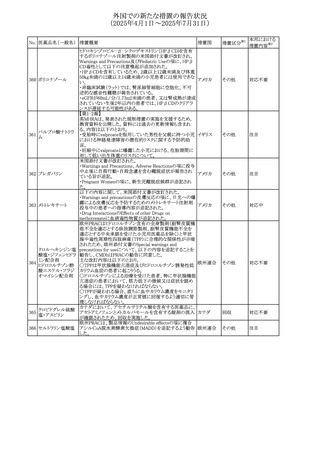
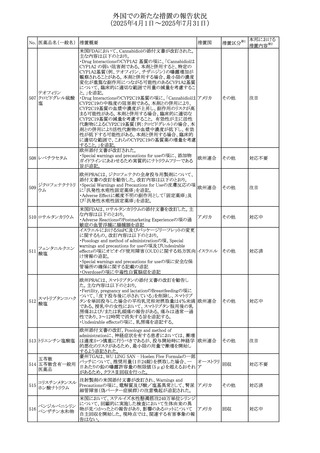
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
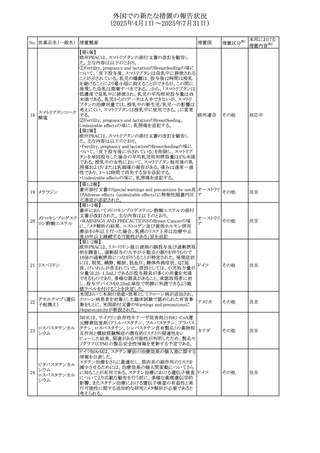
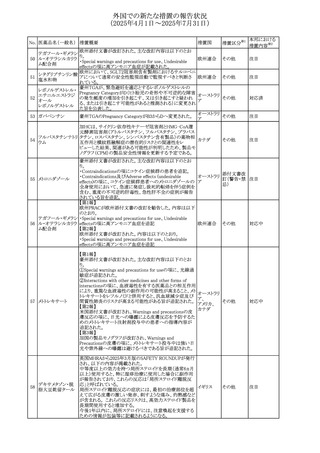
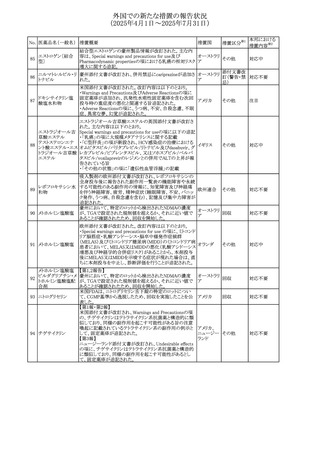
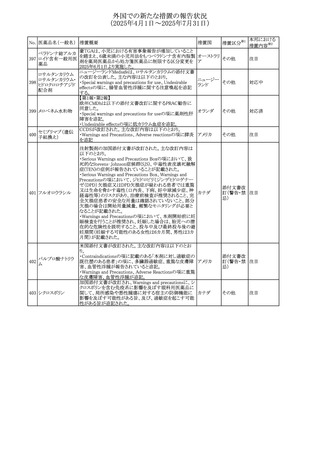
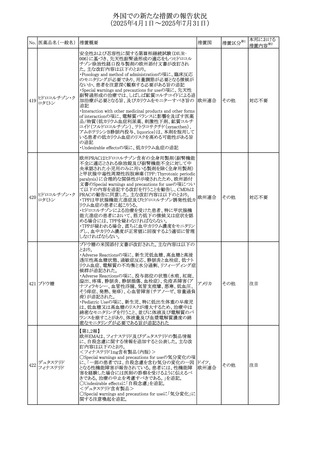
No. 医薬品名(一般名) 措置概要
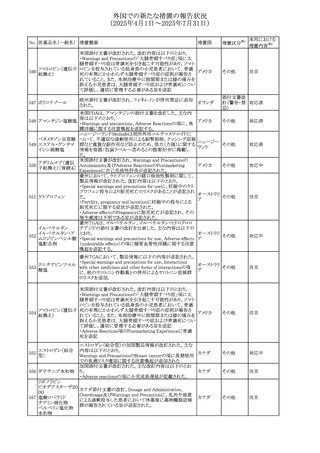
413 フェノフィブラート
414
エルトロンボパグ
オラミン
415 カペシタビン
措置国
フェノフィブラートの米国添付文書が改訂された。主な内容
は以下のとおり。
Contraindicationsの項
①末期腎疾患(ESRD)患者を追記
②本剤の添加物に対する過敏症を有する患者。アナフィラ
キシーおよび血管性浮腫等の
重篤な過敏症反応がフェノフィブラートで報告されている旨
を追記
Warnings and Precautionsの項
③死亡率および冠動脈性心疾患の罹患率の項に、2型糖
尿病患者を対象とした試験でフェノフィブラートやペマフィブ
ラートは心血管疾患の罹病率および死亡率を低下させない
旨を追記
④肝毒性の項に、臨床試験において、フェノフィブラートの
中等度の1日投与量または最大推奨1日投与量は、血清
ASTまたはALTの上昇と関連していた旨を追記
⑤ミオパチーおよび横紋筋融解症の項に、ミオパチーの危
険因子、ミオパチーおよび横紋筋融解症を予防、またはそ
のリスクを軽減するための手段を追記
⑥血清クレアチニン増加の項に、本剤は末期腎疾患
アメリカ
(ESTD)および透析を受けている患者等、重度の腎機能障
害を有する患者には禁忌である旨を追記
⑦胆石症の項に、本剤は基礎疾患として胆嚢疾患を有する
患者には禁忌である旨を追記
⑧クマリン抗凝固薬による出血リスクの増加について、項目
名を変更
⑨過敏症反応の項に、本剤は、フェノフィブラート、フェノ
フィブリン酸または本剤の成分のいずれかに対し過敏症の
ある患者には禁忌である旨を追記
⑩静脈塞栓性疾患の項に、ペマフィブラートの心血管系転
帰に関する試験における肺塞栓症、深部静脈血栓症に関
する内容を追記
⑪HDLコレステロール値の逆説的な低下の項を記載整備
Adverse Reactionsの項
⑫Postmarketing Experienceの項に、アナフィラキシー、血
管性浮腫を追記する他、記載整備
⑬Drug Interactionsの項を記載整備
⑭Use in Specific Populationsの小児、高齢者、腎障害、肝
障害の項を記載整備
米国FDAにおいて、エルトロンボパグ オラミンの添付文書
が改訂された。主な内容は以下のとおり。
・Warnings and Precautions、Drug Interactionsの項に、エル
アメリカ
トロンボパグは色が濃く患者の検体を変色させる可能性があ
るため,ビリルビンやクレアチニンなどの臨床検査に影響を
及ぼす可能性があることについて追記された。
仏ANSMがレターを発出した。主な内容は以下のとおり。
・中等度、重度の腎機能障害のある患者では、ジヒドロピリミ
ジンデヒドロゲナーゼ(DPD)欠損の誤診によるフルオロウラ
シル等の過少量投与リスクを回避するため、血清中ウラシル フランス
濃度の測定によるDPD表現型の判定を慎重に解釈する必
要がある。またフルオロピリミジンによる治療におけるDPD欠
損症のスクリーニング等について情報提供がされた。
56
措置区分※1
本邦における
措置内容※2
添付文書改
訂(警告・禁 注目
忌)
その他
対応済
情報提供
注目
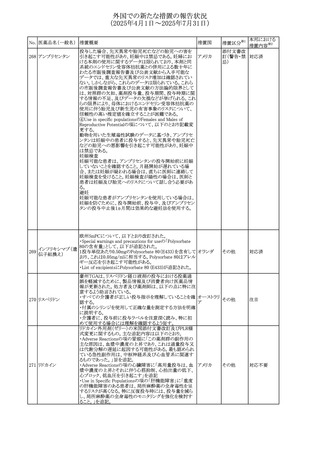
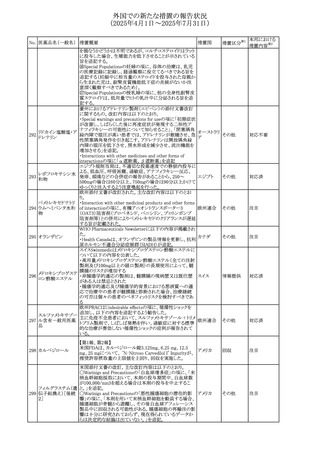
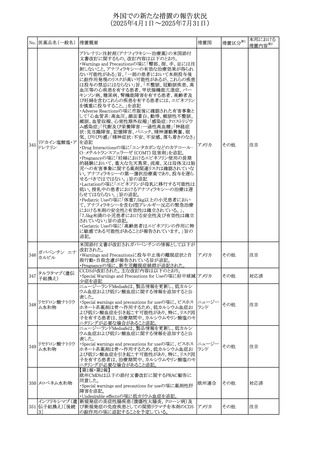
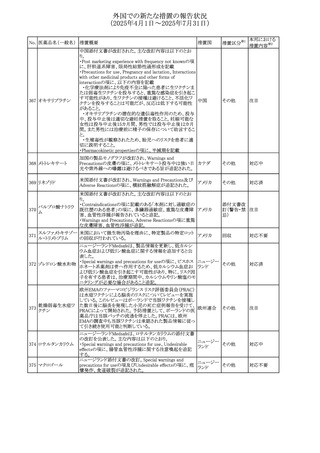
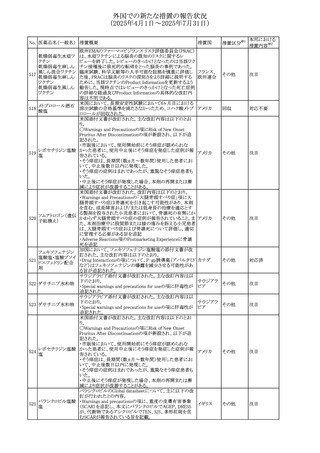
(2025年4月1日~2025年7月31日)
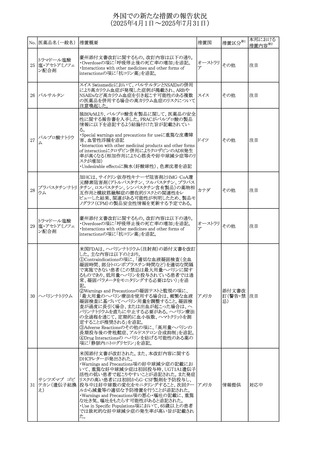
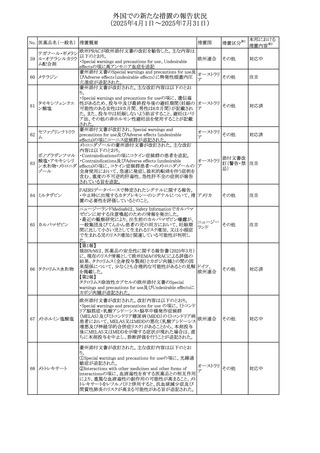
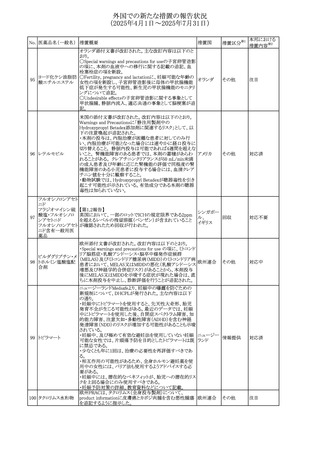
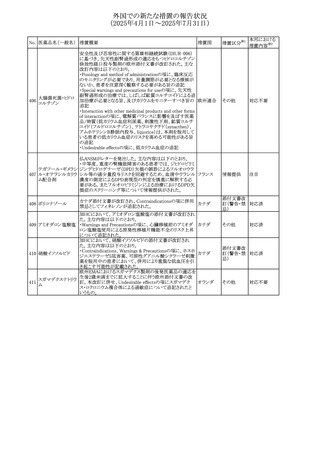
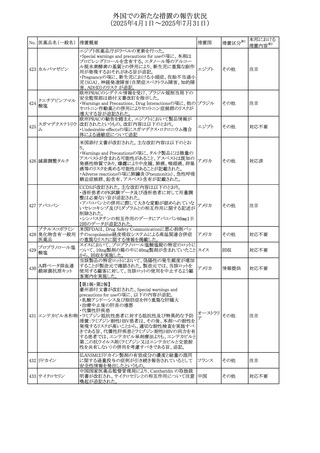
No. 医薬品名(一般名) 措置概要
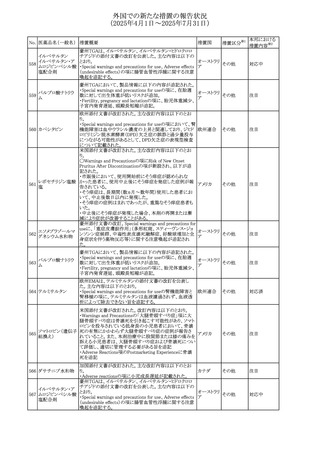
413 フェノフィブラート
414
エルトロンボパグ
オラミン
415 カペシタビン
措置国
フェノフィブラートの米国添付文書が改訂された。主な内容
は以下のとおり。
Contraindicationsの項
①末期腎疾患(ESRD)患者を追記
②本剤の添加物に対する過敏症を有する患者。アナフィラ
キシーおよび血管性浮腫等の
重篤な過敏症反応がフェノフィブラートで報告されている旨
を追記
Warnings and Precautionsの項
③死亡率および冠動脈性心疾患の罹患率の項に、2型糖
尿病患者を対象とした試験でフェノフィブラートやペマフィブ
ラートは心血管疾患の罹病率および死亡率を低下させない
旨を追記
④肝毒性の項に、臨床試験において、フェノフィブラートの
中等度の1日投与量または最大推奨1日投与量は、血清
ASTまたはALTの上昇と関連していた旨を追記
⑤ミオパチーおよび横紋筋融解症の項に、ミオパチーの危
険因子、ミオパチーおよび横紋筋融解症を予防、またはそ
のリスクを軽減するための手段を追記
⑥血清クレアチニン増加の項に、本剤は末期腎疾患
アメリカ
(ESTD)および透析を受けている患者等、重度の腎機能障
害を有する患者には禁忌である旨を追記
⑦胆石症の項に、本剤は基礎疾患として胆嚢疾患を有する
患者には禁忌である旨を追記
⑧クマリン抗凝固薬による出血リスクの増加について、項目
名を変更
⑨過敏症反応の項に、本剤は、フェノフィブラート、フェノ
フィブリン酸または本剤の成分のいずれかに対し過敏症の
ある患者には禁忌である旨を追記
⑩静脈塞栓性疾患の項に、ペマフィブラートの心血管系転
帰に関する試験における肺塞栓症、深部静脈血栓症に関
する内容を追記
⑪HDLコレステロール値の逆説的な低下の項を記載整備
Adverse Reactionsの項
⑫Postmarketing Experienceの項に、アナフィラキシー、血
管性浮腫を追記する他、記載整備
⑬Drug Interactionsの項を記載整備
⑭Use in Specific Populationsの小児、高齢者、腎障害、肝
障害の項を記載整備
米国FDAにおいて、エルトロンボパグ オラミンの添付文書
が改訂された。主な内容は以下のとおり。
・Warnings and Precautions、Drug Interactionsの項に、エル
アメリカ
トロンボパグは色が濃く患者の検体を変色させる可能性があ
るため,ビリルビンやクレアチニンなどの臨床検査に影響を
及ぼす可能性があることについて追記された。
仏ANSMがレターを発出した。主な内容は以下のとおり。
・中等度、重度の腎機能障害のある患者では、ジヒドロピリミ
ジンデヒドロゲナーゼ(DPD)欠損の誤診によるフルオロウラ
シル等の過少量投与リスクを回避するため、血清中ウラシル フランス
濃度の測定によるDPD表現型の判定を慎重に解釈する必
要がある。またフルオロピリミジンによる治療におけるDPD欠
損症のスクリーニング等について情報提供がされた。
56
措置区分※1
本邦における
措置内容※2
添付文書改
訂(警告・禁 注目
忌)
その他
対応済
情報提供
注目