よむ、つかう、まなぶ。
資料4-3 外国での新たな措置の報告状況[1.6MB] (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
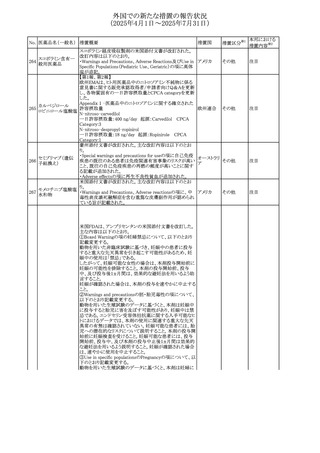
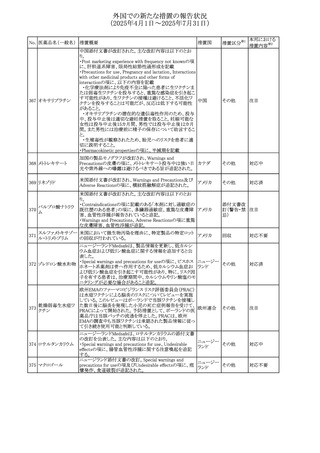
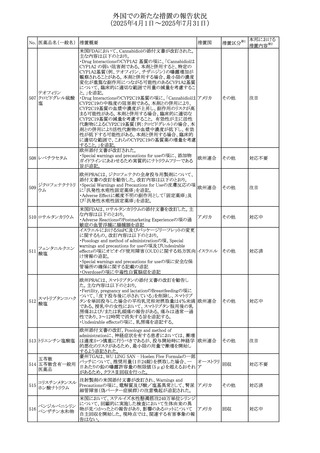
外国での新たな措置の報告状況
(2025年4月1日~2025年7月31日)
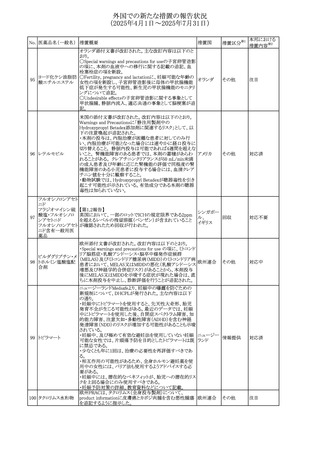
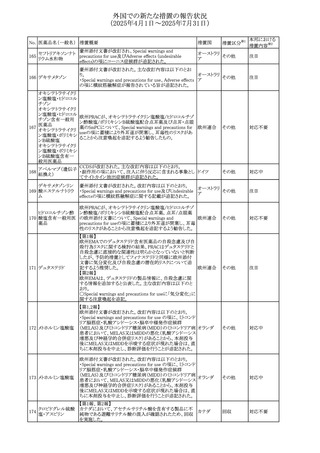
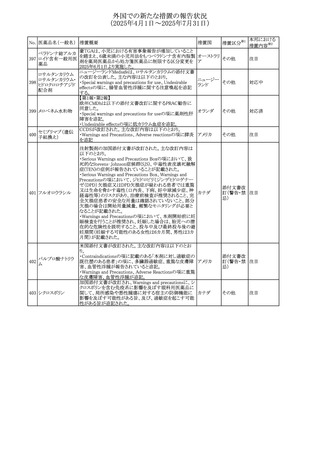
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
スコポラミン経皮吸収製剤の米国添付文書が改訂された。
改訂内容は以下のとおり。
スコポラミン含有一
264
・Warnings and Precautions、Adverse Reactions及びUse in アメリカ
その他
般用医薬品
Specific Populations(Pediatric Use、Geriatric)の項に高体
温が追記。
【第1報、第2報】
欧州EMAは、ヒト用医薬品中のニトロソアミン不純物に係る
意見書に関する販売承認取得者/申請者向けQ&Aを更新
し、各物質固有の一日許容摂取量とCPCA categoryを更新
した。
Appendix 1 -医薬品中のニトロソアミンに関する確立された
カルベジロール
265
許容摂取量
欧州連合 その他
ロピニロール塩酸塩
N-nitroso-carvedilol
一日許容摂取量:400 ng/day 起源:Carvedilol CPCA
Category:3
N-nitroso-despropyl-ropinirol
一日許容摂取量:18 ng/day 起源:Ropinirole CPCA
Category:1
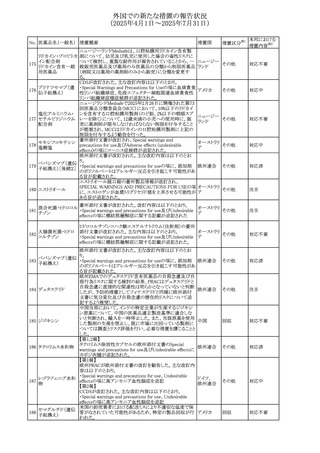
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Special warnings and precautions for useの項に自己免疫
セミプリマブ(遺伝
オーストラリ
266
疾患の既往のある患者は免疫関連有害事象のリスクが高い
その他
子組換え)
ア
こと、既往の自己免疫疾患の再燃の頻度が高いことに関す
る記載が追加された。
・Adverse effectsの項に再生不良性貧血が追加された。
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
モメロチニブ塩酸塩
267
・Warnings and Precautions、Adverse reactionsの項に、中 アメリカ
その他
水和物
毒性表皮壊死融解症を含む重篤な皮膚副作用が認められ
ている旨が記載された。
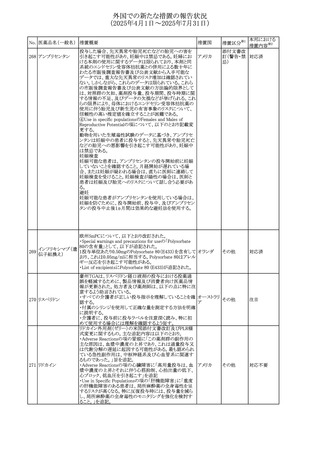
268 アンブリセンタン
米国FDAは、アンブリセンタンの米国添付文書を改訂した。
主な内容は以下のとおり。
①Boxed Warningの項の妊婦禁忌について、以下のとおり
記載変更する。
動物を用いた非臨床試験に基づき、妊娠中の患者に投与
すると重大な先天異常を引き起こす可能性があるため、妊
娠中の使用は「禁忌」である。
したがって、妊娠可能な女性の場合は、本剤投与開始前に
妊娠の可能性を排除すること。本剤の投与開始前、投与
中、及び投与後1ヵ月間は、効果的な避妊法を用いるよう助
言すること。
妊娠が確認された場合は、本剤の投与を速やかに中止する
こと。
②Warnings and precautionsの胚・胎児毒性の項について、
以下のとおり記載変更する。
動物を用いた生殖試験のデータに基づくと、本剤は妊娠中
に投与すると胎児に害を及ぼす可能性があり、妊娠中は禁
忌である。エンドセリン受容体拮抗薬に関する入手可能なヒ
トにおけるデータでは、本剤の使用に関連する重大な先天
異常の有無は確認されていない。妊娠可能な患者には、胎
児への潜在的なリスクについて説明すること。本剤の投与開
始前に妊娠検査を受けること。妊娠可能な患者には、投与
開始前、投与中、及び本剤の投与中止後1ヵ月間は効果的
な避妊法を用いるよう説明すること。妊娠が確認された場合
は、速やかに使用を中止すること。
③Use in specific populationsのPregnancyの項について、以
下のとおり記載変更する。
動物を用いた生殖試験のデータに基づくと、本剤は妊婦に
投与した場合、先天異常や胎児死亡などの胎児への害を
引き起こす可能性があり、妊娠中は禁忌である。妊婦にお アメリカ
ける本剤の使用に関するデータは限られており、本剤と同
系統のエンドセリン受容体拮抗薬との併用による数十年に
わたる市販後調査報告書及び公表文献から入手可能な
データでは、重大な先天異常のリスク増加は確認されてい
ない。しかしながら、これらのデータは限られている。これら
の市販後調査報告書及び公表文献の方法論的限界として
は、対照群の欠如、薬剤投与量、投与期間、投与時期に関
する情報の不足、及びデータの欠損などが挙げられる。これ
らの限界により、母体におけるエンドセリン受容体拮抗薬の
使用に伴う胎児及び新生児の有害事象のリスクについて、
信頼性の高い推定値を確立することが困難である。
④Use in specific populationsのFemales 31
and Males of
Reproductive Potentialの項について、以下のとおり記載変
更する。
本邦における
措置内容※2
注目
注目
注目
注目
添付文書改
訂(警告・禁 対応済
忌)
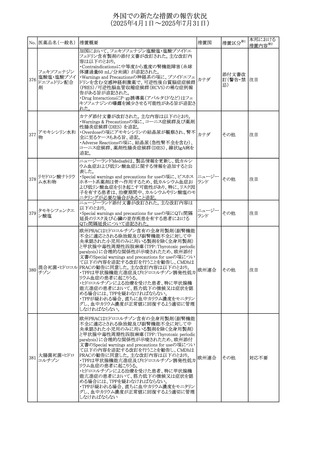
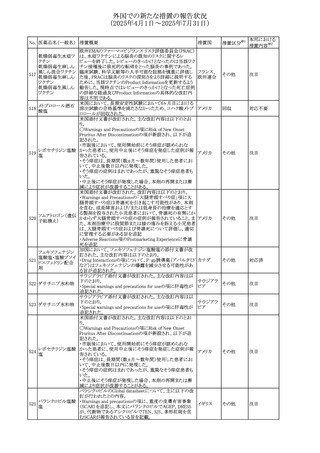
(2025年4月1日~2025年7月31日)
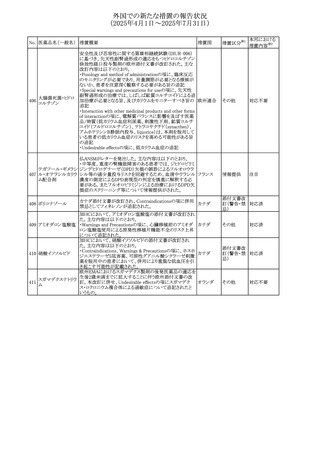
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
スコポラミン経皮吸収製剤の米国添付文書が改訂された。
改訂内容は以下のとおり。
スコポラミン含有一
264
・Warnings and Precautions、Adverse Reactions及びUse in アメリカ
その他
般用医薬品
Specific Populations(Pediatric Use、Geriatric)の項に高体
温が追記。
【第1報、第2報】
欧州EMAは、ヒト用医薬品中のニトロソアミン不純物に係る
意見書に関する販売承認取得者/申請者向けQ&Aを更新
し、各物質固有の一日許容摂取量とCPCA categoryを更新
した。
Appendix 1 -医薬品中のニトロソアミンに関する確立された
カルベジロール
265
許容摂取量
欧州連合 その他
ロピニロール塩酸塩
N-nitroso-carvedilol
一日許容摂取量:400 ng/day 起源:Carvedilol CPCA
Category:3
N-nitroso-despropyl-ropinirol
一日許容摂取量:18 ng/day 起源:Ropinirole CPCA
Category:1
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Special warnings and precautions for useの項に自己免疫
セミプリマブ(遺伝
オーストラリ
266
疾患の既往のある患者は免疫関連有害事象のリスクが高い
その他
子組換え)
ア
こと、既往の自己免疫疾患の再燃の頻度が高いことに関す
る記載が追加された。
・Adverse effectsの項に再生不良性貧血が追加された。
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
モメロチニブ塩酸塩
267
・Warnings and Precautions、Adverse reactionsの項に、中 アメリカ
その他
水和物
毒性表皮壊死融解症を含む重篤な皮膚副作用が認められ
ている旨が記載された。
268 アンブリセンタン
米国FDAは、アンブリセンタンの米国添付文書を改訂した。
主な内容は以下のとおり。
①Boxed Warningの項の妊婦禁忌について、以下のとおり
記載変更する。
動物を用いた非臨床試験に基づき、妊娠中の患者に投与
すると重大な先天異常を引き起こす可能性があるため、妊
娠中の使用は「禁忌」である。
したがって、妊娠可能な女性の場合は、本剤投与開始前に
妊娠の可能性を排除すること。本剤の投与開始前、投与
中、及び投与後1ヵ月間は、効果的な避妊法を用いるよう助
言すること。
妊娠が確認された場合は、本剤の投与を速やかに中止する
こと。
②Warnings and precautionsの胚・胎児毒性の項について、
以下のとおり記載変更する。
動物を用いた生殖試験のデータに基づくと、本剤は妊娠中
に投与すると胎児に害を及ぼす可能性があり、妊娠中は禁
忌である。エンドセリン受容体拮抗薬に関する入手可能なヒ
トにおけるデータでは、本剤の使用に関連する重大な先天
異常の有無は確認されていない。妊娠可能な患者には、胎
児への潜在的なリスクについて説明すること。本剤の投与開
始前に妊娠検査を受けること。妊娠可能な患者には、投与
開始前、投与中、及び本剤の投与中止後1ヵ月間は効果的
な避妊法を用いるよう説明すること。妊娠が確認された場合
は、速やかに使用を中止すること。
③Use in specific populationsのPregnancyの項について、以
下のとおり記載変更する。
動物を用いた生殖試験のデータに基づくと、本剤は妊婦に
投与した場合、先天異常や胎児死亡などの胎児への害を
引き起こす可能性があり、妊娠中は禁忌である。妊婦にお アメリカ
ける本剤の使用に関するデータは限られており、本剤と同
系統のエンドセリン受容体拮抗薬との併用による数十年に
わたる市販後調査報告書及び公表文献から入手可能な
データでは、重大な先天異常のリスク増加は確認されてい
ない。しかしながら、これらのデータは限られている。これら
の市販後調査報告書及び公表文献の方法論的限界として
は、対照群の欠如、薬剤投与量、投与期間、投与時期に関
する情報の不足、及びデータの欠損などが挙げられる。これ
らの限界により、母体におけるエンドセリン受容体拮抗薬の
使用に伴う胎児及び新生児の有害事象のリスクについて、
信頼性の高い推定値を確立することが困難である。
④Use in specific populationsのFemales 31
and Males of
Reproductive Potentialの項について、以下のとおり記載変
更する。
本邦における
措置内容※2
注目
注目
注目
注目
添付文書改
訂(警告・禁 対応済
忌)