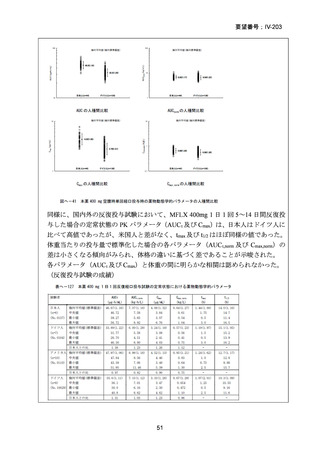
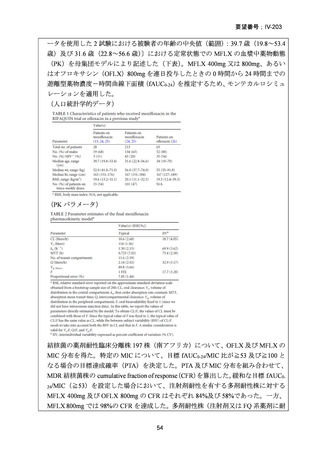
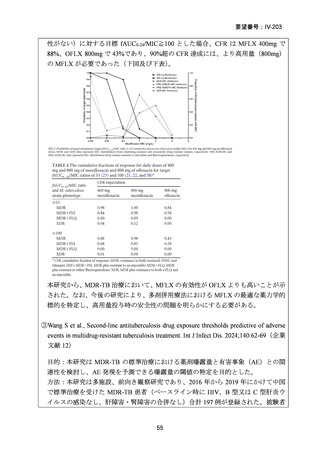
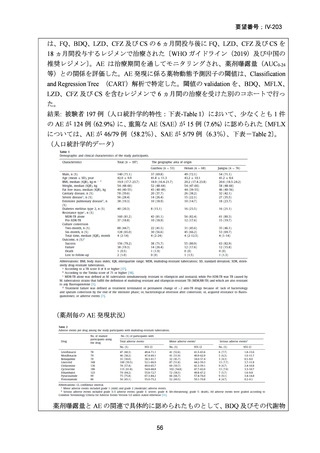
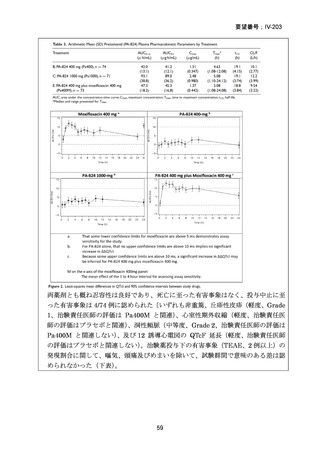
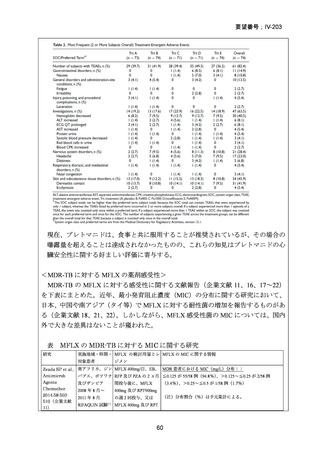
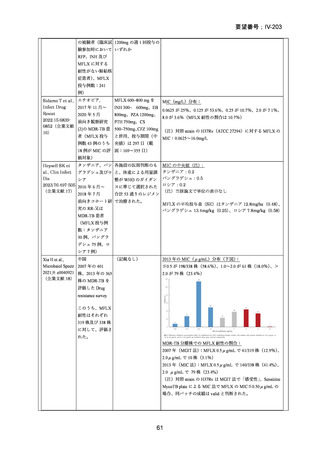
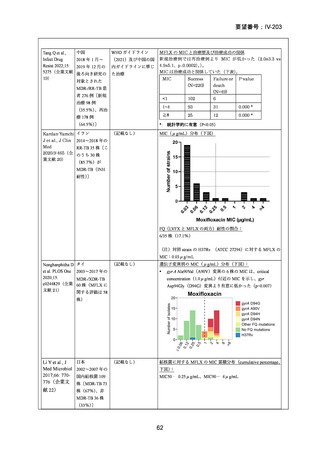
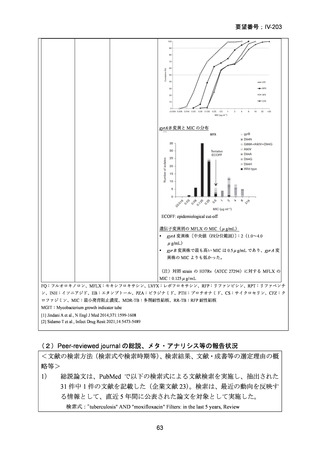
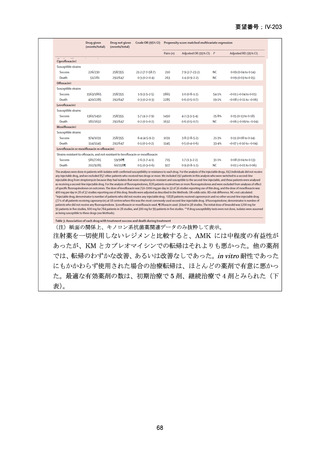
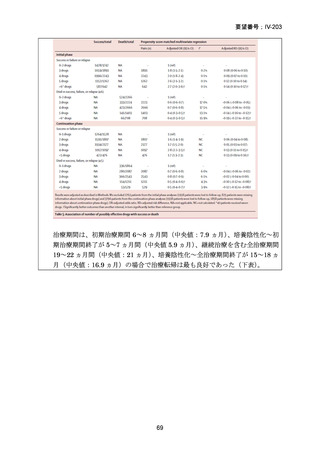
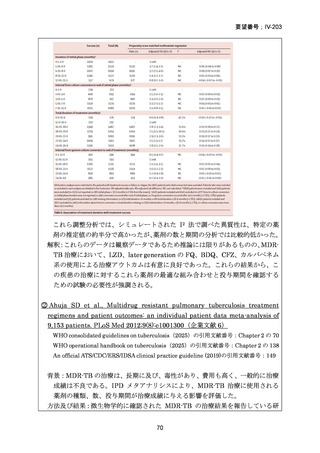
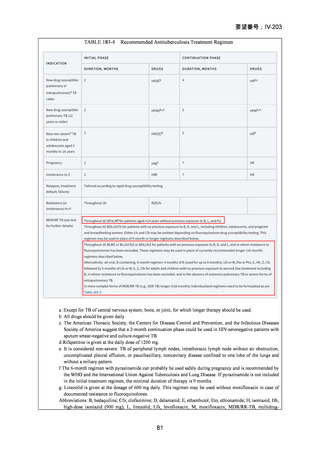
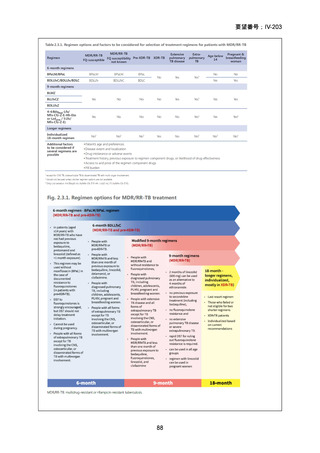
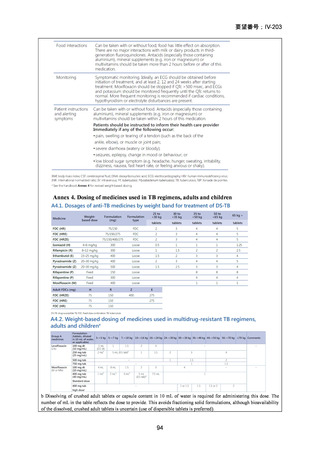
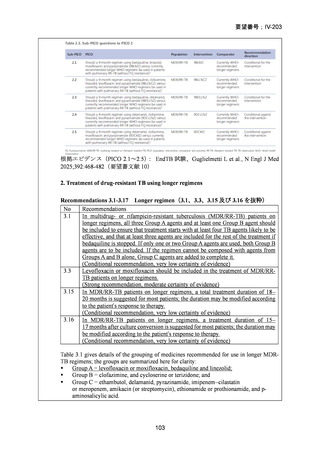
資料5-1 Ⅳ-203 モキシフロキサシン塩酸塩[15.1MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
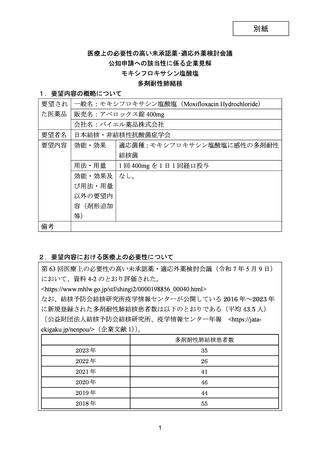
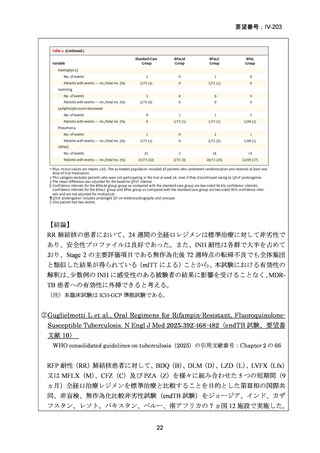
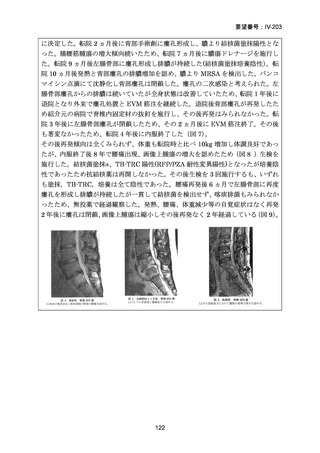
2017 年
52
2016 年
49
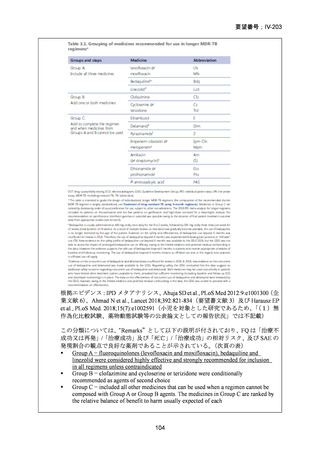
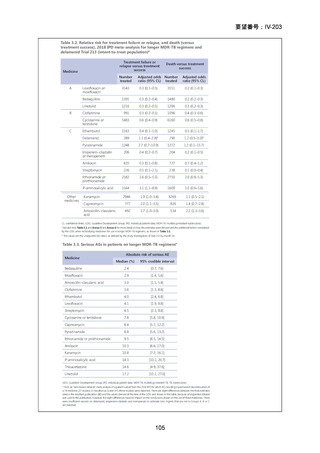
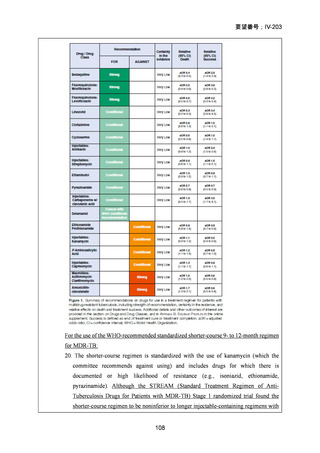
3.欧米等6カ国の承認状況等について
(1)
欧米等6カ国の承認状況及び開発状況の有無について
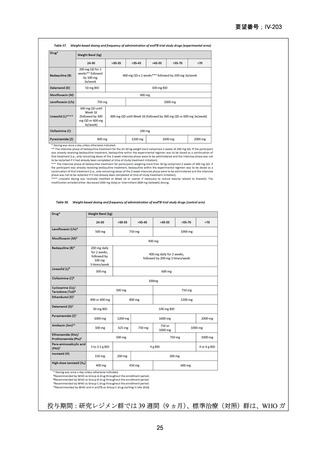
1)米国
効能・効果
用法・用量
承認年月(または
米国における開発
の有無)
備考
承認なし(調査年月日:2025 年 6 月 16 日)
承認されていない理由:バイエル社は、WHO 主導の臨床試験
を支援するため、治験薬として MFLX を無償提供したことは
あるが、自社では開発を行っていない。
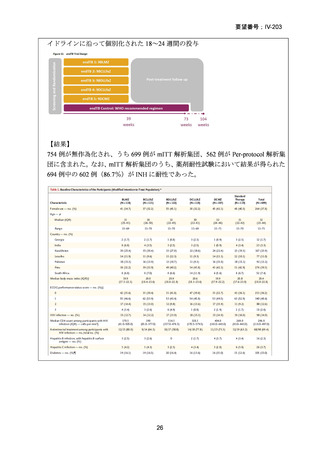
2)英国
効能・効果
用法・用量
承認年月(または
英国における開発
の有無)
備考
承認なし(調査年月日:2025 年 6 月 16 日)
承認されていない理由:バイエル社は、WHO 主導の臨床試験
を支援するため、治験薬として MFLX を無償提供したことは
あるが、自社では開発を行っていない。
3)独国
効能・効果
用法・用量
承認年月(または
独国における開発
の有無)
備考
承認なし(調査年月日:2025 年 6 月 16 日)
承認されていない理由:バイエル社は、WHO 主導の臨床試験
を支援するため、治験薬として MFLX を無償提供したことは
あるが、自社では開発を行っていない。
2