資料5-1 Ⅳ-203 モキシフロキサシン塩酸塩[15.1MB] (137 ページ)
出典
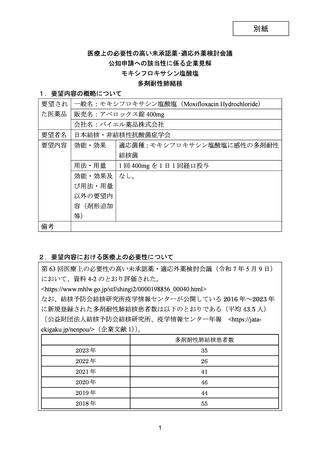
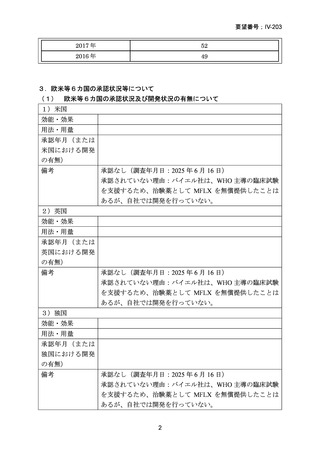
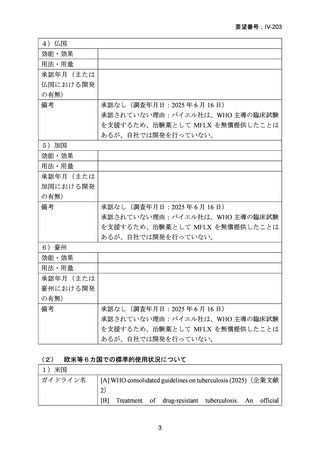
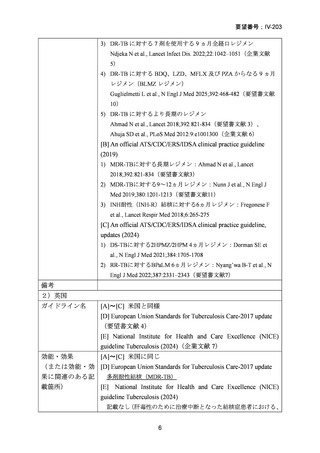
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
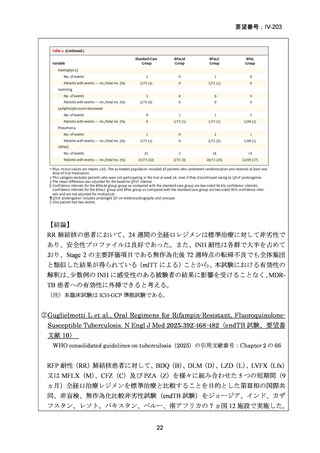
投与開始後 9 週間までは減量は適用されず、LZD は投与中止となり、BPaLM レジ
メンも中止となる。
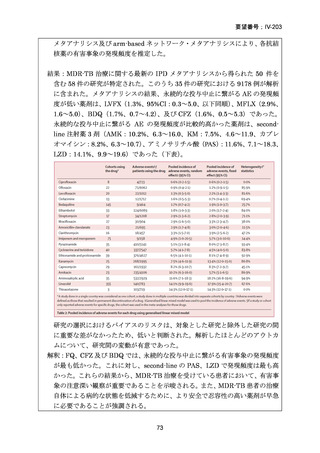
許容されるレジメンの中断期間
治療期間中、BDQ 及び/又はプレトマニドを中断する必要がある場合、BPaLM レ
ジメンの中断が「連続 14 日間」又は「連続ではないが累積して最大 4 週間」を超
えないようにする必要がある。7 日超のレジメン中断期間は、治療期間を延長して
補完する。よって、26 週間処方された服用は、この中断期間を補完して延長した場
合でも治療期間全体として 7 ヵ月で完了する必要がある。
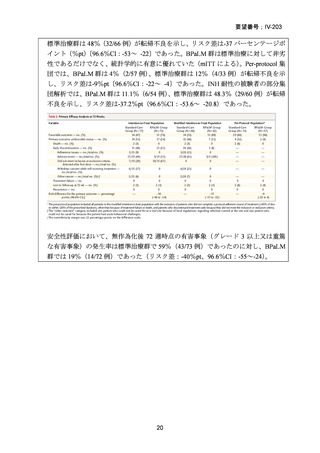
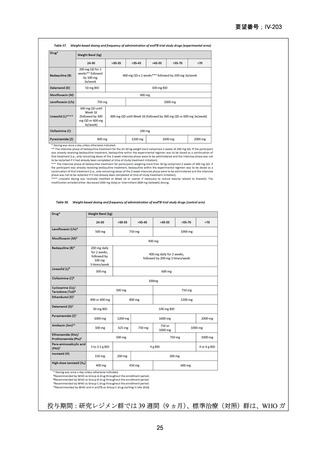
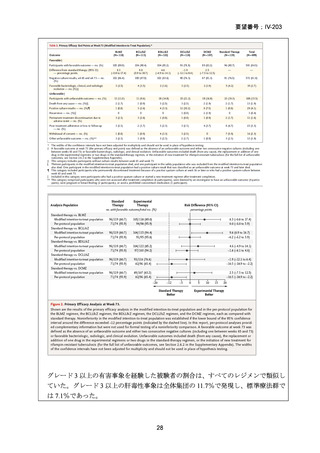
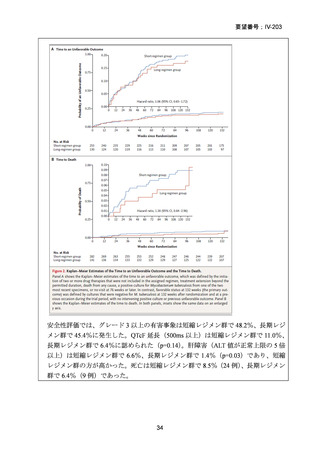
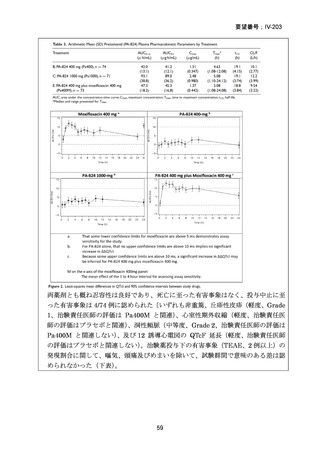
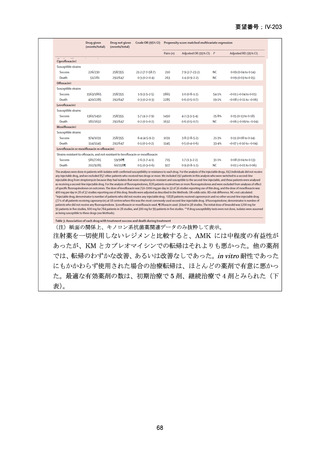
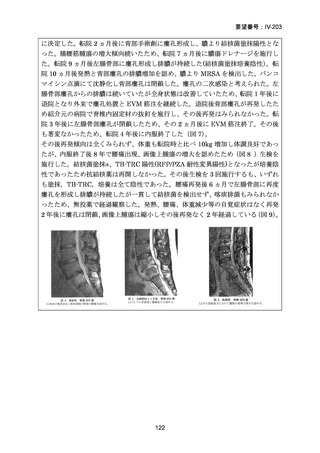
TB-PRACTECAL 試験における BPaLM レジメンの有効性
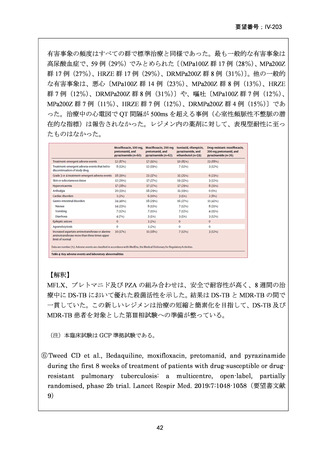
TB-PRACTECAL 試験 (Stage 2)では、ローカルで承認されている標準治療で、
可能な限り WHO ガイドラインで推奨される MDR-TB/超多剤耐性結核(XDR-TB)
の治療に沿うものを対照として標準治療群を設定した。有効性主要評価項目である
無作為化後 72 週時点の転帰不良(死亡、治療失敗、治療中止、追跡不能、結核再
発、治療の継続の複合指標)は、BPaLM 群で 11%(7/62 例)、標準治療群で 48%
(32/66 例)に認められ、リスク差は -37 パーセンテージポイント(%pt)〔96.6%
CI:-53~ -22〕であった。BPaLM 群は標準治療群に対して非劣性であるだけでな
く、統計的に有意に優れていた(mITT)。対照群であった標準治療(66 例)での処
方薬は日本でも抗結核薬の位置づけとして second-line 薬剤、MDR-TB 治療薬とさ
れている薬剤に含まれており、処方割合の高かった薬剤は、CFZ(97.0%)、MFLX
又は LVFX(95.5%)、LZD(77.3%)、PZA(77.3%)、BDQ(77.3%)であったこと
から、日本のガイドラインが推奨する MDR-TB 治療の処方薬と概ね一致している
と考えられた。
以上より、MFLX 及びプレトマニドが日本で承認され、MDR-TB 治療に処方可能
となれば、本試験で認められた BPaLM 群の標準治療群に対する非劣性及び統計的
に有意に優れていたという結果は、参照可能なものと考えられた。
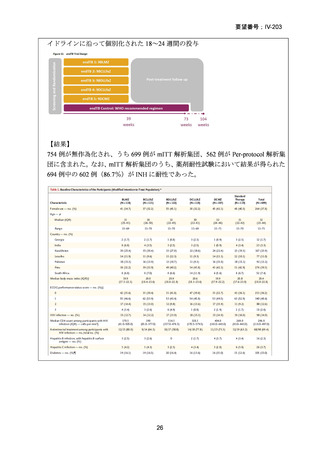
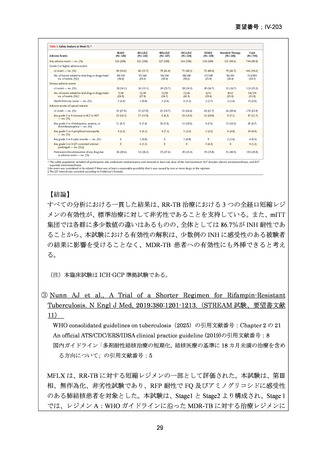
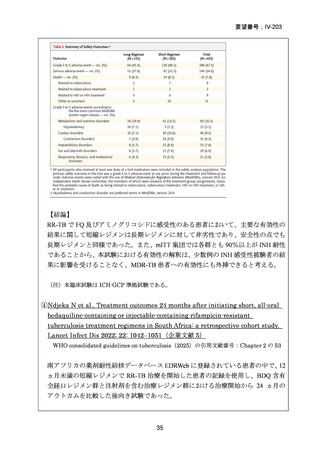
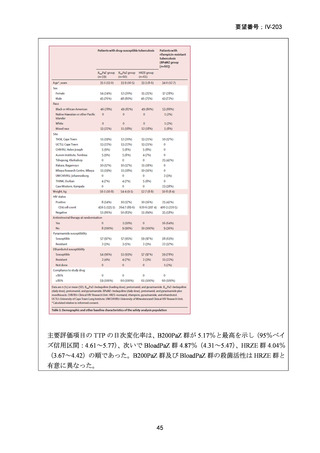
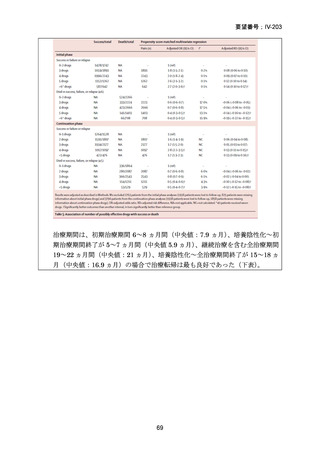
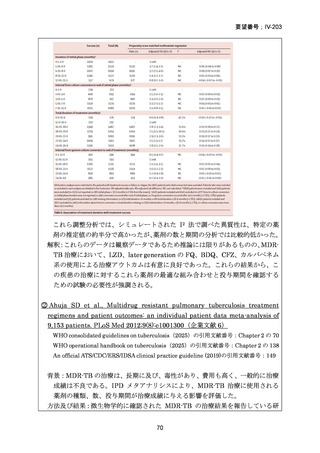
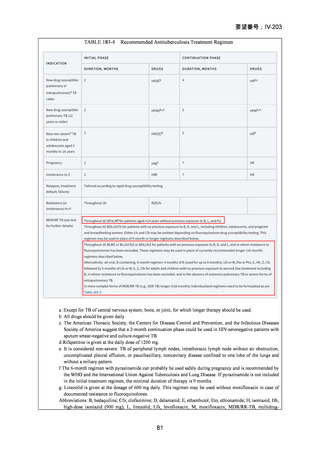
4.9 ヵ月修正全経口薬レジメン BLMZ(9 ヵ月 BLMZ レジメン)
WHO ガイドライン(2025)において、9 ヵ月修正全経口薬レジメンは、endTB 試
験の成績(要望書文献 10)を根拠に推奨されている。endTB 試験では、BCLLFfxZ、
BDLLfxZ、DCLLfxZ 及び DCMZ の各レジメンと共に、WHO ガイドラインに従っ
た地域の標準治療と比較され、BLMZ レジメンでは、標準治療に比べて高い治療成
功率(89.0% vs. 80.7%)等の成績が示されている。以下に、国内で想定される 9 ヵ
月 BLMZ レジメンの使用法と有効性成績の概要を示す。
9 ヵ月 BLMZ レジメン
BLMZ レジメンは、BDQ、LZD、MFLX 及び PZA から構成される。BLMZ では
構成される 4 剤を通常 9 ヵ月の全期間投与する。臨床反応が遅い場合には治療期間
の延長は推奨されておらず、他のレジメンへの切り替えとなる。
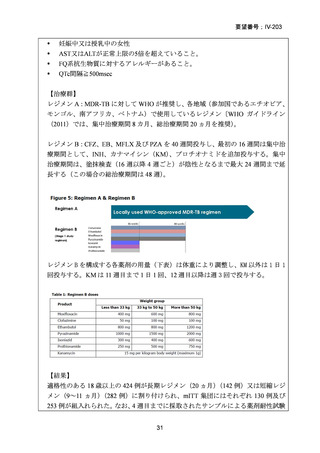
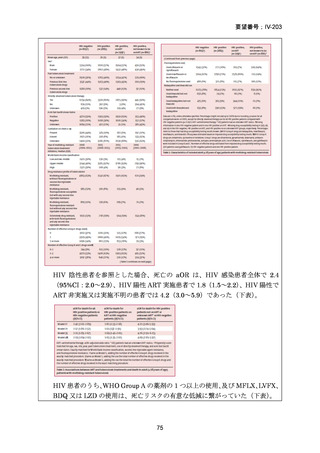
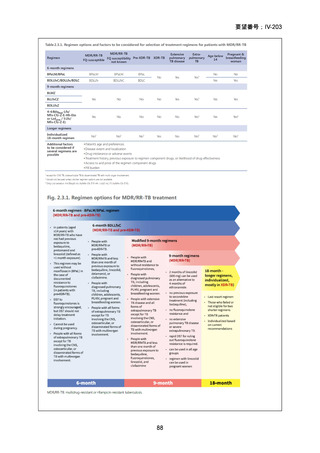
WHO ハンドブック(2025)における各構成薬剤の用法・用量を以下に示す。BDQ、
133