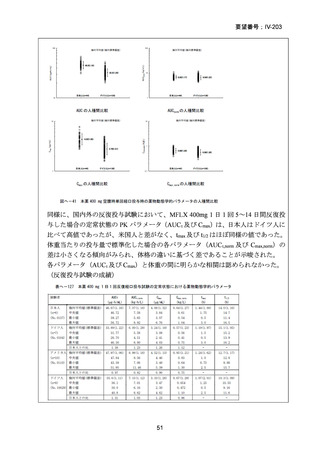
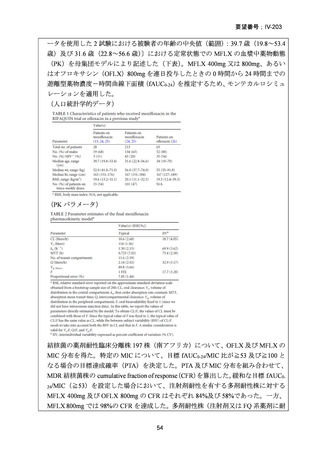
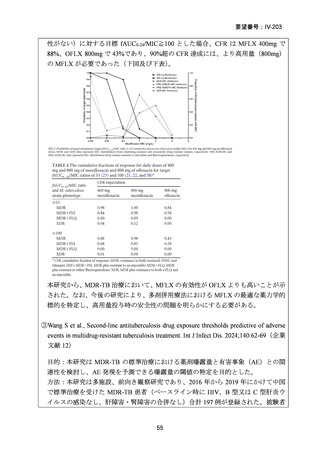
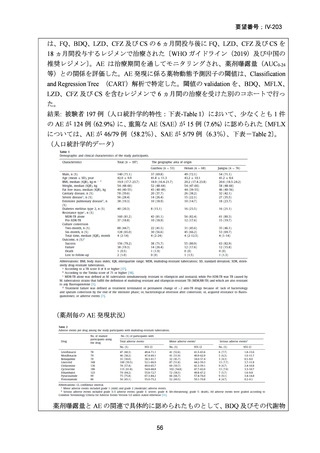
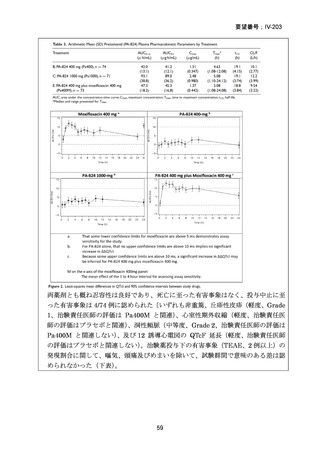
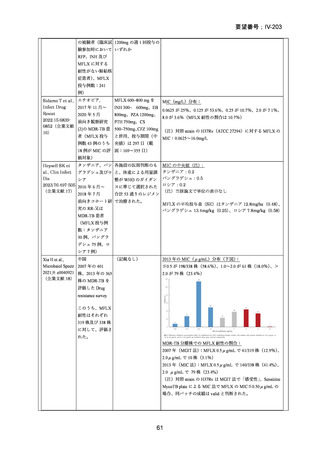
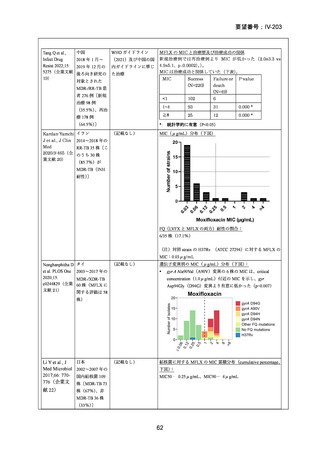
資料5-1 Ⅳ-203 モキシフロキサシン塩酸塩[15.1MB] (150 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添
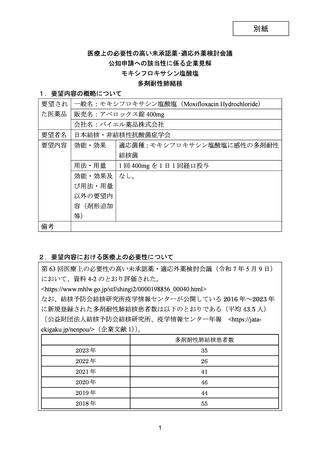
第 63 回医療上の必要性の高い未承認薬・適応外薬検討会議(令和 7 年 5 月 9 日)資料 4-2(抄)
要望番号
Ⅳ-202
要望された医薬品
要 望 者 名
日本結核・非結核性抗酸菌症学会
一
般
名
モキシフロキサシン塩酸塩
会
社
名
バイエル薬品株式会社
効能・効果
要 望 内 容
適応菌種:モキシフロキサシン塩酸塩に感性の多剤耐性結核菌
適応症:多剤耐性肺結核
用法・用量
1 回 400mg を 1 日 1 回経口投与
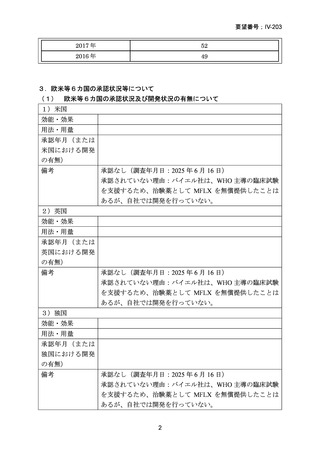
「 医療 上の 必要 性 (1)適応疾病の重篤性についての該当性
ア
に係る基準」への該 〔特記事項〕
当性に関する WG
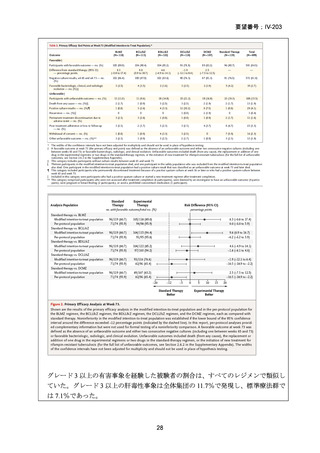
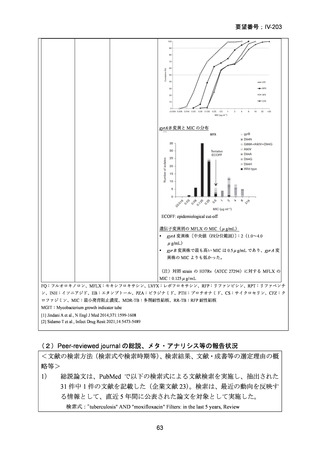
本要望は、モキシフロキサシン塩酸塩について、多剤耐性肺結核を適応症とする効能・効果の追加を要望するものである。イ
の評価
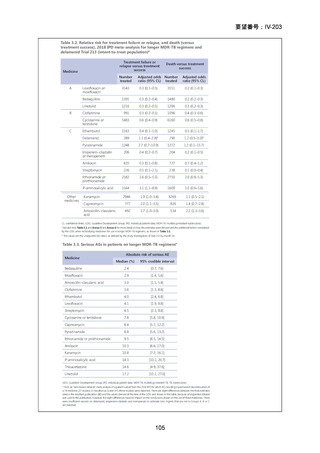
ソニアジド及びリファンピシンの両剤に耐性の多剤耐性結核患者は、2021 年に 50 例が新規登録され、そのうち 16%(8/50 例)
が 2023 年末までに死亡の転帰を辿っており4)、致死的な疾患である。したがって、
「ア:生命に重大な影響がある疾患(致死的
な疾患)」に該当すると判断した。
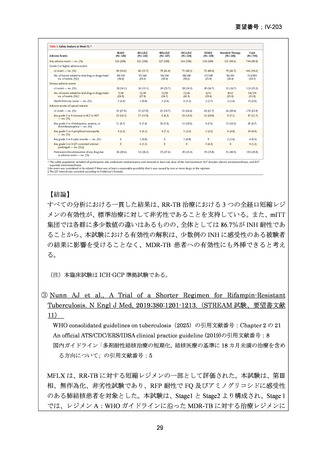
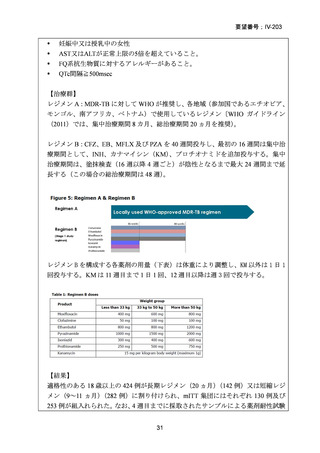
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
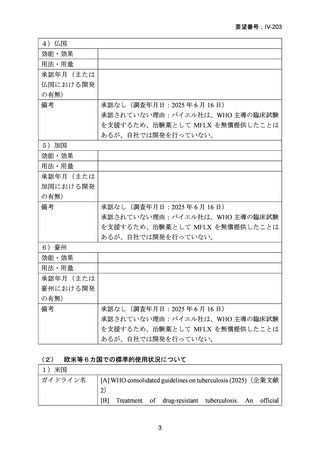
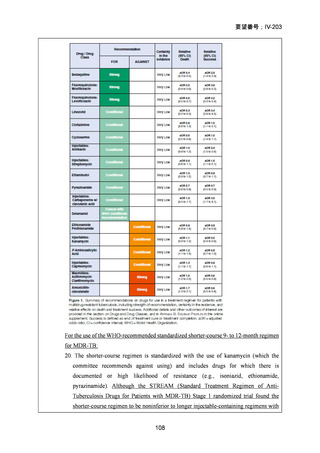
本邦における多剤耐性肺結核の標準的療法は、レボフロキサシン及びベダキリンを基本薬として、エタンブトール、ピラジナ
ミド、デラマニド又はサイクロセリンを追加する 5 剤併用療法とされ、治療期間は結核菌培養陰性後 18 カ月までとされている
5)
が、長期にわたる服薬は、副作用の増加、医療費の増加や服薬アドヒアランスの低下に繋がる。
モキシフロキサシン塩酸塩について、欧米等 6 カ国では、多剤耐性肺結核に係る効能・効果に対する承認はされていないもの
4)
5)
結核の統計 2024、公益財団法人結核予防会
「
「結核医療の基準」の一部改正について」(令和 3 年 10 月 18 日付け健感発 1018 第 1 号)
1