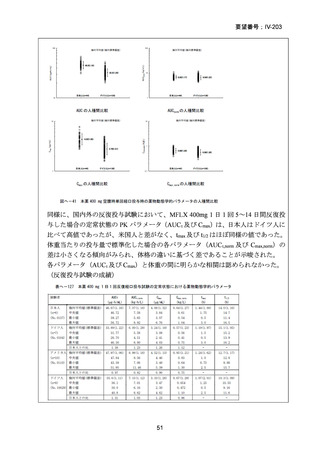
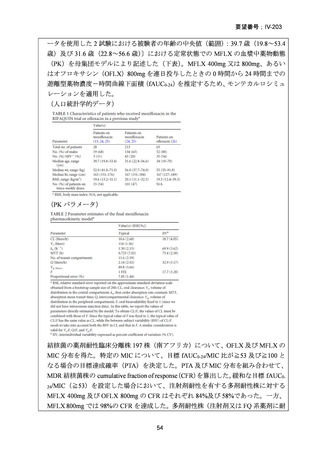
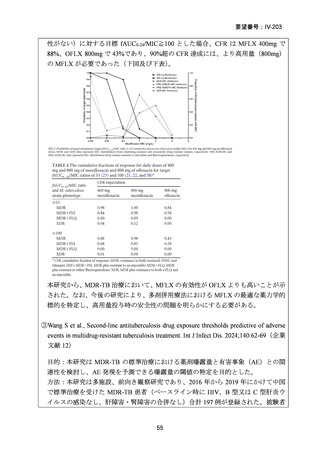
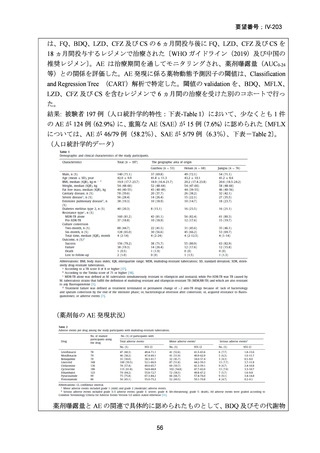
資料5-1 Ⅳ-203 モキシフロキサシン塩酸塩[15.1MB] (20 ページ)
出典
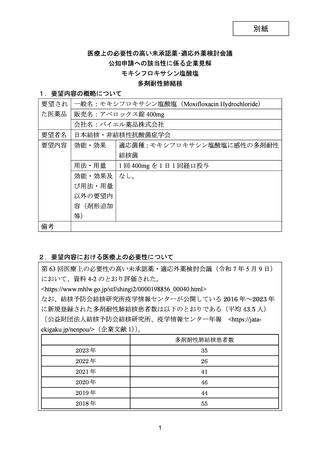
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
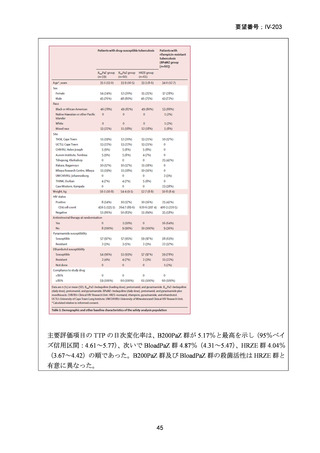
日(最大 1 日用量 400mg)であったことから、申請予定用法・用量の「1 回 400mg
を 1 日 1 回経口投与」を支持する知見と考えられる。
以下に、これらエビデンスの概要を示す。
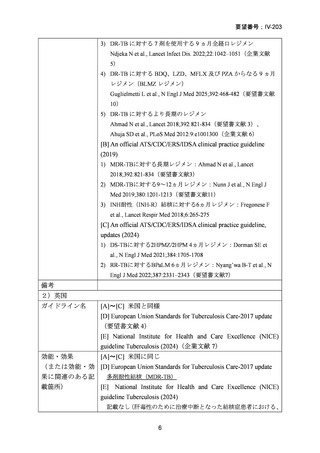
① Nyang’wa BT et al., A 24-week, all-oral regimen for rifampin-resistant
tuberculosis. N Engl J Med. 2022;387:2331-2343(TB-PRACTECAL 試験、要望
書文献 7)
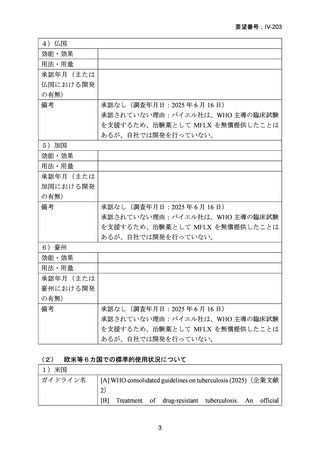
An official ATS/CDC/ERS/IDSA clinical practice guideline, updates (2024)の引用文献番号:
19
Australian recommendations for the Management of Drug-Resistant Tuberculosis, 2023
の引用文献番号:9
結核診療ガイドライン(2024)の引用文献番号:
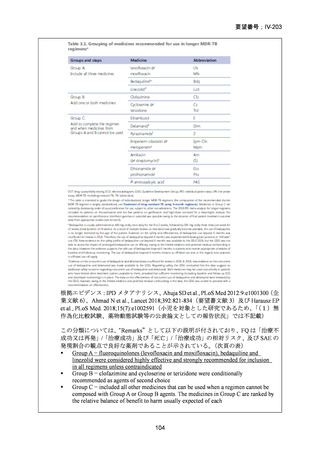
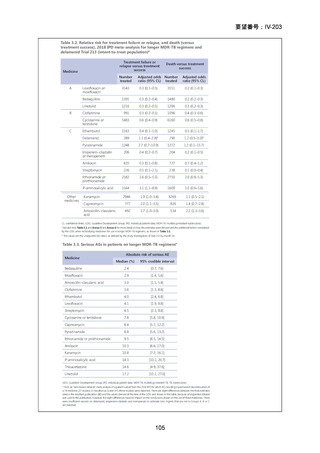
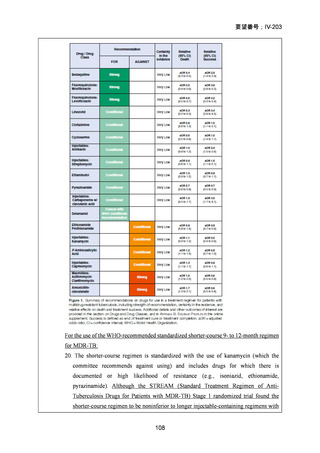
「総論 4 結核の治療」の 18 文献
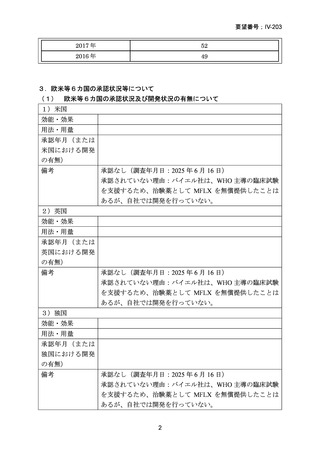
(注)WHO consolidated guidelines on tuberculosis(2025)では、推奨の根拠に TBPRACTECAL 試験のデータが記載されているが、引用文献として表示されていない。
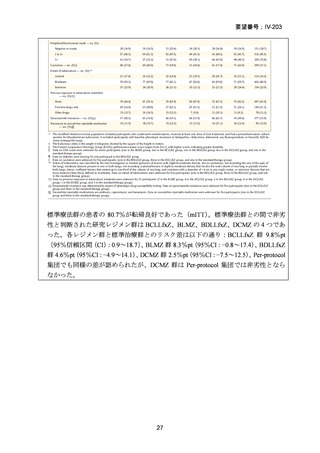
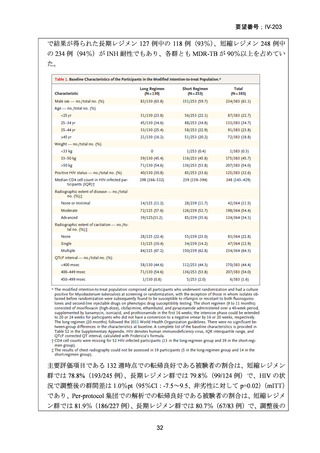
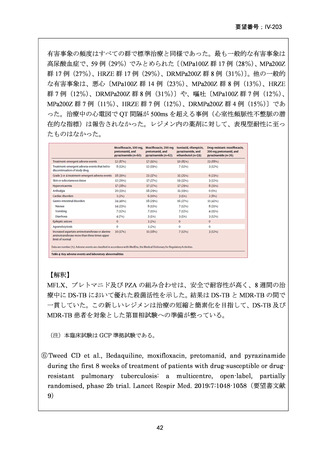
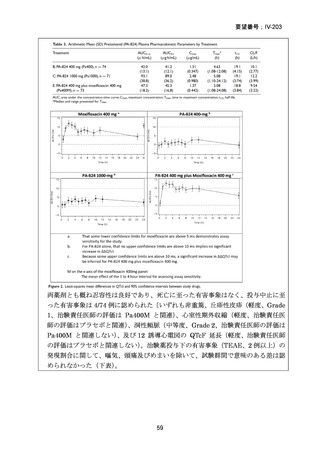
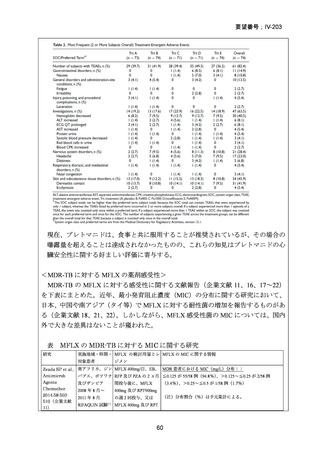
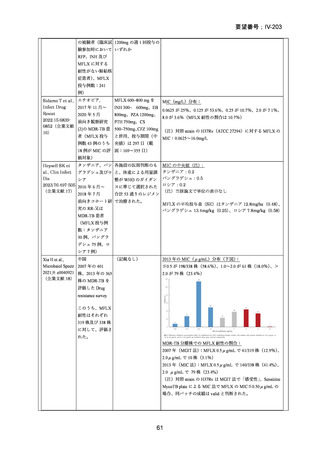
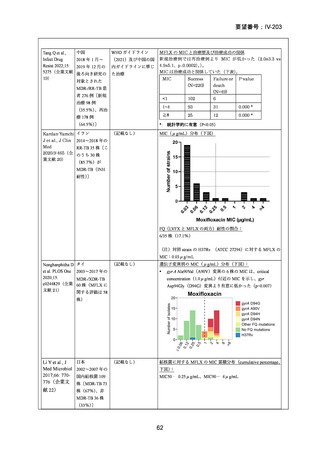
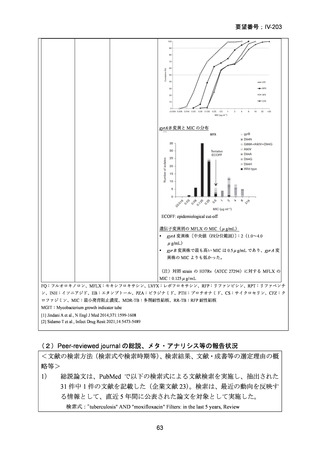
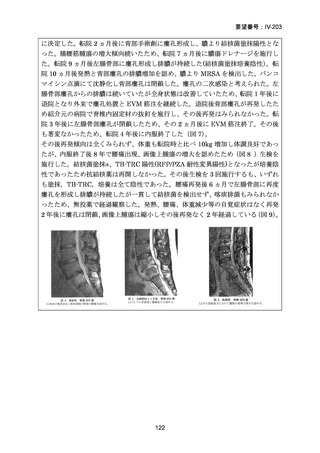
RFP 耐性(RR)肺結核に対する 3 つの短期間の全経口治療レジメンが評価された。
本試験は、RR 肺結核患者を対象とした第Ⅱ~Ⅲ相の多施設共同、無作為化比較、非
劣性試験であり、プラセボ対照ではなく、非盲検試験として実施された。
本試験は、ベラルーシ、南アフリカ、ウズベキスタンの 7 施設で行われた。
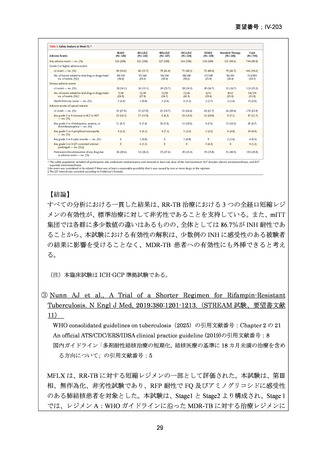
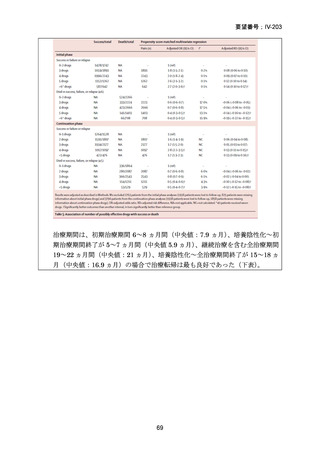
【試験デザインの概要】
本試験は、Stage 1(第Ⅱb 相に相当)及び Stage 2(第Ⅲ相に相当)より構成された。
Stage 1 では、適格とされた被験者を BDQ(B)、プレトマニド(Pa)を含む 3 つの
並行する研究レジメン群及び標準治療(SoC)コントロール群に、1:1:1:1(各群 60
例)で無作為割付けした。
Stage 1 の目的は、3 つの研究レジメン群による 8 週間投与の安全性及び有効性の結
果に基づき、このレジメンを更に検討すべきかを決定することであった。事前に定
義された安全性及び有効性の評価基準(培養陰性化を達成した被験者の割合が 40%
を超える及び/又は理由によらず治療中止又は死亡の被験者の割合が 45%未満)に
達したレジメンから、科学諮問委員会(SAC)が Stage 2 で評価するレジメン 2 つを
治験運営委員会(TSC)に推奨した。TSC は SAC 及びデータ安全性モニタリング委
員会(DSMB)と協議の上、Stage 2 で評価するレジメンを最終的に 1 つ選択した。
Stage 1 から Stage 2 に移行した研究レジメン群の被験者は、長期安全性、忍容性及
び有効性の評価対象となった。
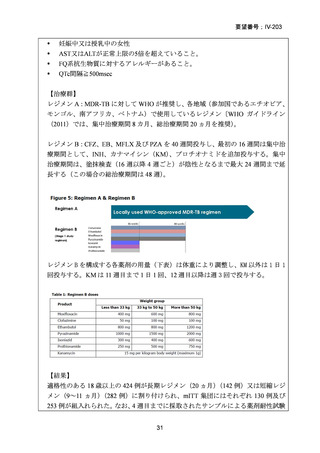
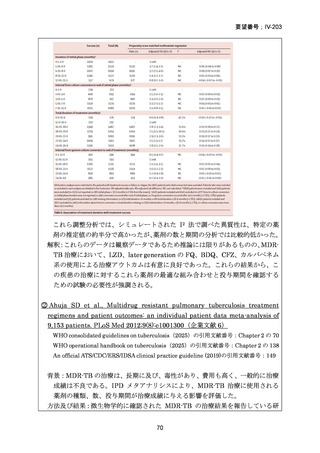
Stage 2 では、Stage 1 で選択された研究レジメン群と SoC 群との間で、主要評価項
目を 72 週時点における転帰不良(死亡、治療失敗、治療中止、追跡不能、結核再発
の複合指標)に達した被験者の割合として比較した。また、副次評価項目には安全
16