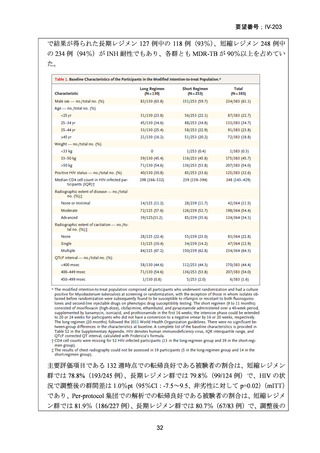
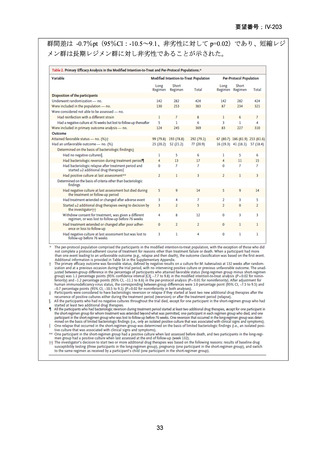
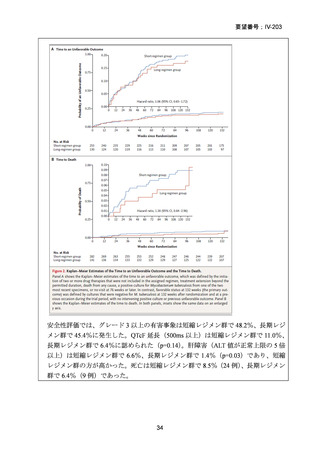
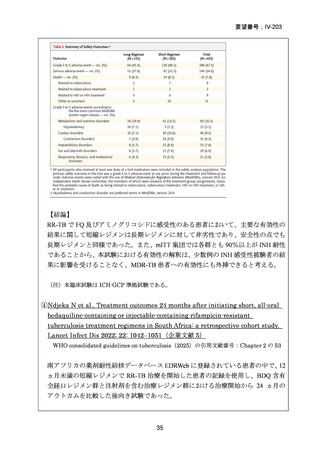
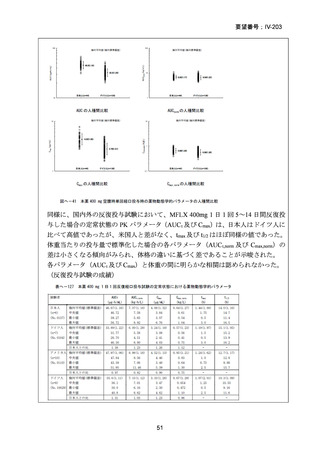
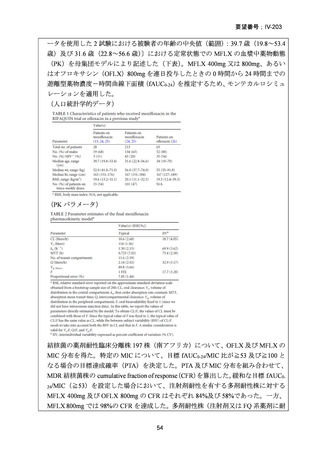
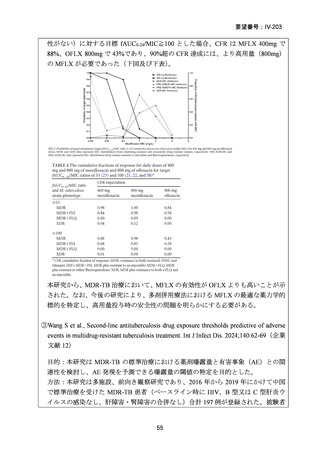
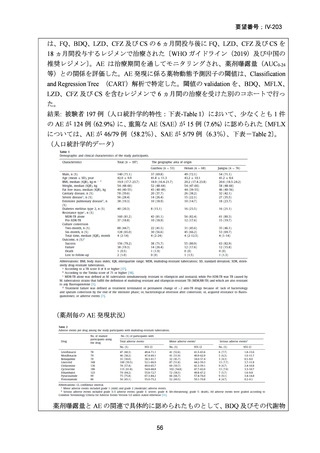
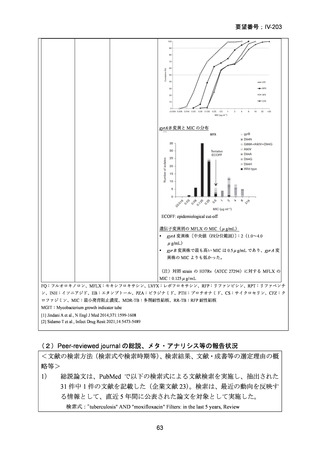
資料5-1 Ⅳ-203 モキシフロキサシン塩酸塩[15.1MB] (11 ページ)
出典
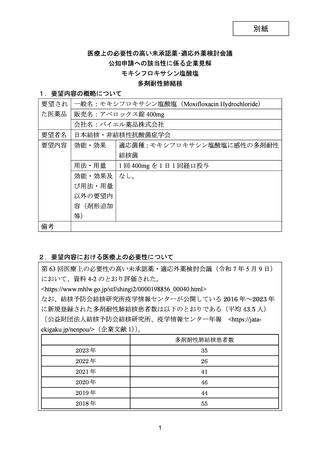
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
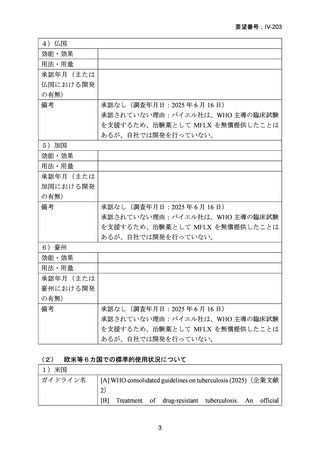
肝臓専門医の監視下での治療継続の選択肢としての記載がある。
適応外使用であり、処方医の責任に基づく処方判断、患者の同意
取得が必要とされている)
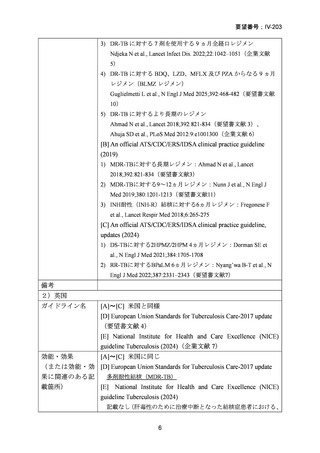
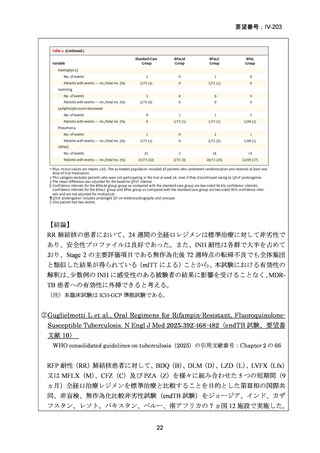
用法・用量
[A]~[C] 米国に同じ
(または用法・用 [D] European Union Standards for Tuberculosis Care-2017 update
量に関連のある記 欧州のガイドライン(2017)では、以下の 2 レジメンが紹介されて
載箇所)
いるが、MFLX の用法・用量に関する記載はない。
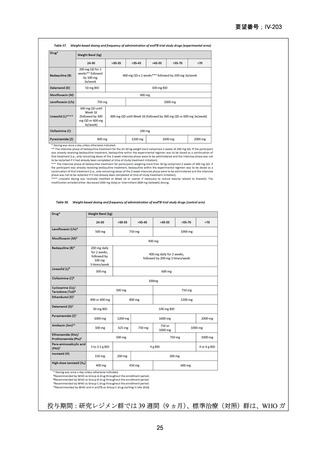
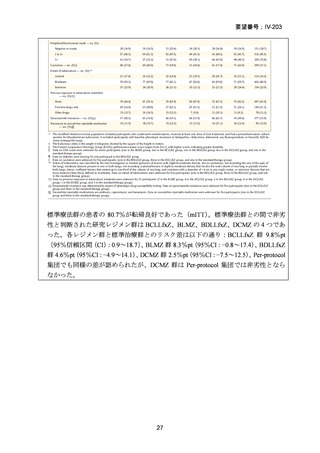
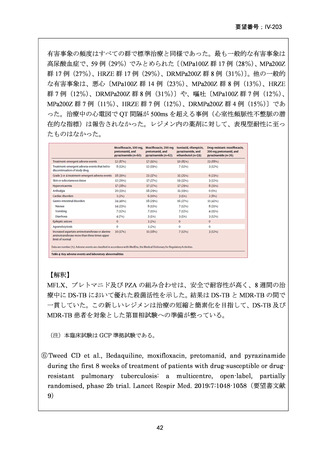
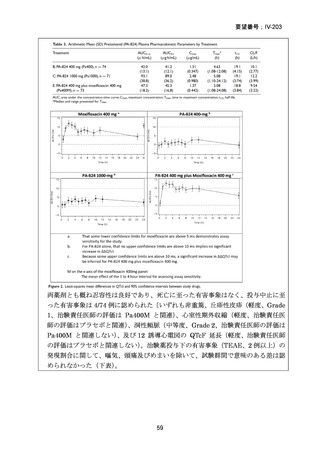
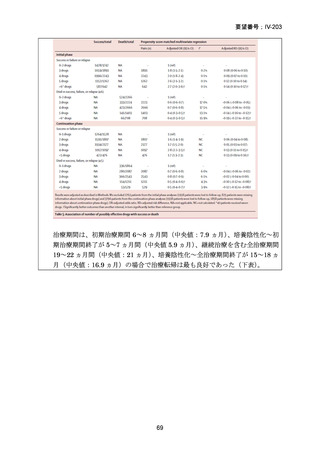
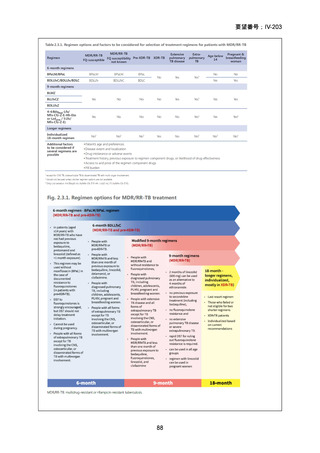
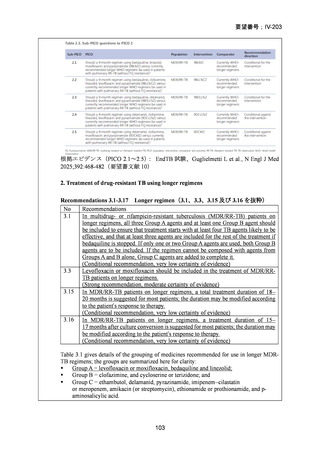
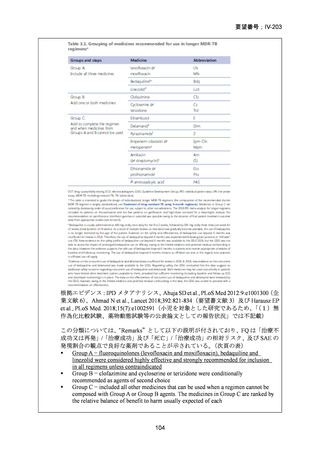
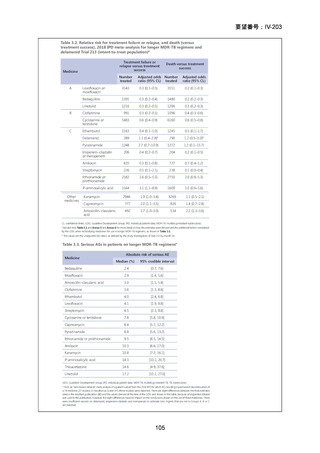
1) 症例ごとの20~24ヵ月レジメン(5剤併用療法)
:
PZA と表の A から 1 剤、B から 1 剤、C から 2 剤。これで
5 剤にできなければ D から選択(MFLX は A に分類)
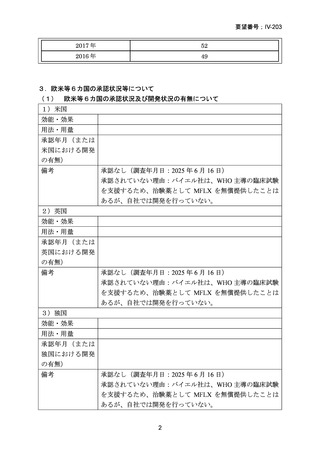
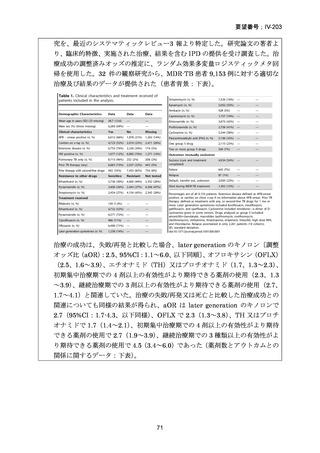
なお、MDR-TB に対する薬剤選択優先順位分類は、2018 年に
WHO から発出された important rapid communication document,
“Key changes to treatment of multidrug- and rifampicin-resistant
tuberculosis”に準じて、下表に変更されている(Migliori GB et
al., Eur Respir J 2018; 52: 1801617、企業文献 8)
。WHO ガイドラ
イン(2025)の優先順位分類とも同じである。
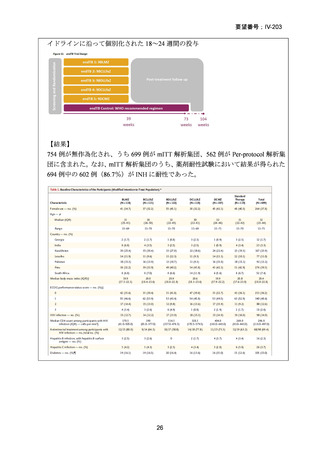
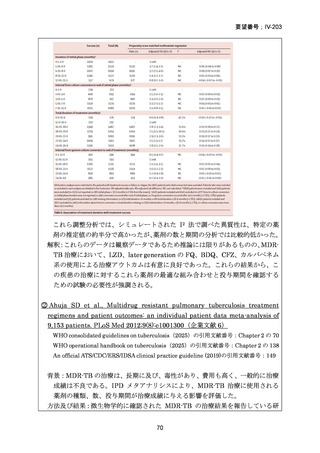
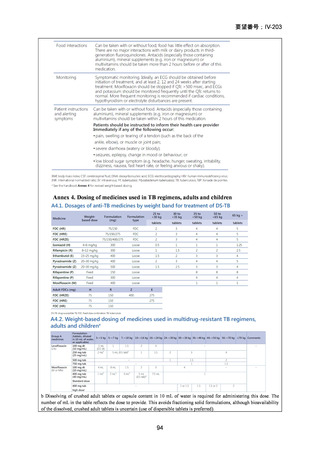
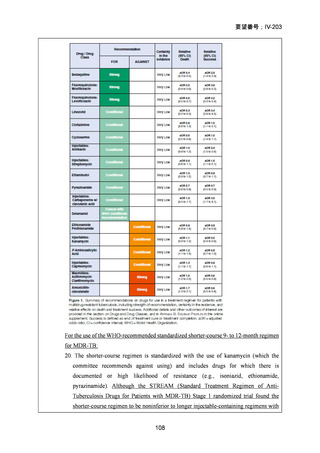
2) WHO(2016)の推奨する9~12ヵ月短縮レジメン
欧州のガイドライン(要望書文献 4)で参照されている WHO ガ
イドライン(2016、Falzon D et al., Eur Respir J 2017; 49: 1602308)
7