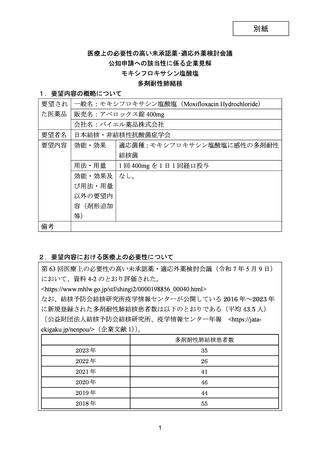
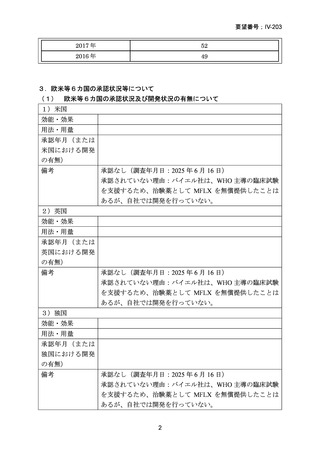
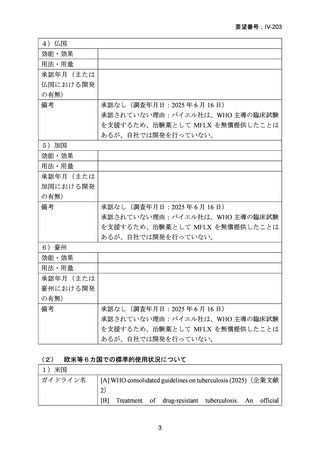
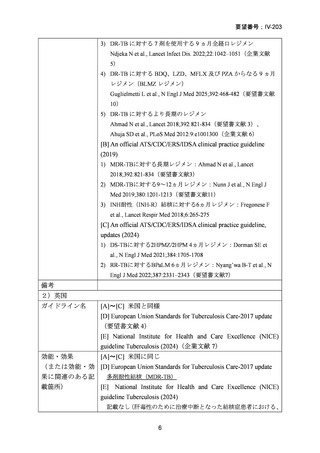
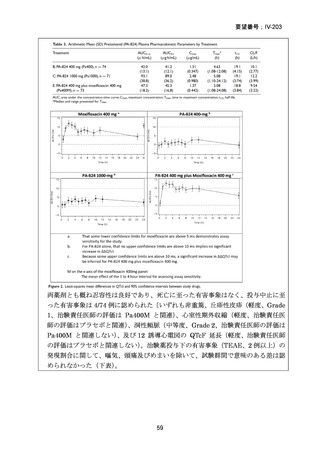
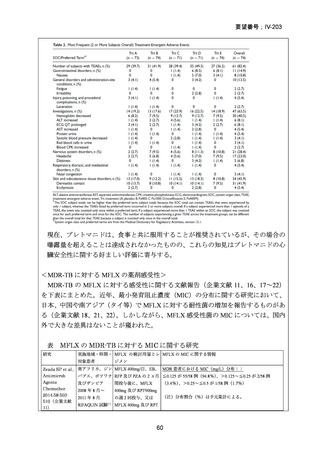
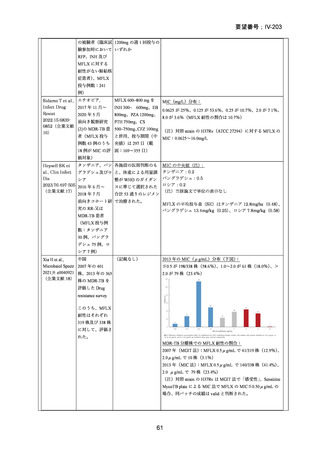
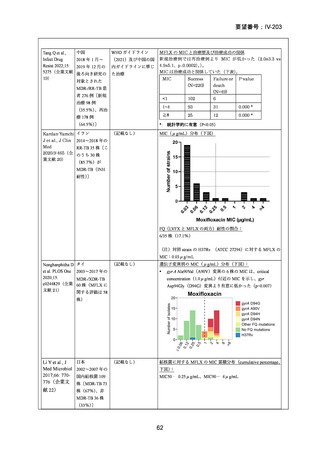
資料5-1 Ⅳ-203 モキシフロキサシン塩酸塩[15.1MB] (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
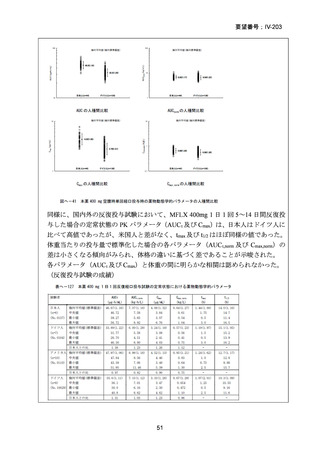
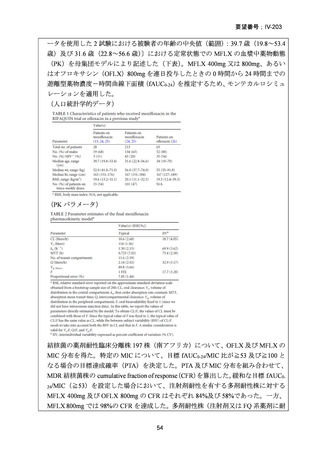
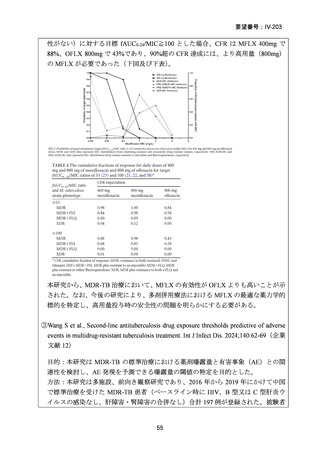
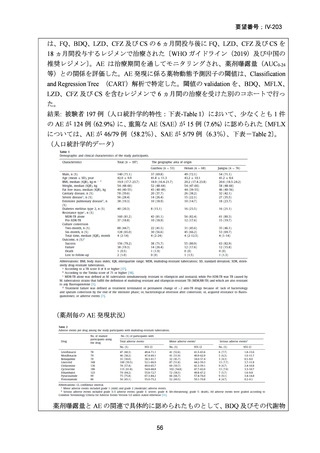
医との議論を経て実施されるべき」との勧告を行っている。
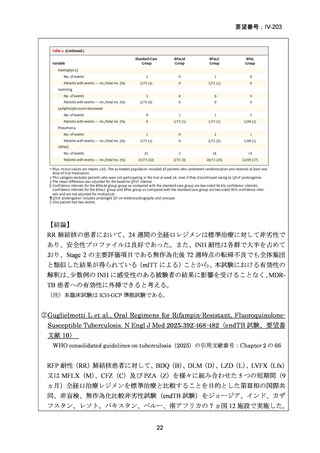
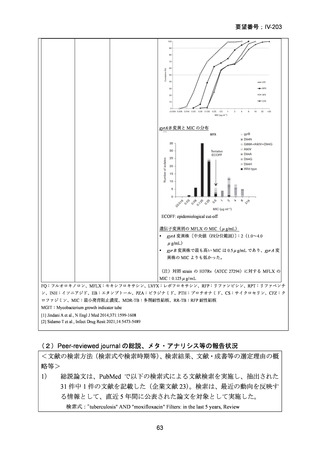
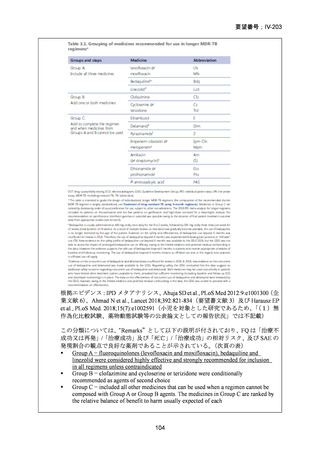
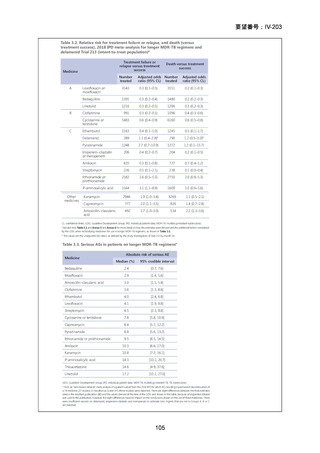
(注 2)INH のみに抵抗性の結核に対する 6 ヵ月レジメンにおいて RFP、
EB 及び PZA と併用する FQ としては、LVFX が好ましいとされている。
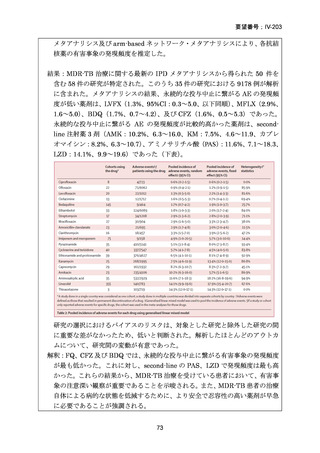
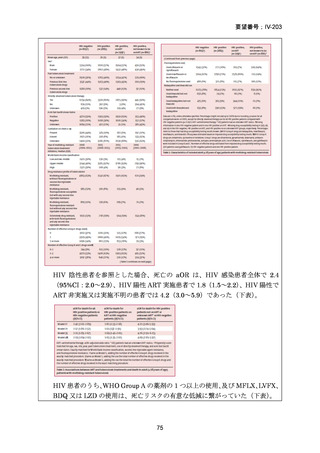
用法・用量
[A] 米国と同じ
(または用法・用 [B] Australian recommendations for the Management of Drug量に関連のある記 Resistant Tuberculosis, 2023
載箇所)
成人:400mg/日(高用量として 600~800mg)
小児:10~15mg/㎏/日
ガイドラインの根 [A] 米国と同じ
[B] Australian recommendations for the Management of Drug-
拠論文
Resistant Tuberculosis, 2023
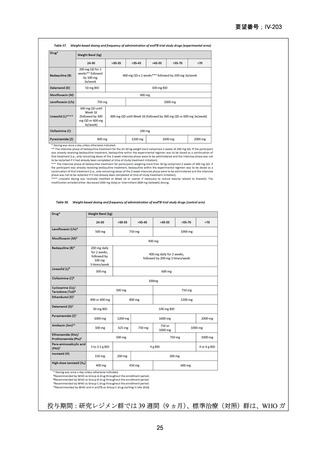
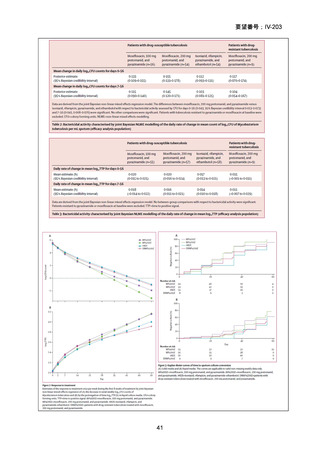
1) BPaLM 6 ヵ月レジメン:
Nyang’wa B-T et al., N Engl J Med 2022;387:2331–2343(要望書
文献7)
他のレジメンについては、以下の WHO ガイドライン等が参照され
ている。
World Health Organization. WHO Operational Handbook on
Tuberculosis. 2022 update. Module 4: treatment - drug-resistant
tuberculosis treatment. Geneva, Switzerland.
備考
4.要望内容について企業側で実施した海外臨床試験成績について
結核治療に関して、企業側で実施したモキシフロキサシン(MFLX)の臨床試験
は、国内外を通じてなく、本項に記載すべき臨床試験成績はない。これまで、
“Global
Alliance for TB Drug Development”等の公的機関が主導した臨床試験への治験薬供与
を行うなど協力は行っており、関連する臨床試験の成績は「5.要望内容に係る国
内外の公表文献・成書等について、
(1)無作為化比較試験、薬物動態試験等の公表
論文としての報告状況」の項に記載する。
5.要望内容に係る国内外の公表文献・成書等について
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
<文献の検索方法(検索式や検索時期等)、検索結果、文献・成書等の選定理由の概略
等>
1)
臨床試験は、PubMed で以下の検索式による文献検索を実施し、抽出された 38
件中 5 件は要望書文献 7~11 であった。
11