資料5-1 Ⅳ-203 モキシフロキサシン塩酸塩[15.1MB] (26 ページ)
出典
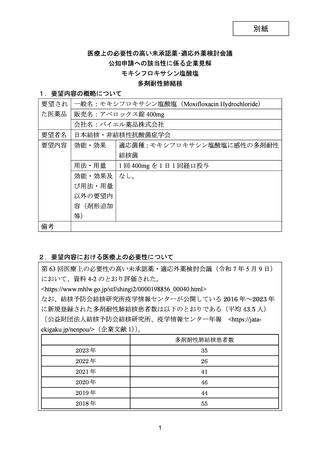
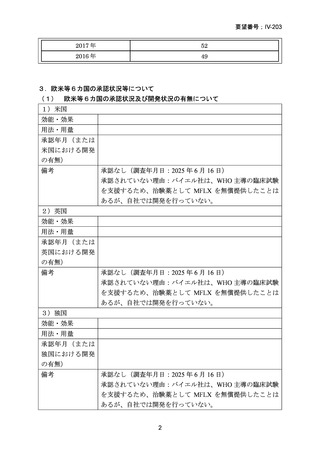
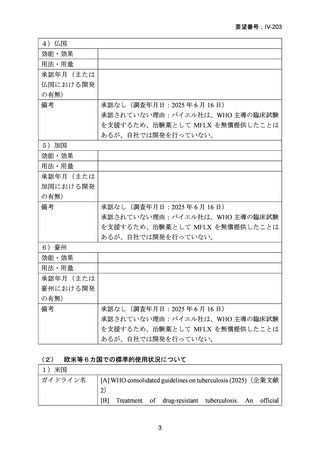
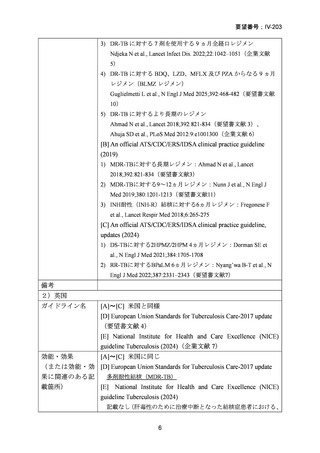
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
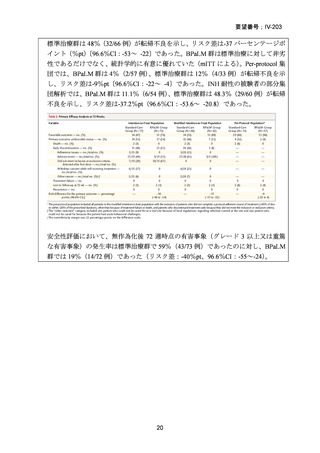
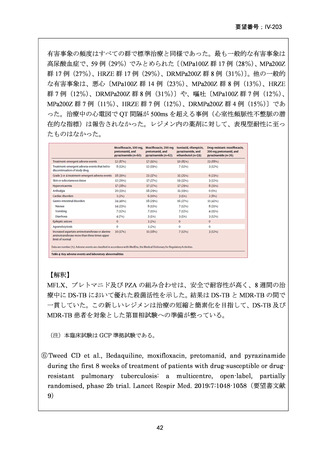
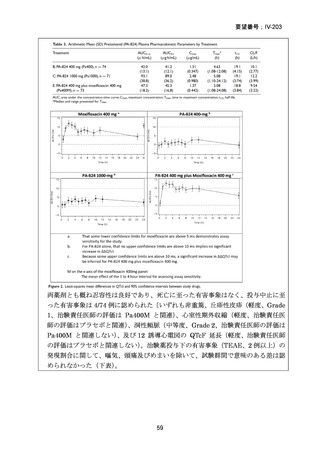
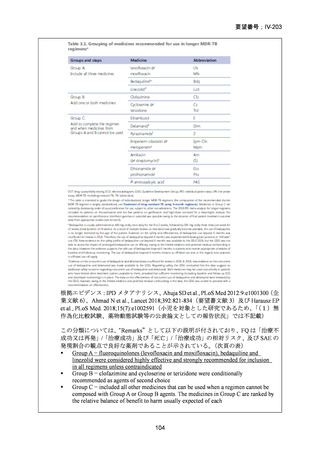
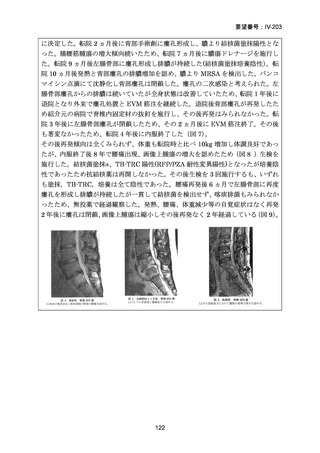
【結論】
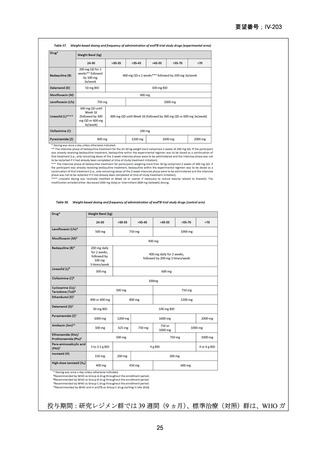
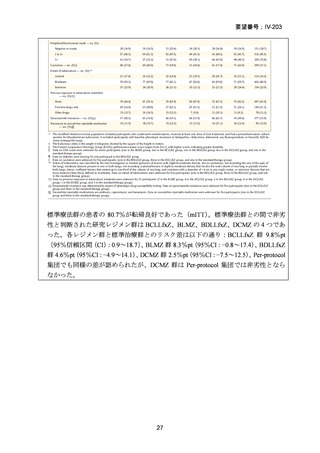
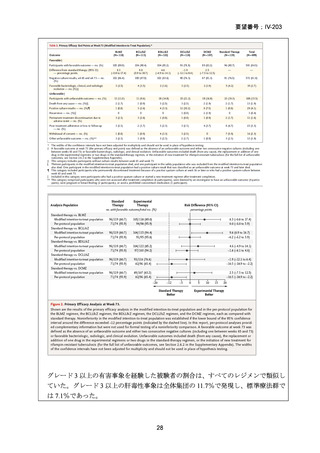
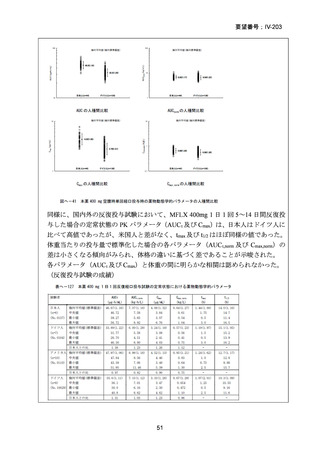
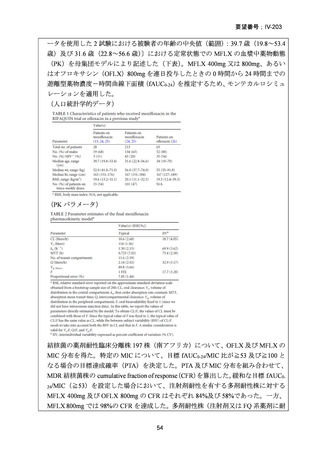
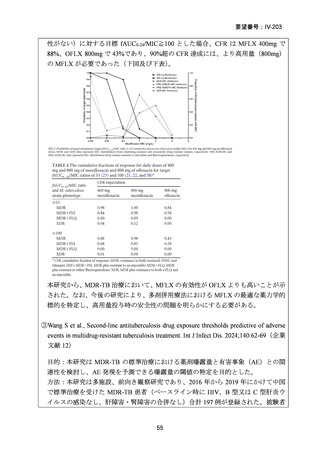
RR 肺結核の患者において、24 週間の全経口レジメンは標準治療に対して非劣性で
あり、安全性プロファイルは良好であった。また、INH 耐性は各群で大半を占めて
おり、Stage 2 の主要評価項目である無作為化後 72 週時点の転帰不良でも全体集団
と類似した結果が得られている(mITT による)ことから、本試験における有効性の
解釈は、少数例の INH に感受性のある被験者の結果に影響を受けることなく、MDRTB 患者への有効性に外挿できると考える。
(注)本臨床試験は ICH-GCP 準拠試験である。
②Guglielmetti L et al., Oral Regimens for Rifampin-Resistant, FluoroquinoloneSusceptible Tuberculosis. N Engl J Med 2025;392:468-482(endTB 試験、要望書
文献 10)
WHO consolidated guidelines on tuberculosis(2025)の引用文献番号:Chapter 2 の 66
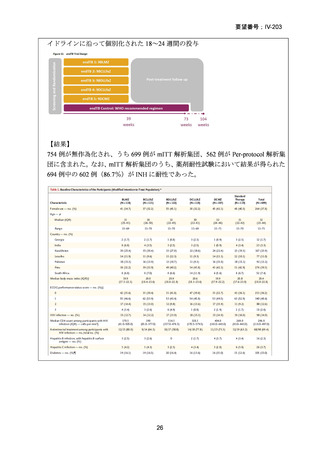
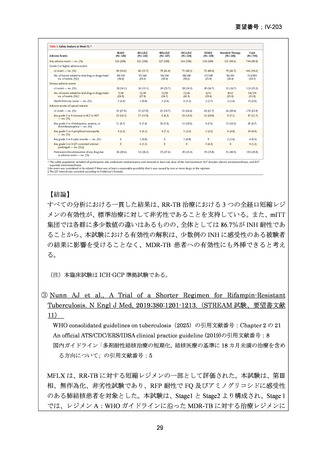
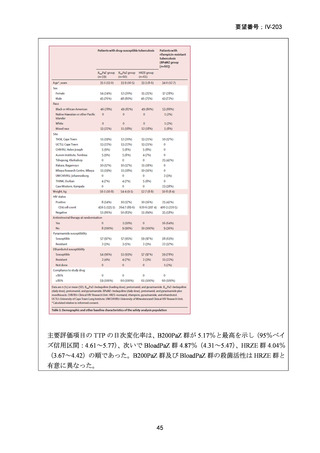
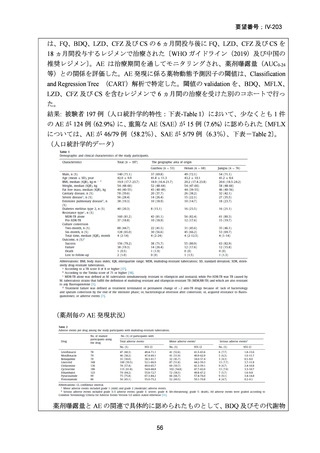
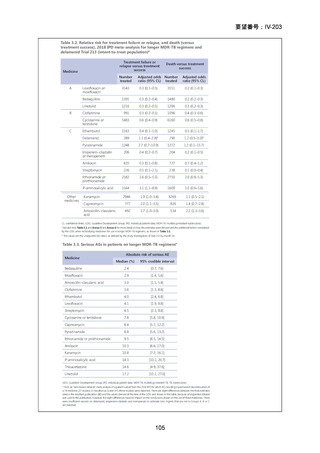
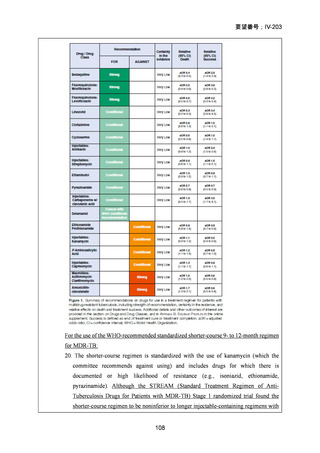
RFP 耐性(RR)肺結核患者に対して、BDQ(B)、DLM(D)、LZD(L)、LVFX(Lfx)
又は MFLX(M)、CFZ(C)及び PZA(Z)を様々に組み合わせた 5 つの短期間(9
ヵ月)全経口治療レジメンを標準治療と比較することを目的とした第Ⅲ相の国際共
同、非盲検、無作為化比較非劣性試験(endTB 試験)をジョージア、インド、カザ
フスタン、レソト、パキスタン、ペルー、南アフリカの 7 ヵ国 12 施設で実施した。
22