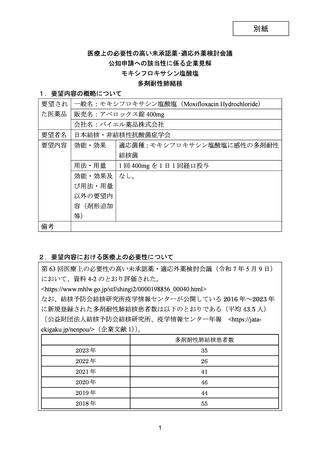
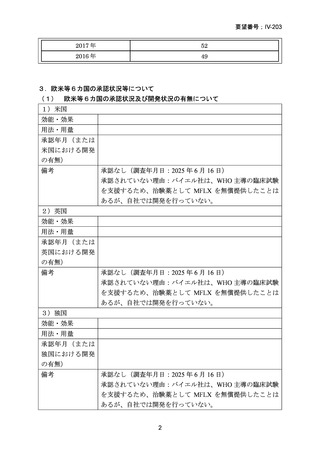
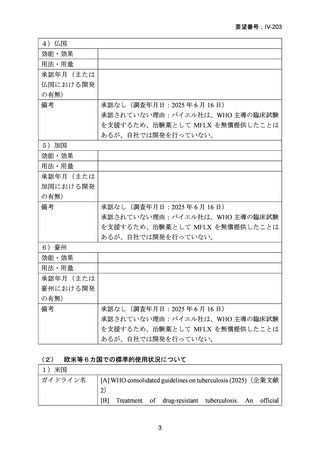
資料5-1 Ⅳ-203 モキシフロキサシン塩酸塩[15.1MB] (140 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
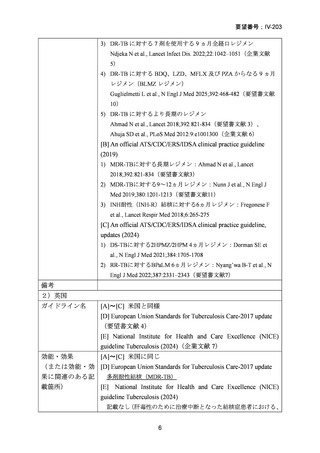
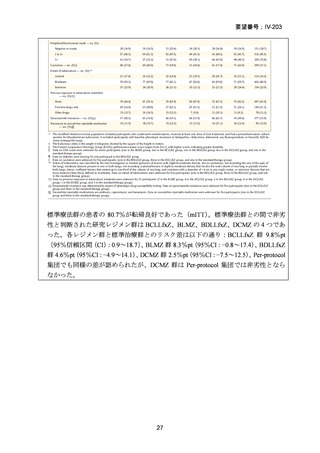
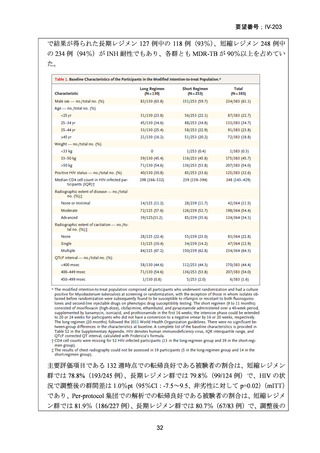
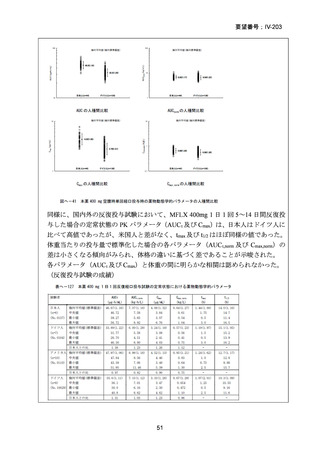
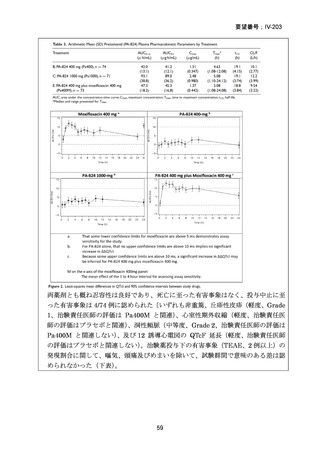
対する非劣性という結果は、日本においても参照可能なものと考えられた。
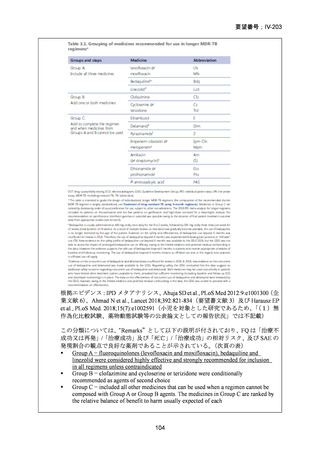
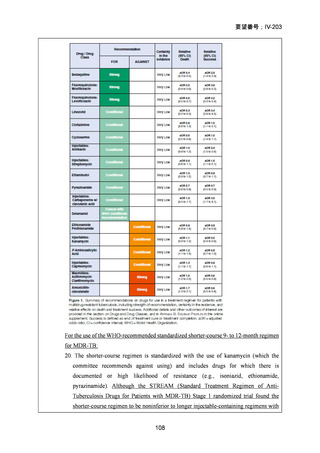
なお、WHO ガイドライン(2025)では、endTB 試験で比較された他の 2 つの BDQ
を含む 9 ヵ月レジメン(BLLfxCZ、BDLLfxCZ)と BMLZ レジメンを合わせて「9
ヵ月修正全経口薬レジメン」と称しているが、この中で、複数の要件(治療に要す
るリソース、健康の公平性、受容性、DLM へのアクセスを含む)で追加評価した結
果、BLMZ レジメンは全般的な健康面の効果(net health effect)から最優先のレジメ
ンとして推奨されている。
以上が、国内外の MDR-TB 治療で MFLX を使用するレジメンに関するガイドラ
インの推奨状況と根拠エビデンスの要約であるが、日本人の結核症患者に対して
MFLX が使用されたデータは限られる。しかしながら、
「2.要望内容における医療
上の必要性について」に記載したように多剤耐性肺結核症の国内新規登録患者数は
年間 50 人弱と極めて少数であり、国外の成書及び WHO ガイドラインでの推奨レ
ジメンについて、国内で日本人を対象とし、検証的な試験を実施することは極めて
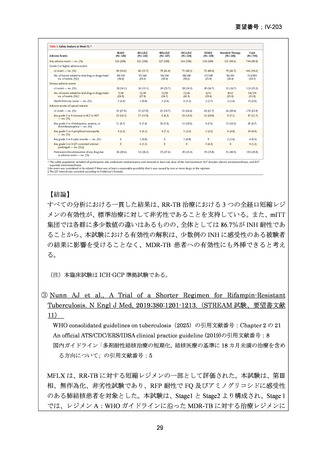
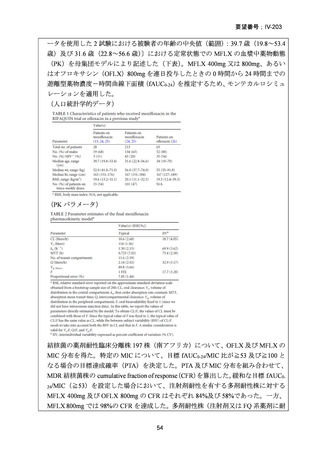
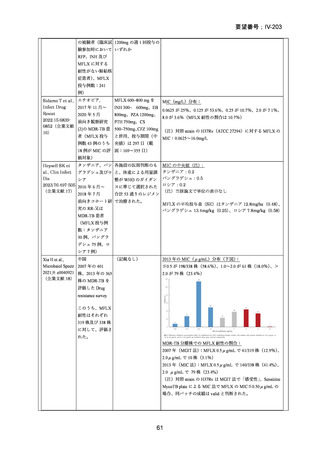
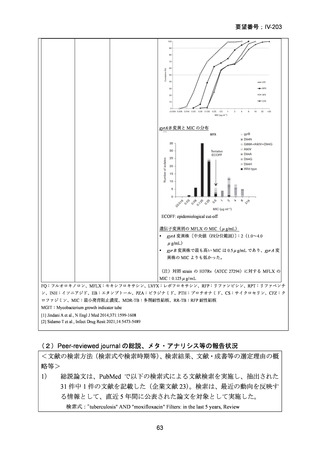
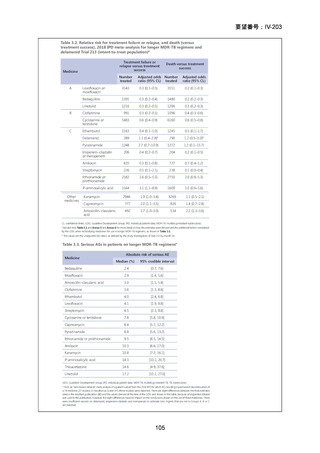
困難である。国内の臨床で分離された結核菌(全体の 67%が多剤耐性結核菌)に対
する本薬の感受性(MIC50:0.25μg/mL、MIC90:4μg/mL、いずれも推定値、企業文
献 22)は国外の臨床で分離された多剤耐性結核菌に対する本薬の感受性(MIC50:
0.5μg/mL、MIC90:2μg/mL、2005 年 10 月 11 日承認
申請資料概要
ホ.薬理作
用に関する資料)と類似しており、近年の MDR-TB の MFLX 感受性に関する研究
においても、MFLX 感受性菌の MIC は上記の値と比較して、また国内外で大きな
違いがないことが窺われる(「5.
(1)無作為化比較試験、薬物動態試験等の公表
論文としての報告状況」、60~63 頁)。また、本薬の薬物動態に関して、臨床上問題
となる民族差は認めらなかった(2005 年 10 月 11 日承認
申請資料概要
へ.吸
収、分布,代謝,排泄に関する資料)ことから、日本人患者においても本薬の有効
性が期待できると考えられる。国外の成書及びガイドラインの推奨レジメンは、ア
ジア(日本以外)を含む国際共同、前向き無作為化比較、後ろ向き観察等の試験で
得られたエビデンスを分析した上で推奨に至っていることを考慮すると、日本人に
MFLX を含む多剤併用レジメンで治療した場合の有効性は期待でき、公知申請によ
り早期に承認されることが望まれる。
【多剤耐性肺結核症に対する小児、並びに、妊婦又は妊娠している可能性のある
女性の適応に関する考察】
MFLX は既承認の効能・効果において、国内外ともに小児、並びに、妊婦又は妊
娠している可能性のある女性の用法・用量は設定されていない。
MFLX の国内添付文書においても、小児に対しては、動物実験(幼若イヌ、幼若
ラット)で、キノロン系抗菌剤に特徴的な関節部の軟骨障害が認められていること、
また、小児等(低体重出生児、新生児、乳児、幼児又は小児)を対象とした臨床試
136